«БЛИЗНЕЦЫ» В МИРЕ АТОМОВ
Для получения атомной энергии большое значение имело одно очень важное открытие. При изучении химических элементов учёные обнаружили, что многие элементы состоят из нескольких сортов атомов, имеющих одинаковые химические свойства, но различные атомные веса.
|
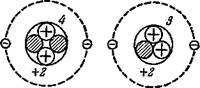
Рис. 2. Природные изотопы гелия. |
Например, оказалось, что в природе существует два сорта атомов гелия: у одних атомный вес равен четырём, у других, более лёгких,— трём. Правда, доля лёгкого гелия чрезвычайно мала: на 1 ООО ООО атомов гелия с массой 4 приходится только 1 атом гелия с массой 3.
Чем же они отличаются друг от друга?
В ядре атома тяжёлого гелия находится четыре частицы — два протона и два нейтрона, а ядро лёгкого гелия содержит на один нейтрон меньше (рис. 2).
И
Мы уже знаем, что место химического элемента в периодической системе Менделеева определяется зарядом ядер его атомов. А эта величина у обоих сортов атомов гелия одинакова, она равна двум. Как атомы тяжёлого, так и атомы лёгкого гелия имеют по два протона в ядре и по два электрона в оболочке. Химические свойства этих элементов одинаковы. Поэтому их помещают в одной и той же (второй) клеточке периодической системы.
Такие атомы называют изотопами («изо» по-гречески— равный, «топос» — место). Изотопы — это различные сорта атомов одного и того же химического элемента, имеющие одинаковые химические свойства, но
|
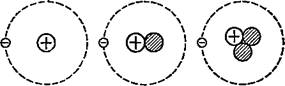
Дтом Дтом Дтом Водорода дейтерия трития Рис. 3. Изотопы водорода. |
Разные атомные веса. Ядра атомов изотопов содержат одинаковое число протонов (одинаковый заряд), но разное число нейтронов; поэтому их массы оказываются различными. Изотопы найдены у большинства химических элементов. Например, олово имеет 10 изотопов, кадмий — 8, ртуть — 7, платина — 6. Самый лёгкий из всех элементов — водород, также имеет изотопы.
Природный водород в основном состоит из атомов с массой, равной единице. Ядром такого атома является протон; вокруг него обращается один электрон (рис. 3). Наряду с этим в природе существует и другой сорт атомов водорода, в два раза более тяжёлых. Ядра атомов тяжёлого водорода состоят из двух частиц—протона и нейтрона. Такой водород называют дейтерием. Количество его очень невелико: на 6000 атомов лёгкого водорода приходится обычно только 1 атом дейтерия.
Учёным удалось искусственным путём приготовить ещё один сорт атомов водорода — сверхтяжёлый водород, или тритий. В ядра атомов трития входят уже три частицы: протон и два нейтрона (см. рис. 3). Следовательно, каждый атом трития в 3 раза тяжелее атома лёгкого водорода.
Дейтерий и тритий имеют большое значение для производства атомной энергии и создания атомного оружия. О том, как их используют, будет рассказано далее.
Основным источником атомной энергии является уран. Исследования показали, что природный уран имеет три изотопа, массы которых равны 238, 235 и 234. Основным в природном уране является наиболее тяжёлый изотоп — уран 238, доля урана 235 составляет
Щ, а урана 234 — всего лишь около 2о1юо * ^Рана 234 так мало, что он практического значения не имеет.