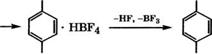Ароматические углеводороды: Выделение, применение, рынок
ТОЛУОЛ
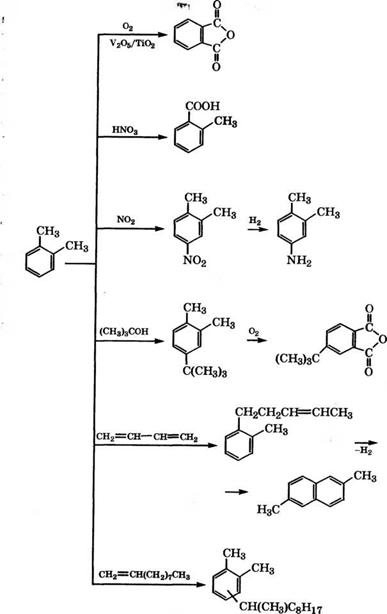
Основные промышленные и перспективные направления применения толуола в органическом синтезе представлены на схеме (рис. 9, см. стр. 214, 215).
Значительная часть толуола до последнего времени превращалась в бензол и ксилолы с использованием процессов гидроде- алкилирования и диспропорционирования. Так, в США в 1976 г. 32 % бензола было получено гидродеалкилированием толуола, в Западной Европе - 20 % [1]. В последующие годы доля бензола, получаемого из толуола, уменьшилась.
Гидродеметилирование толуола осуществляется термическим и каталитическим способами. Термическое гидродеметилирование проводится при 750-790 °С, давлении 4-5 МПа, объемной скорости подачи сырья 4-7 ч-1, при мольном соотношении Н2: сырье = 4:1, расходе водорода 1.1 % (мае.). При этих условиях селективность образования бензола составляет около 90 % при конверсии толуола за один проход 75-80 % [2]. В оптимальных условиях выход бензола достигает 79 %. В качестве побочных продуктов образуются высококипящие арены, состоящие на 50-60 % (мае.) из бифенила, около 20 % (мае.) фенилтолуола, флуорена.
Широкое применение при гидродеметилировании толуола получили каталитические процессы с использованием алюмомо - либденовых или алюмохромовых катализаторов, содержащих 10-12 % (мае.) оксидов Мо или Сг на А1203 Температура каталитического процесса может быть снижена до 600-650 °С, давление 4-5 МПа, скорость подачи сырья 1ч“1, мольное соотношение Н2: толуол = 3 : 1. Выход бензола из-за снижения конверсии толуола составляет около 60 %.
Деалкилирование толуола в присутствии водяного пара позволяет снизить температуру процесса до 350-400 °С при использовании №-Сг-катализатора, селективность образования бензола около 90 % [3]. При применении или Рс1-катали - заторов селективность повышается до 96-98 % при достаточно высокой активности. Более высокая степень конверсии толуола достигается на Rh-катализаторе, однако он способствует и протеканию побочной реакции расщепления ароматического кольца, в результате селективность по бензолу снижается до 85- 87 % [4].
Деалкилирование толуола может проводиться в газовой фазе с С02 в присутствии Pd-катализаторов на А1203, промотирован - ных оксидами La, Sm, Y или Се, повышающими активность и селективность. Так, при использовании катализатора 0.5 % PdLa/Al2Og при массовом отношении Pd:La= 1 : 10 селективность образования бензола при 400 °С 89.5 % [5].
Еще более селективен катализатор 0.5 % PdFe/Al203 при массовом отношении Pd : Fe = 1 : 10 - селективность образования бензола при 500 °С составляет 94.1 % [6].
Диспропорционирование толуола - промышленный метод производства бензола и ксилолов, в котором обычно используются кислотные цеолитные катализаторы. Наибольший интерес представляет применение модифицированного цеолита ZSM-5 благодаря его высокой стойкости к дезактивации коксом и высокой селективности образования наиболее ценного изомера - п - ксилола [7, 8]. Отсутствие больших полостей в структуре цеолита ZSM-5 препятствует образованию полиаренов как предшественников кокса [9]. Низкая концентрация кислотных центров, характерная для этого цеолита, также обуславливает устойчивость этого катализатора к закоксовыванию [10].
Кинетика дезактивации катализатора SiMg/ZSM-5 в реакции диспропорционирования толуола исследована в работе [11]. Установлено, что экспериментальные данные описываются наилучшим образом кинетической моделью, в которой принимается толуол в качестве предшественника кокса.
Фирма «Mobil Oil Corp.» запатентовала использование в процессе диспропорционирования толуола цеолитных катализаторов, например ZSM-5, активированного 2-6-кратной обработкой водорастворимыми кремнийорганическими полимерами - про - пиламиносилановым полимером, другими силиконами, силана - ми, алкоксисиланами в воде или водном растворителе с последующим кальцинированием. Селективность получения п-ксилола на таких активированных цеолитах составляет 80-90 % [12, 13]. Той же фирмой предложено проводить трехкратную модификацию цеолитного катализатора раствором диметил-фенил-ме- тилполисилоксана в додекане. Селективность образования п-кси - лола при диспропорционировании толуола возрастает при этом до 92 % [14].
02NTJ, N02
|
V |
![]() Н2 HNO,
Н2 HNO,
*■ СбНв + СН4
|
|
TOC o "1-5" h z ------------- ► СбНв + СвН4(СНз)2 s' NO2
HNO3 '/Н2 СОС1,
H2S04 СНзСбНз(К02)2 ------------------------------------------------------- CH3C6H3(NH2)2 ► CH3C6H3(NCO)2
О2 „ „ ____ н2 ^ тт NOHSO4 _ /
V2o5 СбН5СООН СбНнСООН l/NH
I-- ^ С6Н5ОН + со2 S)
2
|
СН3 |
![]() С6Н5СНО
С6Н5СНО
Hno3, h, so4 н2
----------------- ► ch3c6h4no2 —► ch3c6h4nh2
Cl, н20, NaOH
-2-*» СеН5СН2С1 —----------------- ► С6Н5СН2ОН
NaCN
|
Cl, |
![]()
|
С6Н5СНС12 |
![]() ---------- ► c6h5ch2cn
---------- ► c6h5ch2cn
Cl,
C6H5CC13
Cl! CH3C6H4C1 ^ CH3C6H4OH
FeCl3 о О * Na0H
NH3, 02
- c6h5cn
NP + BF3
HgC CHO
CO
CH3OH
— ^ ► Н3С-^^-СН3
-2 ——► H3C—CH2CH3 H3C—CH—CH2
(CH3)2CHOH /®
— - H3C—Y^>—CH(CH3)2
CH3
1 sS°3H
|
S03H |
![]()
![]()
|
CH3 |
![]() H2SO-4 CH3C6H4S03H fj
H2SO-4 CH3C6H4S03H fj
S02CU0H2^ СНзСбН43о2С1 JEv CH3C6H4S02NH2
C6H5CH2C1
. -*■ (C6H5CH2)2C6H3CH3
-Д-“ CH3C6H4C20H41
Олигомеры— ^ cHqC6H4R CH3C6H3(S03H)R —сульфонатные присадки
Пропилена out
I
CH3COOH + o2 ^ СбН5СН20(0)ССНз
0
CH3C6Hn
Рис. 9. Направления использования толуола
Конверсия толуола при использовании цеолита с мольным отношением Si02 : А1203 не более 60, модифицированного крем - нийорганическими соединениями, достигает 40 % [15].
Диспропорционирование толуола предлагается проводить при температуре ниже 600 °С в присутствии Н2 и цеолита ZSM-5 с модулем Si02/Al203 = 15-40 в Na-H-Mg-модификации [16].
При диспропорционировании моноалкилбензолов их реакционная способность изменяется в ряду: кумол > к-пропилбензол >
> этилбензол > толуол. Сопоставлена активность различных цеолитов (H-ZSM-5, Y, морденит, Р) и установлено, что активность зависит от кислотности цеолитов, типа моноалкилбензола и механизма реакции [17].
При проведении диспропорционирования толуола в присутствии цеолита МСМ-49 образуются бензол и ксилолы с селективностью 42 и 57 % соответственно [18].
Компания «Fina Techonoly, Inc.» запатентовала способ диспропорционирования толуола пропусканием смеси Н2 и толуола в массовом соотношении (3.5-4.5): 1 при 250-480°С и давлении до 4.2 МПа над модифицированным обработкой водяным паром и промотированным Ni (0.3-0.8 % (мае.)) цеолитом со, содержащим Si и А1 в мольном соотношении (35-40): 1. При температуре процесса 280 °С конверсия толуола 46-48 %, содержание бензола в продуктах диспропорционирования составляет 40-41 % (мае.), ксилолов 58-59 % (мае.) и менее 1 % (мае.) - жидких неароматических побочных продуктов [19].
Исследованиями каталитической активности цеолита ZSM-11 с мольным соотношением Si : А1 = (31-176): 1 установлено, что цеолиты H-ZSM-11 с низким отношением Si : А1 эффективны в реакции диспропорционирования толуола, со средним — при изомеризации ж-ксилола и с высоким - при алкилировании толуола метанолом [20].
Для быстрого достижения оптимальной селективности по бензолу и ксилолам при диспропорционировании толуола на мор- денитовом катализаторе, модифицированном металлом, рекомендуется использовать необычно низкое соотношение Н2: толуол, пока не стабилизируется количество побочно образующихся неароматических углеводородов [21].
Трансалкилированием толуола и аренов С9, например, в присутствии цеолита Р получают ксилолы, причем выход их максимален при использовании эквимолярного соотношения реагентов [22].
Одно из важнейших направлений применения толуола - производство то луи лен диизоцианатов.
Необходимый для их производства динитротолуол получают обычно двухстадийным нитрованием толуола нитрующей смесью. На первой стадии нитрования до мононитротолуолов может быть использована нитрующая смесь, например, следующего состава, % (мае.): HN03 - 3.0, H2S04 - 72.4, Н20 - 24.6 %. На второй стадии кислотную фазу укрепляют азотной и серной кислотами, получая нитрующую смесь состава, % (мае.): HN03 - 3.6, H2S04 - 79.9, Н20 - 16.5. Выход смеси динитротолуолов составляет 99 % [23].
Возможно одностадийное получение динитротолуола нитрованием толуола в адиабатических условиях нитрующей смесью состава, % (мае.): HN03 1-20, H2S04 60-90, Н20 - не менее 5 при мольном соотношении HN03 : толуол не менее 2:1. Нитрующая смесь может содержать до 20 % (мае.) динитротолуолов. Температура реакционной смеси на выходе из реактора 120-160 °С. Состав продуктов реакции при конечной температуре 160 °С, % (мае.): 2,4-, 2,6- и 2,3-динитротолуолы - 76, 19 и 4.5 соответственно. Концентрации моно - и тринитротолуолов не превышают 1000 ррш [24].
Компания «Olin Corp.» запатентовала процесс получения динитротолуолов жидкофазным нитрованием толуола 90-96 % - й HN03 без H2S04 при 40-54 °С и мольном соотношении HN03 : : толуол = (17-20): 1. Динитротолуолы получаются с низким содержанием побочных продуктов - нитрокрезолов - менее 350 ррш [25]. В следующем патенте той же фирмы предложено проводить нитрование при температуре до 60 °С, времени пребывания в реакторе до 0.5 ч и меньшем мольном соотношении HN03: толуол = = (11—12): 1 [26].
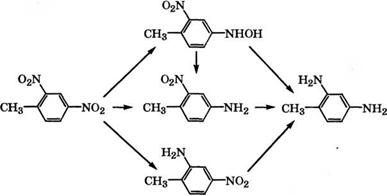
Восстановлением смеси 2,4- и 2,6-динитротолуолов железом в H2S04 при 100 °С или гидрированием над Ni Ренея в метаноле при 120 °С и давлении 4.8-6.2 МПа в промышленности получают смесь толуилендиаминов [27].
Так, фирма «Bayer AG» запатентовала способ получения то- луилендиизоцианатов, включающий гидрирование динитротолуолов на Ni Ренея в присутствии растворителя или разбавителя с последующей отгонкой воды, растворителя или разбавителя в системе из двух ректификационных колонн. Фосгениро - ванием сухой смеси толуилендиаминов получают смесь 2,4- и
2,6- толуилендиизоцианатов (состава 79.4 и 20.6 % (мае.) соответственно) [28].
В качестве катализатора гидрирования динитротолуолов может использоваться Pd/Si02, модифицированный вторым метал - лическим компонентом - Cu, Sn, Fe [29] или Pd/C [30].
В результате исследования кинетики и механизма жидкофазного гидрирования 2,4-динитротолуола в присутствии 5 % (мае.) Р(1/С при 5-50 °С и давлении 0.1 МПа в этанольном растворе установлено, что лучше всего с экспериментальными данными согласуется следующая схема образования 2,4-диаминотолуола
[31]:
|
|
Толуилендиамины, в частности 2,4-изомер, применяются в производстве красителей для меха, сернистых, основных, прямых и азиновых красителей. Так, к группе азиновых красителей относятся сафранины, наиболее известный из которых сафранин Ж
|
|
Получают окислением эквимолярной смеси 2,4-толуилендиамина, о-толуидина и анилина К2Сг207 в кислой среде.
Однако основное направление применения толуилендиами - нов - производство диизоцианатов для синтеза полиуретанов. Кроме того, 2,4- и 2,6-толуилендиизоцианаты используются в качестве ускорителей вулканизации каучуков.
Толуилендиизоцианаты получают в промышленности фосге - нированием диаминотолуолов одно - или двухстадийным методом. Одностадийный процесс проводится обычно в растворе о-дихлорбензола при мольном соотношении фосген : диаминотолуо - лы = 6:1, температуре 200-210°С, давлении 4.2-5 МПа, времени пребывания в реакторе 40-50 с [32]:
CH3C6H3(NH2)2 + 2СОС12 — CH3C6H3(NCO)2 + 4НС1 + 52.4 кДж/моль
Выход толуилендиизоцианатов 90-96 %.
Двухстадийное фосгенирование проводится 25-50 %-м раствором фосгена в о-дихлорбензоле:
С0С12
CH3C6H3(NH2)2 + СОС12 — NH2C6H3NHC0C1 ■ HCl -------------------- ►
— CH3C6H3(NCO)2 + 4НС1
Температура процесса на первой стадии 60-80 °С, на второй стадии 180-200 °С, выход толуилендиизоцианатов достигает 96 %.
Крупнейший производитель ароматических диизоцианатов фирма «Bayer AG» запатентовала способ их получения взаимодействием диамина, возможно разбавленного инертным газом или растворителем, с фосгеном в газовой фазе при температуре выше температуры кипения диамина и времени пребывания в реакторе 0.5-5 с [33].
Французская фирма «Rhone-Poulenc Chimie» предложила способ получения толуилендиаминов газофазным фосгенирова - нием 10%-го раствора 2,4-толуилендиамина в о-дихлорбензоле при массовом соотношении СОС12: 2,4-толуилендиамин = 5:1, температуре 320°С, давлении 0.13 МПа и времени пребывания в реакторе 1.8 с. При этих условиях происходит полная конверсия толуилендиаминов с выходом 2,4-толуилендиизоцианата 92 % [34]. Та же фирма запатентовала проведение процесса в реакторе, состоящем из двух зон - при этом повышается рентабельность, устраняется необходимость рециркуляции фосгена, выход толуилендиизоцианата возрастает до 95 % [35].
Двухстадийный способ получения ароматических ди- или полиизоцианатов предусматривает на первой стадии взаимодействие раствора амина с избытком фосгена при 20-35 °С с отводом теплоты и на второй стадии - проведение процесса при нагревании [36].
Предложены также различные бесфосгенные методы получения ароматических изоцианатов [37], однако широкого промышленного применения они не получили.
Японские фирмы «Takeda Chemical Industries Ltd.» и «Kobe Steel» разработали способ рециркуляции 2,4-толуилендиизоцианата из кубовых остатков, образующихся при его ректификации. Этот способ применяется на промышленной установке в г. Ка - шима. Кубовые остатки обрабатывают водой при 374°С и давлении 22 МПа, в результате чего извлекается около 80 % продукта, который превращается при гидролизе в диаминотолуол, выделяемый дистилляцией и перерабатываемый затем в толуилен- диизоцианат [38].
Толуилендиизоцианаты применяются в производстве полиуретанов, пенополиуретанов, уретановых эластомеров, в качестве сшивающих агентов при получении найлона 6, вулканизующих агентов резиновых смесей, в производстве лаков, красок, клеев, пропиточных составов.
В качестве гидроксилсодержащих компонентов при производстве полиуретанов используют олигогликоли и сложные полиэфиры с концевыми группами ОН, получаемые поликонденсацией дикарбоновых кислот, например фталевой кислоты, с гликолями. В процессе производства полиуретанов используют также агенты удлинения и структурирования цепей - гидроксилсодержащие соединения (воду, гликоли, оксиэтилирован - ный бисфенол А) и диамины (бис(4-амино-3-хлорфенил)метан, фенилендиамины). Катализаторами реакций получения линейных полиуретанов служат третичные амины, нафтенаты РЬ и вп, октаноат и лауринат вп, хелатные соединения Ее, Си, Ве,
V [39].
Толуилендиизоцианаты, как и дифенилметандиизоцианаты, применяются также для производства блокированных изоцианатов, получаемых взаимодействием с соединениями, имеющими активный атом водорода, - фенолами или е-капролактамом. Блокированные изоцианаты имеют общую формулу 1ШНС(0)А, где А - остаток блокирующего агента НА. Частично или полностью блокированные изоцианаты применяются в качестве отвер - дителей клеев, лаков, красок, как компоненты пропиточных составов для бумаги, полиэфирных волокон и тканей, вулканизующие агенты, модификаторы, улучшающие свойства полимеров [40].
Ароматические уретаны могут быть синтезированы и взаимодействием аминов, в частности 2,4-диаминотолуола, с карбонатами (этилен-, пропиленкарбонатом, диметил-, диэтил-, ди - пропилкарбонатом) при 100-190 °С в присутствии кислот Льюиса (хлоридов Zn и вп или солей этих металлов с органическими карбоновыми кислотами) в количестве 1-10 % (мол.) и 10-40 % (мол.) спирта от количества спирта, выделяющегося при реакции [41].
Окисление толуола - основной промышленный способ производства бензойной кислоты [42]. Ранее бензойную кислоту получали декарбоксилированием фталевого ангидрида, однако себестоимость ее производства была очень высокой. Выпуск бензойной кислоты на основе фталевого ангидрида осуществлялся, в частности, Рубежанским ПО «Краситель».
В 1986 г. в ПО «Сланцехим» (г. Кохтла-Ярве) был введен в действие цех мощностью 40 тыс. т/год бензойной кислоты, получаемой из толуола, и 15 тыс. т/год консерванта животноводческих кормов силобен. Окисление толуола осуществляется воздухом или кислородо-воздушной смесью при 170-180 °С и давлении около 0.8 МПа в реакторе колонного типа. Катализатором служит смесь солей Мп и Со, промотированных бромидом Na, содержание катализатора 0.05 % (мае.).
Впервые комбинированный катализатор, содержащий Со, Мп и Вг, применила при производстве бензойной кислоты фирма «Mid-Century”, первый завод был построен в Англии в 1964 г. [43].
Состав реакционной смеси при жидкофазном окислении толуола следующий, % (мае.): бензойная кислота - 94.2, толуол -
3.0, бензилбензоат - 0.9, бензальдегид - 0.6, бифенил - 0.2, прочие примеси — 1.1. При ректификации реакционной смеси образуются высококипящие отходы, которые растворяют в ацетоне и сжигают. При термическом обезвреживании отходов теряется до 170 кг сырьевых и промежуточных компонентов на 1 т бензойной кислоты. Исследованием равновесия жидкость - пар в бинарных системах, включающих компоненты реакционной смеси, установлено, что все они зеотропны, кроме системы бензойная кислота - бифенил, для которой ранее найден азеотроп с минимальной температурой кипения. Предложено выделять из реакционной смеси не только толуол, но и бензальдегид с возвратом в реактор. Возможно и разделение азеотропной смеси бензойная кислота - бифенил сочетанием ректификации и кристаллизации [44].
Ранее предлагалось извлекать бензойную кислоту из кубовых остатков ректификации продуктов окисления толуола экстракцией. Кубовый остаток содержит, % (мае.): бензойная кислота - 30, бензилбензоат - 12, циклогексанкарбоновые кислоты - 13, фталевая кислота - 1.7, бензальдегид - 0.4. При экстракции смесями ацетона (или метанола, этанола) и воды, взятыми в массовом соотношении 1:2, степень извлечения бензойной кислоты 90-92 %. В связи с тем что выделенная экстракцией бензойная кислота содержит около 10 % (мае.) примесей, ее предложено возвращать в цикл на окисление [45].
В качестве катализатора в производстве бензойной кислоты парофазным оксилением толуола широко применяется V205 [46]. Добавление Sb203 к V205/Ti02 повышает выход бензойной кислоты [47].
При содержании У205 и 8Ь203 в катализаторе 5 и 2 % (мае.) соответственно, температуре процесса окисления толуола 350°С, мольном отношении толуол : 02: Н20 = 1 : 2.5 : 57 выход бензойной кислоты составляет 62 % при селективности ее образования 75 %. Дальнейшее повышение выхода кислоты до 66 % и селективности до 80 % происходит при дополнительном модифицировании катализатора добавлением 1 % (мае.) Те02. При 2 % (мае.) Те02 селективность образования бензойной кислоты возрастает до 83 %, однако конверсия толуола снижается с 82 до 76 %. Катализатор достаточно стабилен - селективность по бензойной кислоте через 100 ч работы сохраняется на уровне выше 80 % [48].
Модифицирование У205/ТЮ2 такими диэлектриками, как Мо03, ¥03, 1ЧЬ205 и Та205, повышает селективность окисления толуола в бензойную кислоту, а при добавлении Се02, Т120, К20 и Р205 активность и селективность снижаются по сравнению с исходным катализатором [49].
Сравнительное изучение кинетики окисления толуола в паровой фазе на катализаторах с перовскитной структурой позволило установить следующий ряд их активности: ЬаСо03 > ЬаГе03 >
> ЬаСг03. В этом же ряду катализаторов энергия активации повышается от 13.4 до 25.3 кДж/моль. Максимальную активность катализаторы проявляют при 450°С [50].
При парофазном окислении толуола основные побочные продукты - С02 и СО; суммарная селективность их образования составляет 17-21% при мольном соотношении СО : С02= 0.010- 0.045. Основной жидкий побочный продукт - бензальдегид, получающийся с селективностью 1-2 %.
Суммарная селективность образования прочих жидких продуктов (бензола, малеинового и фталевого ангидридов, бензофе - нона и антрахинона) не превышает 1-2 % [48].
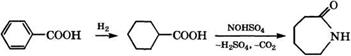
Гидрированием бензойной кислоты и нитрозированием образующейся циклогексанкарбоновой кислоты получают капролак - там:
|
|
Схема производства капролактама из толуола была разработана и реализована в 1961 г. итальянской фирмой «вша У1Б - соэа» совместно с Миланским политехническим институтом [51].
! Гидрирование циклогексанкарбоновой кислоты проводят в жидкой фазе при 170°С и давлении 1-1.5 МПа в присутствии 5 % (мае.) Рс1 на угле в каскаде реакторов с мешалками [52, 53].
Для получения нитрозилсерной кислоты аммиак сжигают в воздухе над платиновой сеткой при 600 °С и образующиеся оксиды азота после охлаждения абсорбируют олеумом. Нитрозилсер - ная кислота взаимодействует с олеумным раствором циклогексанкарбоновой кислоты при 80 °С, необходимая температура поддерживается за счет испарения циклогексана, подаваемого в реактор.
Расходные коэффициенты при производстве 1 т капролакта - ма из толуола: толуол — 1.11 т, аммиак - 1.25 т, олеум (36 %-й) - 3.1 т, Н2 - 900 м3.
Себестоимость производства капролактама из толуола ниже, чем из фенола, но несколько выше, чем из бензола. Капитальные затраты на строительство установки по толуольной схеме максимальные, а по фенольной - минимальные [53].
Бензойная кислота применяется также для производства фенола [54]:
2С6Н5СООН + 1/2 02 — С6Н5С(0)0С6Н5 + Н20 + со2 С6Н5С(0)0С6Н5 + Н20 — С6Н5ОН + С6Н5СООН
Фирма «Боу СЬет1са1 Со.» впервые реализовала процесс производства фенола из бензойной кислоты в 1961 г.
Селективным окислением толуола в присутствии оксидов Мо, V, Се получают бензальдегид. Так, отмечена высокая активность каталитической системы, состоящей из ультрадисперсных частиц Ее2(Мо04)3 (20-40 нм) и Ге203 (10-20 нм) при температуре процесса 350 °С и давлении 0.2 МПа [55]. При конверсии толуола 65.8 % в присутствии Ее2(Мо04)3 селективность образования бен - зальдегида 39.8 %, выход 26.2 %. Еще более селективен катализатор Се2(Мо04)3 - 52.3 %, выход бензальдегида 31.5 % [56].
Менее эффективна смесь Се02 и Мо03 при соотношении Се/Мо = 2: при температуре реакции 450°С и соотношении воздух/толуол = 10 селективность образования бензальдегида 29.2%, выход 14.3 % [57].
Исследованиями кинетики окисления толуола в бензальдегид на слоистых катализаторах В12Мо06 и Ьа2Мо06 установлен первый порядок реакции [58].
Высокую активность и селективность при окислении толуола в бензальдегид проявляет марганцевый катализатор на аморфном микропористом силикагеле при оптимальной температуре реакции 469 °С [59]. В качестве катализаторов той же реакции исследованы также V205-K2S04-Zn0-Si02 [60], K-V205 [61], V205-K2S04-Si02[62].
В Японии с 1988 г. на заводе в г. Куросаки эксплуатируется установка производительностью 2 тыс. т/год бензальдегида, получаемого гидрированием бензойной кислоты в газовой фазе над оксидным цирконий-хромовым катализатором при 350-400 °С и давлении 0.3 МПа [63].
Процесс фирмы «Mitsubishi Kasei» отличается высокой селективностью по бензальдегиду - 96 % при конверсии бензойной кислоты 98 % [64].
Еще выше выход бензальдегида в процессе, предложенном фирмой «Hoechst AG» с катализатором на основе ZnO и 1 ррт As. При 350 °С отмечается полная конверсия бензойной кислоты при селективности 98 % [65].
Компанией «BASF AG» запатентован способ получения бензальдегида и его 4-алкил - или 4-метоксипроизводных гидрированием соответствующих кислот при 340-360 °С на катализаторе Zr02, содержащем на поверхности 3 %(мас.) лантанидов (La, Pr или Се) в форме оксидов. Выходы альдегидов приближаются к количественным [66].
При использовании немодифицированного Zr02 при гидрировании бензойной кислоты при 350-400 °С селективность образования бензальдегида составляет 97 %, однако конверсия кислоты низкая - 51 %. Модифицирование катализатора Сг203 при атомном отношении Cr/Zr = 5/100 повышает конверсию бензойной кислоты до 98 % при селективности по бензальдегиду 96 % [67].
Исследовано применение и других добавок, модифицирующих Zr02, - Y203, MgO, Ti02, ZnO, однако все они снижают селективность образования бензальдегида [68].
В качестве сырья для производства бензальдегида каталитическим гидрированием вместо бензойной кислоты может использоваться метилбензоат. Наиболее активен в этом процессе Mn-Zr-катализатор с атомным отношением Mn/Zr = 0.05 [69].
Бензальдегид и его производные получают также гидролизом соответствующих бензальхлоридов водными растворами H2S04 при температуре около 140 °С. Выход бензальдегида достигает 98 % [70].
Бензальдегид можно получать по реакции Гаттермана - Коха из бензола и СО в присутствии НС1 и А1С13, а также каталитическим окислением бензилового спирта.
Бензальдегид применяется как душистое вещество в парфюмерии, компонент пищевых эссенций, сырье для синтеза душистых веществ - коричного альдегида и коричной кислоты, аце - талей бензальдегида, жасминальдегида и др. Так, коричная кислота образуется по реакции Перкина:
С6Н5СНО + (СН3С0)20 — С6Н5СН=СНСООН
При конденсации бензальдегида с фенолом или третичными ароматическими аминами образуются производные трифенилме - ! тана, применяющиеся в производстве красителей.
Бензальдегид применяется и в фармацевтической промыш - ’ ленности для получения гидрохлорида эфедрина - сосудосуживающего и бронхорасширяющего средства, хлорамфеникола и других лекарств [71].
Парофазным хлорированием бензальдегида при 290-310 °С в присутствии модифицированных оксидом меди хлоридов Си, Са, Ni или Pd на носителе при времени контакта 0.5-2.0 с можно получать бензоилхлорид [72]. Бензоилхлорид применяется как бензоилирующее средство при синтезе индигоидных красителей, в производстве пероксида бензоила и лекарственных средств.
Нитрованием бензальдегида получают ж-нитробензальдегид, который восстанавливают далее железом до ж-аминобензальде- гида, применяющегося в производстве трифенилметановых красителей. Выход ж-нитробензальдегида повышается, уменьшается количество других изомеров, что облегчает выделение продукта при предварительном переводе бензальдегида в основание Шиффа и нитровании последнего [73].
Процессы нитрования толуола до моно-, ди - и тринитропро - изводных, а также направления использования полученных нитропродуктов рассмотрены в монографии [27].
Нитрованием толуола в жидкой фазе нитрующей смесью состава, % (мае.): HN03 28-32, H2S04 55-66, Н20 12-20 получают смесь мононитротолуолов, содержащую 55-60 % 2-нитро-, 3-4 %
3- нитро - и 35-40 % (мае.) 4-нитротолуола.
Компанией «Nippon Kagaku» запатентован процесс получения ароматических нитросоединений без применения минеральной кислоты, не загрязняющий окружающую среду. Раствор толуола, например, в дихлорметане обрабатывают при -10 °С N02 и кислородом или воздухом, содержащим озон, в присутствии цеолитов, катионообменных смол. При продолжительности реакции 3 ч выход нитротолуолов с использованием цеолитных катализаторов составляет 76 %. Полученная смесь нитропродуктов содержит о-, м - и тг-нитротолуолы в количестве 57, 2.4 и 40 % (мае.) соответственно [74].
.гАиследовгши жидкицжаное моноиитрование толуола на различных твердых кислотных катализаторах и установлено, что наибольшую активность и пара-селективность проявляет цеолит H-ZSM-5 с высоким соотношением Si/Al [75]. Нитрование протекает в каналах пор цеолита, причем пара-селективность реакции связана с размером пор цеолита. Нитрование толуола ускоряется за счет диссоциации HN03 с образованием нитроний-катиона и за счет активации и адсорбции толуола на катализаторе, поэтому его активность зависит не только от кислотных свойств, но и от гидрофобности катализатора.
Разработан процесс нитрования толуола с селективностью образования n-нитротолуола до 95 % с использованием нитрата меди на глине или цеолита типа H-ZSM-5. В последнем случае толуол нитруют и-пропилнитратом, при этом удешевляется отделение n-нитротолуола от примесей [76].
Возможно газофазное нитрование толуола HN03 при 100- 140°С в присутствии 5 % - го раствора H2S04, нанесенной на Si02 или А1203. В продуктах газофазного нитрования соотношение тг /о-изо - меров составляет 1.84, конверсия толуола 61 % [27].
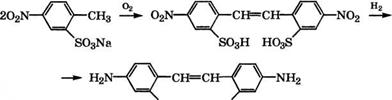
Сульфированием n-нитротолуола S03 при 75-80 °С в дихлорэтане получают 4-нитротолуол-2-сульфокислоту с выходом 98 % [77].
Окислением раствора Na-соли 4-нитротолуол-2-сульфокислоты воздухом при 48-62 °С в присутствии MnS04 или NaClO получают 4,4'-динитростильбен-2,2'-дисульфокислоту и последующим восстановлением нитрогрупп чугунной стружкой в водном растворе СН3СООН при 95-100°С - 4,4'-диаминостильбен-2,2'- дисульфокислоту:
|
ВОзН НОзв |
В качестве растворителей при окислении Ыа-соли 4-нитро - толуол-2-сульфокислоты предложено использовать смеси воды со спиртами, простыми или сложными эфирами, ацеталями [78], оксиэтилированными спиртами [79], углеводородами с добавками ПАВ [80]. Окисление 4-нитротолуол-2-сульфокислоты возможно при -15 °С кислородом в растворе полиамина, например пропилен-1,2-диамина, ЫаОН и МпБ04 [81].
4,4 - Диаминостильбен-2,2 - дисульфокислота используется как диазосоставляющая в производстве прямых красителей для хлопка и кожи, активных красителей, а также для получения оптических отбеливателей для тканей и бумаги.
Жидкофазным окислением п-нитротолуола кислородом воздуха в среде СНдСООН при 170-180°С, давлении 1.6 МПа в присутствии ацетатов Со или Мп, а также стеарата Со получают 4-ни - тробензойную кислоту [82]. При окислении тг-нитротолуола в смеси бензола и метанола, взятой в объемном отношении 5:1, при 50 °С и парциальном давлении кислорода 2 МПа получается 4-нитро - бензойная кислота чистотой 99.6 % с выходом 66.4 % [83].
Окисление п-нитротолуола кислородом воздуха в уксусной кислоте в присутствии каталитического количества ацетата Со и МаВг при 130-135°С и давлении 2.94 МПа в течение 5 ч повышает выход 4-нитробензойной кислоты до 94.7 % и степень чистоты — до 99.96 % [84].
2-Нитробензойная кислота производится окислением о-нитро - толуола 15-20 %-й НМ03 при 160-165 °С и давлении 1.6-2 МПа. В качестве окислителя могут также использоваться Ма2Сг207 или Мп02 [82]. Окисление может проводиться и кислородом воздуха в растворителе в присутствии солей каталитически активных металлов [85].
Из 4-нитробензойной кислоты и ГШ3 при нагревании в среде органического растворителя и в присутствии каталитической системы: Н3В03 или (С4Н90)4Т1 или диметилфосфита и сокатали - затора - полиэтиленгликоля с молярной массой 400-5000 получают 4-нитробензамид [86]. 4-Нитробензамид используют в синтезе светостойких азопигментов; красителей, полимерных материалов.
Взаимодействием 4-нитробензойной кислоты с фосгеном в среде хлорбензола с добавкой 4-нитробензоилхлорида в присутствии каталитических количеств диметилформамида возможно получение 4-нитробензоилхлорида. Процесс рекомендуется вести в трех реакционных зонах при температуре в первой и второй зонах 60-80 °С и в третьей зоне 15-40°С с подачей катализатора во вторую зону, а фосгена - в первую и вторую зоны [87]. Полученный продукт применяется в синтезе красителей, фармацевтических препаратов, термостойких волокон и кинофотоматериалов.
Ацилированием 2,4-динитроанилина 4-нитробензойной кислотой в среде хлорбензола при кипячении раствора в присутствии активатора - полихлорциклофосфазена и катализатора - Г^- оксида пиридина или 1М-оксидов пиколинов получен 2',4,4'-три - нитробензанилид [88]:
|
|
|
02N |
|
|
|
О |
|
■Ш2 + Н20 |
|
02N |
![]()
|
СООН+ н2к |
![]() Полученный продукт применяется в синтезе мономеров для термостойких волокон.
Полученный продукт применяется в синтезе мономеров для термостойких волокон.
Восстановлением нитробензойных кислот железом в НС1 при гидрировании водных растворов в присутствии Pt при 85 °С получают аминобензойные кислоты. Производные 4-аминобензой - ной кислоты применяются для синтеза лекарственных средств, тиоиндигоидных красителей и азокрасителей, ж Аминобензойная кислота используется в производстве кубовых красителей и азокрасителей, реактивов для цветной фотографии.
4-Аминобензойная кислота может быть получена и электрохимическим методом [89]. д-Нитротолуол окисляют Ка2Сг207 в кислой среде с последующей регенерацией отработанных солей Сг электрохимическим окислением. На второй стадии д-нитро - бензойную кислоту электрохимически восстанавливают в сернокислотной среде с выходом 89 %. Суммарный выход д-аминобен - зойной кислоты из д-нитротолуола около 60 %.
2-Нитробензойная кислота используется также в синтезе бензидин-3,3'-дикарбоновой кислоты [82].
Карбоксилированием д-нитротолуола при его обработке фенолятами щелочных металлов и С02 в апротонных растворителях с количественным выходом получают д-нитрофенилуксус - ную кислоту [90].
Гидрированием нитротолуолов в присутствии N1, Рс1 или Си в промышленности производятся соответствующие толу ИДИНЫ. Толуидины и их нитропроизводные применяются для получения аминотолуолсульфокислот, крезолов, азокрасителей, трифенил - метановых и сернистых красителей [91]. Конденсацией о-толу - идина с формальдегидом при 130°С в присутствии гг02/\Ю3 с удалением воды в виде азеотропа получают при полной конверсии с выходом 68 % смесь диарилдиаминометанов с соотношением изомеров 4,4': 2,4' = 13.9 [92]. д-Толуидин входит в состав ингибиторов коррозии.
Непрерывным противоточным нитрованием толуола смесью НЖ)3 и Н2804 обычно в несколько стадий при 50-120 °С производится в промышленности 2,4,6-тринитротолуол. Примеси несим
метричных изомеров и дини о ол в яю оор о ко водным раствором Ма2803. 2,4,6-Тринитротолуол (тротил) - основное штатное взрывчатое вещество со скоростью детонации 7000 м/с, широко применяющееся для снаряжения боеприпасов и проведения взрывных работ. Тротил используется как в чистом виде, так и в смесях и сплавах с другими взрывчатыми веществами - гексогеном, тетранитропентаэритритом, аммиачной селитрой [27, 93].
Жидкофазным хлорированием толуола при ультрафиолетовом облучении или в присутствии 2,2'-азо-бис-изобутиронитри - ла при 60-75 °С в промышленности производится бензилхлорид [94].
Гидролизом бензилхлорида водными растворами щелочей производится бензиловый спирт. Бензиловый спирт может быть также получен гидролизом бензиловых эфиров (бензилформиа - та, бензилацетата, бензилпропионата или бензилбензоата) при мольном соотношении воды (10-100): 1 в присутствии кислот. Выход бензилового спирта чистотой 98 % составляет 98 % [95].
Взаимодействием бензилхлорида с МаСМ получают бензил - цианид, использующийся для производства фенилуксусной кислоты, транквилизаторов, например диазепама, фенобарбитона, лекарственных веществ на основе Р-фенилэтиламина (фенфор - мина, фенацемида) [71]. Взаимодействием бензилхлорида с ацетатом N8 получают бензил ацетат.
Хлорированием толуола в промышленности производятся также бензальхлорид и бензотрихлорид. Продукты жидкофазного хлорирования толуола разделяют ректификацией.
Гидролизом бензотрихлорида в присутствии ГеС13 в качестве катализатора при 80 -100°С получают хлорангидрид бензойной кислоты с выходом около 85 % [94]:
С6Н5СС13 + Н20 —► С6Н5СОС1 + 2НС1
При гидролизе бензотрихлорида в избытке воды получается бензойная кислота.
Действием безводного НЕ на бензотрихлорид получают бен - зотрифторид, применяющийся в производстве фармацевтических препаратов, красителей, оптических отбеливателей, пестицидов
[96].
Каталитическим жидкофазным хлорированием толуола в присутствии ЕеС13 получают в промышленности также о - и гс-хлор - толуолы [97]. ж-Хлортолуол синтезируют диазотированием ж-то - луидина с последующим замещением диазогруппы на хлор по реакции Зандмейера.
N-Хлортолуол, имеющий более высокую температуру плавления по сравнению с о - и ж-изомерами (соответственно 7.5, -35.1 и -47.8 °С), может быть выделен кристаллизацией при -6°С из продуктов хлорирования толуола в вертикальной бар - ботажной колонне с медленным током азота [98].
Высокая пара-селективность достигается при хлорировании толуола в присутствии цеолитов и монохлоруксусной кислоты в качестве сокатализатора. Так, при использовании цеолита K-L с мольным отношением Si02/Al203 = 6.32 и массовой доле хлорук - сусной кислоты от катализатора 0.2 при температуре 80 °С получен следующий состав реакционной смеси, % (мае.): толуол-
55.0, п-хлортолуол - 33.5, о-хлортолуол - 10.1, бензилхлорид -
1.4 [99]. Соотношение п - и о-хлортолуолов составило 3.32, в то время как при использовании промышленного катализатора FeCl3 оно равно 0.49. При проведении реакции в среде 1,2-дихлорэтана это соотношение изомеров повышается до 4.05.
Компания «Bayer AG» запатентовала способ хлорирования аренов в ядро, в частности, толуола с достаточно высокой ортоселективностью [100]. В качестве катализаторов предложены смеси FeCl3 или Fe и SbCl3, SbCl5 или As, а сокатализаторов - простые полиэфиры. При хлорировании толуола по предложен-, ному способу соотношение о - и n-хлортолуолов составляет 3.04— 3.28.
Предложен способ получения 2,6-дихлортолуола хлорированием 3,5-ди-трепг-бутилтолуола с последующим трансалкили - рованием образующегося 2,6-дихлор-3,5-ди-пгрепг-бутилтолуола с толуолом [101].
Хлортолуолы применяются в производстве красителей и пестицидов. Так, нитрованием n-хлортолуола при 50-55 °С нитрующей смесью состава, % (мае.): HN03 - 20.4, H2S04 - 63.7, Н20 - 15.9 и продолжительности реакции 1.5 ч получают смесь 2- и З-нитро-4-хлортолуолов в соотношении 65.2 : 34.8 с выходом 99 % [102]. Хлорнитротолуолы используются в синтезе красителей, лекарств и сельскохозяйственных химикатов.
Щелочным гидролизом хлортолуолов можно получать соответствующие крезолы. Так, фирма «Bayer AG» запатентовала способ получения n-крезола щелочным гидролизом п-хлортолу - ола в присутствии медного катализатора, водного раствора NaOH и небольшого количества окислителя (Н202). При температуре 250°С конверсия после выдержки 6 ч составила 99.9%, содержание n-крезола в реакционной смеси 92.5 % (мае.) [103].
Окислением д-хлортолуола Н202 на ванадийсиликатном молекулярном сите можно в одну стадию получить д-хлорбензаль - дегид с селективностью более 65 % [104].
Окислением хлортолуолов могут быть получены хлорбензой - ные кислоты. Так, окислением о-хлортолуола Ка2Сг207 в воде получена о-хлорбензойная кислота, использующаяся в производстве красителей и лекарственных веществ [105].
При жидкофазном хлорировании хлортолуолов газообразным хлором при 80-90 °С и ультрафиолетовом облучении или в присутствии 2,2'-азо-бис-изобутиронитрила получают хлор- бензилхлориды, хлорбензальхлориды и хлорбензотрихлориды
[97].
Бромированием толуола получают смесь о - и тг-бромтолуолов, из которой двухступенчатой кристаллизацией выделяют тг-бром- толуол [106]. Предложен катализатор жидкофазного бромирова - ния толуола: система Вг2 - оксиран - цеолит Ма-У, на которой селективность образования п-бромтолуола достигает 98 %; однако недостаток способа - быстрая дезактивация каталитической системы [107].
Окислительным аммонолизом толуола при 300-450 °С в присутствии оксидов V, Мо или вп в промышленности производится бензонитрил [108, 109].
Активность катализатора (У0)3(Р04)2- 7Н20 возрастает в результате предварительной обработки в аммиаксодержащей среде: конверсия толуола повышается с 4.8 % (при обработке в инертной среде - N2) до 18.8 % при близких значениях селективности образования бензонитрила - 96 и 95 % соответственно [ПО].
Перспективный метод получения бензонитрила - цианирование бензилового спирта, протекающее в присутствии оксидных катализаторов или сульфида Ее по дегидрогенизационной схеме [111]:
-Н2 ]*Нз - Н2
С6Н5СН2ОН --- ► С6Н5СНО с6н5сн=гш —► с6н5см
Реакция проводится при 270°С и атмосферном давлении, селективность образования бензонитрила 17.5 %.
Бензонитрил может быть получен также конверсией метил - бензоата и 1МН3 в присутствии монтмориллонита К-10. Селективность образования бензонитрила при 320 °С составляет 60 %
[112] . Эффективным катализатором парофазного синтеза бензонитрила из метилбензоата и МН3 является фосфат ниобия: селективность по бензонитрилу при 320 °С повышается до 77 %
[113] . Небольшие количества бензонитрила получают дегидратацией бензамида или бензоата аммония.
Бензонитрил применяется в качестве растворителя нитратов и ацетатов целлюлозы, нитрильных каучуков, полистирола, по -
Лиметилметакрилата. Используется он также в производстве гуанамино-формальдегидных смол [108].
Производные бензонитрила используются для получения цианобифенилов. Так, взаимодействием о-бромбензонитрила с галогенидом /г-толилмагния в присутствии смешанных катализаторов — хлоридов Мп и Рс1 или ацетилацетоната N1 в растворителе - получают с выходом 96 % о-(/г-толил)бензонитрил, который может быть использован для синтеза медицинских препаратов [114].
Разработан процесс производства /г-толуилового альдегида из толуола и СО при использовании в качестве катализатора бор - фтористоводородной кислоты [115]:
+нк, +вг3 +со
С6Н5СН3 ------------------ С6Н5СН3 НВГ4 ------------ ►
|
СНО СНО
СН3 СН3 |
Выход /г-толуилового альдегида составляет 95 %. Расходные коэффициенты при получении 1 т тг-толуилового альдегида, т: толуол - 0.814, СО - 0.254; удельные энергозатраты: пар - 6.6 т; электроэнергия - 390 кВт ч; охлаждающая вода - 310 м3.
Установка состоит из шести секций: получение толуольного комплекса с НВР4 в реакторе с мешалкой; образование комплекса /г-толуилового альдегида; разложение комплекса нагреванием в дистилляционной колонне с возвратом большей части регенерированных НР и ВЕ3 в первую секцию и частично в секцию регенерации катализатора; очистка /г-толуилового альдегида ректификацией от толуола, примесей о-толуилового альдегида и триарилметанов; дегидратация катализатора; очистка отходящих газов и сточных вод.
В качестве катализатора при получении /г-толуилового альдегида взаимодействием толуола с СО может служить и три- фторметилсульфоновая кислота. Процесс рекомендуется проводить при 20-40 °С и парциальном давлении СО 7-8 МПа. При продолжительсти реакции 5-45 мин селективность по /г изомеру превышает 95 % [116].
/г-Толуиловый альдегид получают в основном из /г-ксилола, однако, с учетом более низких цен на толуол, рассмотренный процесс считается перспективным. Окислением /г-толуилового альдегида может быть получена терефталевая кислота.
В последние годы проводятся активные исследования реакции региоселективного метилирования толуола в /г-ксилол. Эффективным катализатором метилирования толуола метанолом является цеолит H-ZSM-5. Установлено, что содержание п-ксилола в реакционной смеси возрастает при повышении температуры, увеличении размеров кристаллов цеолита и содержания А1 в нем. Так, при 450°С и отношении Si/Al = 44 ксилолы получаются в следующем соотношении, % (мае.): п-, м - и о-ксилол - 95,
3 и 2 соответственно [117].
При алкилировании толуола метанолом на цеолите H-ZSM-5 при 200 °С изомеры ксилола образуются в соотношении п - : м - : о - = = 1.3 : 1 : 1.6. При повышении температуры до 300 °С пара-селективность повышается до значения более 50 %. Высокая селективность образования /г-ксилола проявляется, когда скорость изомеризации ксилолов превышает скорость алкилирования толуола [118].
Исследованиями молекулярно-ситовой селективности образования /г-ксилола при метилировании толуола в присутствии 20 образцов цеолита ZSM-5 подтверждено, что /гара-селективность сильно зависит от адсорбционных свойств цеолита, обусловленных размером кристаллов [119]. Так, содержание /г-ксилола в смеси изомеров при метилировании толуола при 350 °С на цеолите ZSM-5 повышается с 84 до 100 % (мае.) при увеличении размеров кристаллов с 0.15 мкм (кубической формы) до 50 х 20 х 20 мкм. Однако при этом начальная скорость образования ксилолов на единицу массы цеолита снижается с 15 до 0.51 моль • г'1 • с'1 [120].
Компания «Mobil Oil Corp.» предложила для повышения пара-селективности метилирования толуола модифицировать цеолит H-ZSM-5 добавлением около 1 % (мае.) гексаметилдисилок - сана, диметилфенилсилана, полисилоксана, дисилана или ал - коксисилана, содержащего, по крайней мере, одну Si-H-связь [121].
Повышенная пара-селективность проявляется и при диспро - порционировании моно-С1-С4-алкилбензолов в /г-диалкилбензо - лы и бензол в присутствии цеолитов типов PSH-3, МСМ-22 или МСМ-49 после обработки их селективирующими реагентами - мономерными и полимерными силоксанами^122].
При алкилировании толуола метанолом в присутствии цеолитов типа морденита и фожазита при 500 °С получается преимущественно ж-ксилол, но при уменьшении размера пор в результате модифицирования MgO проявляется /гара селективность. Максимальное ее значение 71.2 % отмечается при содержании MgO 13.8 % (мае.) и температуре реакции 200°С [123].
Еще меньшая пара-селективность проявляется при алкили - ровании толуола метанолом в присутствии кристаллических силикатов, например 0.8Ка20 • 0.67СаС) • А1203- 408Ю2. Так, при 500 °С конверсия толуола составляет 51 %, селективность образования д-ксилола 49 % [124].
Вместо метанола при получении д-ксилола из толуола можно использовать синтез-газ. Катализатором служит цеолит типа ZSM-5, модифицированный соединениями 81, и оксидами Zn, Сг и XV. Процесс алкилирования проводится при 380-440°С, массовой скорости подачи толуола 1-3 ч“1 и объемной скорости синтез-газа 1000-10000 ч“1 [125].
Метилирование толуола с получением в основном д-ксилола возможно также метилгалогенидами при 300-400 °С в присутствии немодифицированных цеолитов в протонированной форме с соотношением 81/А1 = 50 или при использовании цеолитов, модифицированных гетерополикислотами [126].
Сопоставление трех процессов синтеза д-ксилола: метаноль - ной конверсией, алкилированием толуола метанолом и ароматизацией н-парафинов - показало, что экономически наиболее целесообразно получать д-ксилол первым методом [127].
Метилированием толуола метанолом в боковую цепь возможно получение этилбензола и стирола.
Реакция открыта в середине 1960-х годов украинскими химиками [128-130], которыми было установлено, что если на Ы - и Ка-формах синтетических фожазитов происходит метилирование толуола метанолом в ароматическое ядро с образованием ксилолов, то на К-, НЬ - и Св-замещенных цеолитах реализуется реакция роста боковой цепи. Вместо метанола может быть использован формальдегид [131]. Каталитические превращения реагентов, по-видимому, протекают по следующей схеме [129]:
Сн3он —► СН20 + Н2 (СН20 —► СО + Н2)
С6н5сн3 + сн2о —► С6Н5СН=СН2 + Н20 С6Н5СН=СН2 + Н2 С6Н5СН2СН3
Исследователям фирмы "Мопвапк)" удалось улучшить показатели процесса, применив в качестве катализатора цеолит СвЫа-Х, модифицированный введением бора или фосфата [132]. Еще более высокие результаты достигнуты при модификации катализатора пропиткой в растворе нитрата меди или серебра [133, 134]. Так, при содержании 2 % (мае.) Ag в цеолите СэВКа- X и содержании В около 1 % (мае.) при 400°С и объемной скорости подачи жидкости 0.53 ч 1 селективность образования этил - бензола составляет 54.1 %, стирола - 2.0 %, т. е. суммарная селективность по целевым продуктам достигает 56.1 % [133].
Исследования по совершенствованию этого процесса продолжаются. Так, при использовании цеолита Ка-У, модифицированного карбонатом цезия, метилирование толуола метанолом при 450 °С приводит к суммарному выходу этилбензола и стирола около 8 %, причем образования ксилолов не происходит [135]. Дополнительной пропиткой цеолита С80 85Ма-Х нитратом цезия удалось повысить суммарный выход целевых продуктов с 24 до 30.6 %, причем катализатор сохраняет активность более 100 ч, в то время как исходный цеолит дезактивируется за 8 ч работы [136].
Однако возможность промышленной реализации процесса остается проблематичной: необходимо решать вопросы продолжительности стабильной работы катализатора, не достигнуто преимущественное получение конечного продукта - стирола [137].
В качестве альтернативы предложен катализатор для одновременного синтеза этилбензола и ксилолов - СвСаМа-Х [138]. При алкилировании толуола метанолом в мольном соотношении
3 : 1 при температуре 425 °С, объемной скорости подачи сырья
1 ч“1 на СаМа-Х получали только ксилолы (преимущественно о-ксилол), на СвКа-Х - только стирол и этилбензол, а на бикати - онной форме - смесь о-ксилола и этилбензола с небольшим количеством м - и /г-ксилолов.
Получение этилбензола и стирола возможно окислительным метилированием толуола метанолом.
Реакция окислительного метилирования, открытая X. Е. Хче- яном, в общем виде может быть представлена следующим образом [139]:
ИСНд 4 СН4 11СН2СНз 11СН=СН2,
К = С6Н5— СН2 = СН—, СН2 = С— N=0—
TOC o "1-5" h z СН3 •;*
Наибольший интерес представляют синтезы с использовании ем природного газа и толуола - I
С6Н5СН3+СН4 - V С6Н5СН2СН3 - V С6Н5СН=СН2 + Н20 э
I х
А также получение я-этилтолуола и гс-метилстирола из п-ксилола:
Сн3—сн3 + сн4 —^ сн3сн2—сн3 -► сн2=сн сн3 + н2о
![]() Процесс идет при 650-750 °С без катализатора, подчиняясь закономерностям радикально-цепных реакций и будучи энергоавтономным за счет теплоты реакции. На опытной установке достигнуты следующие показатели: конверсия толуола 40-50 %, селективность, %: этилбензол + стирол 45-50, бензол 23-28, фенол 12-14, крезолы 6-8, остаток (нафталин, дифенил, дибензил)
Процесс идет при 650-750 °С без катализатора, подчиняясь закономерностям радикально-цепных реакций и будучи энергоавтономным за счет теплоты реакции. На опытной установке достигнуты следующие показатели: конверсия толуола 40-50 %, селективность, %: этилбензол + стирол 45-50, бензол 23-28, фенол 12-14, крезолы 6-8, остаток (нафталин, дифенил, дибензил)
4- 5. Реакционная смесь может быть разделена ректификацией с выделением бензола в качестве одного из товарных продуктов. Еще более экономично кооперирование процесса с действующим производством этилбензола алкилированием бензола этиленом
[140].
Предлагаются и каталитические варианты окислительного метилирования толуола метаном. Так, показано, что добавление РЬ к катализатору 1л/1У^О повышает его селективность и селективность образования этилбензола и стирола [141]. Максимальную активность и стабильность (350 ч работы) проявляет катализатор Pb/Li/MgO состава 5 : 15 : 80 % (мол.). Обсуждается роль промотора, которая, по-видимому, заключается не в формировании активных центров реакции, а в образовании некристаллической фазы РЬ-1л-0, поставляющей кислород.
В Токийском институте технологии разработана технология производства стирола и этилбензола из толуола и метана с использованием в качестве катализатора 1дС1/СоО [142]. Через трубчатый реактор с катализатором пропускают при 650 °С газовую смесь из метана, толуола и кислорода. Конверсия толуола 23 %, селективность образования стирола 60 %, этилбензола - 40 % , побочных продуктов не образуется.
Алкилированием толуола этанолом получают смесь этил - толуолов с преобладанием м - или гс-изомера в зависимости от используемого катализатора. Так, в присутствии цеолита Р при 260 °С образуется смесь этилтолуолов в следующем соотношении, % (мае.): о - 18.5, м - 54.7, п - 26.8 [143]. Модификация цеолита Р Р2Об незначительно изменяет распределение этилтолуолов, а модификация МдО или В203 приводит к снижению содержания ж-этилтолуола и увеличению доли о-изомера. Например, при добавлении к цеолиту Р 1.53 % (мае.) В203 этил - толуолы распределяются следующим образом: о - 33.0, м - 42.6, п - 24.4.
Алкилирование толуола этанолом исследовано также в присутствии цеолитов типов Н-У, №-У и Н^вМ-5 с А1203 в качестве связующего [144]. Алкилирование проводилось при 325-400°С в атмосферном Ы2 или Н2, при давлении до 3 МПа и мольном соотношении толуол : этанол = (1—2): 1. Наиболее активен цеолит Н - гвМ-б при умеренной кислотности и соотношении 8Ю2/А1203 около 50. Содержание /г-этилтолуола в продуктах реакции доходит до 60 % (мае.), конверсия толуола при его отношении к этанолу 1 : 1 составляет 44.2 %.
При модифицировании цеолита Н^БМ-б с помощью В или P-Mg подавляются реакции диспропорционирования и изомеризации, в результате селективность образования /г-этилтолуола возрастает до 98 % [145].
Для алкилирования толуола можно использовать водные ферментационные среды, получаемые при переработке отходов сельскохозяйственной и целлюлозно-бумажной промышленности, содержащие до 10 % (мае.) этанола [146]. В качестве катализатора применяли цеолит ЦВК с мольным соотношением 8Ю2/А1203 = 49 со структурой типа пентасила. При 350 °С и мольном соотношении толуол : этанол =1:1 при использовании чистого этанола содержание /г-этилтолуола в смеси изомеров составляет 66.9 % (мае.), а при алкилировании биоэтанолом в тех же условиях оно возрастает до 91.8 % (мае.). Однако конверсия толуола при этом снижается с 22 до 6.1 % .
Модифицирование пентасила полиметилсилоксаном при алкилировании толуола водными растворами этанола позволяет повысить конверсию до 20 % и /гара-селективность - до 98 % [147].
Окислительным дегидрированием этилтолуолов получают соответствующие метилстиролы. /г-Метилстирол находит применение в производстве синтетического каучука, синтетических волокон, пластмасс, ионообменных смол [148]. Введение /г-метил - стирола в полистирольные композиции улучшает их физикохимические характеристики [149].
Дегидрирование /г-этилтолуола на оксидном Ее-Сг-катализа - торе позволяет получать /г-метилстирол с выходом лишь 57- 58% при селективности 90% [150, 151]. При использовании многокомпонентных оксидных катализаторов на основе Zn-Cr - шпинели выход /г-метилстирола удалось повысить на 10 % [152].
Применение в качестве протоноакцептора в02 вместо кислорода позволяет повысить как конверсию /г-этилтолуола, так и селективность. Так, при дегидрировании смеси п - и ж-этил - толуолов на оксидном V-Mg-кaтaлизaтope в присутствии в02 при объемной скорости подачи сырья 1.2 ч1 и мольном соотношении этилтолуолы : 802: Н20 = 1 : 0.25 : 7, температуре реакции 500°С выход метилстиролов повышается до 80.5 % при селективности их образования 98 % [153].
Совмещенный процесс дегидрирования этилбензола и п-этил - толуола позволяет повысить селективность по сумме мономеров и снизить расход перегретого водяного пара до массового соотношения Н20 : алкилбензолы = (2.5-3): 1 при температуре 580- 640 °С в присутствии оксидного Ее-Сг-К-катализатора [154, 155].
Изопропилированием толуола пропиленом или изопропиловым спиртом получают цимолы. Установлено, что широкопористый цеолит Р не обладает молекулярно-ситовой селективностью ни по одному из изомеров цимола [156].
Исследовано алкилирование толуола изопропиловым спиртом на цеолитах типа Н-У, мор дените, пентасиле с различной кислотностью, проявляющих /гара-селективность при получении цимолов. Установлено, что лимитирующей стадией является десорбция больших молекул пропилтолуолов из каналов цеолита [157].
Высокая пара-селективность при алкилировании толуола изопропиловым спиртом достигается на молекулярных ситах типа МЕ1 [158, 159].
При алкилировании толуола изопропиловым спиртом на цеолите Н^вМ-5 при 247 °С селективность по тг-цимолу составляет 72.7%, а по тг-пропилтолуолу - 7.4 %; в качестве еще одной примеси образуется ж-цимол, о-цимол отсутствует. Установлено, что на первой стадии алкилирования образуются цимолы, которые при последующей бимолекулярной реакции с толуолом дают н-пропилтолуолы. При изопропилировании толуола на Н-морде - ните п - и ж-цимолы образуются в соизмеримых количествах, а при использовании в качестве катализатора цеолита типа Н-У преобладает ж-цимол [160].
Тг-Цимол может быть также получен гидрированием а-ли - монена при 300 °С на слабокислотном 8Ю2, промотированном 0.5 % (мае.) Рс1, с полной конверсией и выходом 100 % [161].
Окислением цимолов до гидропероксидов с каталитическим разложением последних в присутствии кислотных или металлокомплексных катализаторов можно получать крезолы [162, 163].
Окислением тг-цимола при 20 °С активным Мп02 в 65%-й Н2804 получен 4-метилацетофенон с выходом 83.8 %, а окислением кислородом при 90 °С в растворе ацетата Со в уксусном ангидриде с выходом 85.2 % - 4-изопропилбензойная кислота [164].
Сульфированием толуола концентрированной H2S04 при 170°С получают п - толуолсульфокислоту с примесями о - и ж-изомеров, концентрация которых в реакционной смеси повышается при снижении температуры процесса [165]. Выделяют тг-толуолсуль - фокислоту в виде натриевой соли.
/г-Толуолсульфокислота применяется в производстве гс-крезо - ла, азокрасителей, лаков, замазок, стойких к кислотам и щелочам, а также в качестве кислотного катализатора в органическом синтезе. При ее сульфировании олеумом получают толуол-2,4- дисульфокислоту, использующуюся в производстве красителей.
Взаимодействием толуола с избытком хлорсульфоновой кислоты при 0-5 °С получают смесь толуолсульфохлоридов, содержащую 60 % п - и 37 % о-изомеров, из которой кристаллизацией выделяют /г-толуолсульфохлорид (Тпл= 67,5°С). При проведении сульфохлорирования при 70-80 °С содержание /г-толуолсульфо - хлорида в смеси изомеров возрастает до 95 % [166].
При взаимодействии толуолсульфохлоридов с аммиаком или аминами образуются толуолсульфамиды, при конденсации которых с альдегидами получают синтетические смолы. N-Алкил - толуолсульфамиды используются как пластификаторы для эфиров целлюлозы. Алкилированием толуола бензилхлоридом получают армотерм - высокотемпературный теплоноситель [167]. Предложен процесс производства армотерма (дибензилтолуолов) фотохимическим хлорированием толуола хлором или S02C12, при котором бензилхлорид не выделяется, а по мере образования конденсируется с толуолом. В качестве катализатора используется железо или чугун; хлорирование и конденсация протекают одновременно в различных зонах реактора. Дибензилтолуолы выделяют вакуумной дистилляцией, а кубовый остаток (трибен - зилтолуолы) можно утилизировать - путем переалкилирования в избытке толуола дополнительно получать армотерм [168].
Алкилированием толуола димерами а-олефинов, например продуктом димеризации 1-децена в присутствии А1С13, предложено получать алкилароматические смазочные масла с индексом вязкости более 100 [169].
Алкилированием толуола олигомерами С18-С30 пропилена с последующим сульфированием алкилпроизводных газообразным S03 и обработкой сульфокислот водной суспензией Са(ОН)2 производятся сульфонатные присадки к моторным маслам [170].
Ацетоксилированием толуола в присутствии катализатора Pd/C можно получать бензилацетат [171]. Наиболее активен и селективен при парофазном окислительном ацетоксилировании толуола биметаллический катализатор Pd-Au-KN03/Si02, применение которого позволяет повысить выход бензилацетата в 150 раз по сравнению с Рс1/8Ю2 [172]. Ацетоксилирование толуола исследовано также на РсНЗп-катализаторах [173, 174].
При ацилировании толуола бензоилхлоридом в мольном соотношении 5 : 1 на цеолите (3 при 110°С при конверсии бензоил- хлорида 83.4 % образуется 4-метилбензофенон с селективностью 95.3 % [175].
Гидрированием толуола на платиновых катализаторах, нанесенных на кислотные носители, получают метилциклогексан. Оптимальные результаты получены при 60 °С на катализаторе 0.95 % (мае.) Р1/ТЮ2 [176]. Введение 1г или Ие в катализатор Р1/А1203, а также хлорирование или фторирование катализатора повышают его активность, причем толуол гидрируется лучше, чем бензол [177]. При использовании осмиевого катализатора на активном угле БАУ, напротив, скорость жидкофазного гидрирования бензола в 4 раза выше, чем толуола [178]. Активными катализаторами гидрирования толуола являются гексаиридиевые кластеры, нанесенные на у-А1203 [179].
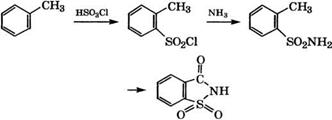
Из толуола получают сахарин по следующей схеме [27]:
|
|
Реакцию толуола с хлорсульфоновой кислотой проводят при температуре не выше 5°С для снижения выхода и-толуолсуль - фохлорида. Изомеры разделяют ректификацией или вымораживанием, затем при взаимодействии о-толуолсульфохлорида с аммиаком получают о-толуолсульфонамид, электрохимическим окислением которого раствором хромовой кислоты синтезируют сахарин.
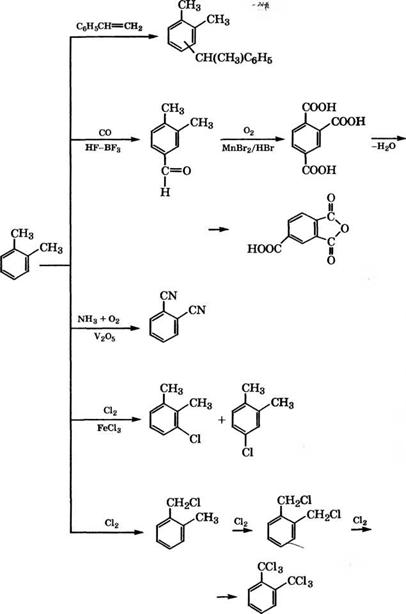
Промышленные и перспективные направления использования о-ксилола представлены на схеме (рис. 10).
Основное направление применения о-ксилола - производство фталевого ангидрида. Процессы производства фталевого ангидрида рассмотрены в ряде монографий и обзоров [180-182].
В промышленности фталевый ангидрид получают парофазным окислением о-ксилола или нафталина с использованием стационарных или псевдоожиженных катализаторов на основе V205/Ti02 или V205-K2S04 при 350-450°С. Сырой фталевый ангидрид улавливают из реакционных газов в калориферах, выделяют и очищают ректификацией. Выход фталевого ангидрида при окислении о-ксилола 75-80 %, при использовании нафталина 85-88 %.
Конструкция трубчатого реактора с неподвижным слоем катализатора V205/Ti02 описана в статьях [183, 184]. Максимальная температура процесса 460-480°С, в пересчете на нормальные условия расход сырья составляет 4.5 м3*ч“г, концентрация о - ксилола - 40 г/м3 (по другому варианту с низким расходом воздуха - 60 г/м3). В качестве хладагента используется расплав солей NaN02/KN03. Выход фталевого ангидрида постепенно снижается с 79 до 74 % через 50 дней работы катализатора и далее до 71.3 и 61.1 % - через 20 и 36 мес [185].
Шведская фирма «Neste» разработала новую технологию производства фталевого ангидрида, при которой после обычного реактора с неподвижным слоем катализатора предусматривается адиабатический реактор. Новая технология позволяет повысить качество фталевого ангидрида и его выпуск на 20 %, увеличить срок службы катализатора на 30 %. Срок окупаемости затрат на реконструкцию составляет 1 год [186].
Применение вместо шарикового катализатора регулярно уложенных трубчатых гранул привело к снижению гидравлического сопротивления реактора, снижению расхода энергии на 25 %. Это позволило увеличить мощность реактора на 22 % и повысить селективность процесса за счет выравнивания концентрационных и температурных полей, улучшения теплосъема. Доля продуктов горения (СО + СОо) при замене катализатора снизилась с 21.6 до 18 % [187].
Фирма «Lurgi» повысила концентрацию о-ксилола в рабочем потоке при окислении воздухом на 30 %, доведя ее до 100 г/м3, что привело к снижению инвестиционных затрат [188].
Окисление о-ксилола в неизотермическом режиме на катализаторе в нестационарном состоянии повышает выход фталевого ангидрида [189, 190]. ^
Японская компания «Nippon Shokubai» запатентовала процесс производства фталевого ангидрида парофазным окислением смеси о-ксилола и нафталина воздухом при 300-450°С в трубчатом реакторе с двумя катализаторами. В состав первого по ходу движения реакционной смеси катализатора входит V205/Ti02, промотированный Nb, Р, Sb и щелочным металлом (К, Cs, Rb)
|
Рис. 10. Направления использования о-ксилола 242 |
|
Рис. 10 (продолжение) |
Или Т1. Второй катализатор имеет тот же состав, но отличающийся пониженным содержанием щелочного металла или Т1. В качестве преимущества процесса отмечается высокая производительность катализатора [191].
Активность и селективность по фталевому ангидриду повышается при промотировании промышленного катализатора V205/Ti02 добавкой 0.15 % Li20 [192].
Промотирующее влияние добавок оксидов К, Ва, Bi, W, Sn на каталитические свойства V205/Ti02 при окислении о-ксилола изучено в работе [193]. Отмечается хорошая корреляция при температуре выше 300 °С между кислотно-основными свойствами промотора и выходом фталевого ангидрида, однако при низкой температуре положительный эффект оказывают лишь основные промоторы.
При окислении нафталина или о-ксилола в присутствии V205 + + K2S04 при 360-400°С выход фталевого ангидрида составляет около 90 %. Побочными продуктами являются малеиновый ангидрид и 1,4-нафтохинон, получающиеся с выходом 7-9 и менее 5 % соответственно [194].
Парофазное окисление о-ксилола изучено также на моно - слойном оксиднованадиевом катализаторе, нанесенном на MgF2 [195], а также на Мо03 на различных носителях [196]. Однако выход фталевого ангидрида при использовании этих катализаторов ниже, чем на промышленном катализаторе.
Основной недостаток парофазного процесса окисления о-кси - лола - низкий выход фталевого ангидрида вследствие сгорания значительной части сырья при высокой температуре. Разработан жидкофазный процесс получения фталевого ангидрида совместным окислением о-ксилола и рециклового о-метилтолуилата кислородом воздуха под давлением [197].
Процесс проводится при 180-200 °С и давлении 1 МПа, при этом протекают следующие реакции [198]:
|
О |
|
II |
|
+ |
|
СН3 |
|
СООН |
|
А |
 |
|
|
|
|
|
![]()
![]()
![]()
|
СООСНз |
![]()
|
+ СН3ОН |
![]() СООН
СООН
|
+ н20 |
![]() А
А
|
СНз |
![]() СНз
СНз
Получающаяся при окислении наряду с фталевым ангидридом о-толуиловая кислота этерифицируется метанолом до о - метилтолуилата, который вновь подается на окисление. Выход фталевого ангидрида по этому методу составляет 90 %.
Нитрованием о-ксилола N02 в газовой фазе над цеолитом Р с высокой селективностью получают 4-нитро-о-ксилол [199]. Нитрование о-ксилола можно проводить безводной нитрующей смесью HN03, H2S04 и Н3Р04 при 20 °С. При этом с выходом 76.5 % получается смесь 3- и 4-нитро-о-ксилолов в соотношении 35.7 : : 64.3 [200]. Восстановлением 4-нитро-о-ксилола получают 3,4-кси - лидин, применяющийся для синтеза рибофлавина (витамина В2). Восстановлением различных нитроксилолов производятся изомерные ксилидины, использующиеся в производстве азокрасителей, пигментов, пестицидов [82].
Алкилированием о-ксилола mpem-бутанолом на цеолите CaNa-
Y на алюмосиликате, содержащем Ln, при 135°С с выходом 90- 94 % получен 1,2-диметил-4-трет-бутилбензол, который может быть использован для синтеза 4-трет-бутилфталевой кислоты и на ее основе фталоцианиновых пигментов, пластификаторов, фотоматериалов [201]. 1,2-Диметил-4-трет-бутилбензол можно получать также алкилированием о-ксилола изобутиленом при 190°С и давлении 2.2 МПа на цеолите H-ZSM-12/A1203[202].
Алкилированием о-ксилола 1,3-бутадиеном получают 5-(о-то - лил)-2-пентен и на его основе - 2,6-диметилнафталин, 2,6-на - фталиндикарбоновую кислоту и полиэфиры. В качестве катализатора для алкилирования о-ксилола корпорацией «Атосо» запатентована эвтектическая смесь Na/K, активированная ультразвуковым излучением [203], или смесь Na, К и N, N,N',N'-TeTpa- метилэтилендиамина [204]. При проведении синтеза по первому способу при 125 °С при конверсии о-ксилола 11.1 % селективность его превращения в 5-(о-толил)-2-пентен составляет 77 %.
Компания «Mitsubishi Gas Chemical» запатентовала катализатор алкилирования, получаемый термообработкой смеси Na, СаО или MgO и соединения калия (КОН, К2С03, КНС03) [205]. Этой же компанией предложен катализатор, полученный кальцинированием смеси КОН и А1(ОН)3 при 500-650 °С с последующей обработкой в атмосфере N2 жидким или металлическим Na при 100-300 °С. При использовании последнего катализатора для алкилирования о-ксилола 1,3-бутадиеном выход 5-(о-толил)-
2- пентена достигает 98 % [206].
Смесь диметилнафгалинов, полученная из о-ксилола и 1,3-бутадиена, изомеризуется с использованием Н-морденита с последующей кристаллизацией из гептана с получением 2,6-диметил- нафталина чистотой 99.19 % [207].
Алкилирование аренов олефинами в присутствии твердых перфторсульфокислотных катализаторов идет не по боковой цепи, а по ароматическому кольцу. Так, при использовании сополимера перфторвинилового эфира с функциональной группой - 803Н (Альтион) в качестве катализатора алкилирования о-ксило - ла н-деценом-1 при 130 °С получены втор-децил-о-ксилолы с производительностью 5.27 г/г катализатора, более высокой по сравнению с другими катализаторами алкилирования (Кайюп, МФ-4СК, КСМ-2) [208].
Взаимодействием о-ксилола со стиролом в жидкой фазе при 130-170 °С и давлении 0.1-0.5 МПа можно получать 1-фенил-
1- ксилилэтан - экологически безопасную пропитывающую диэлектрическую жидкость. В качестве катализатора предложено использовать аморфный пылевидный адсорбент для защитных покрытий, приготовленный методом совместного осаждения гидроксидов А1 и [209].
Метилированием ксилолов метанолом при 320-400 °С и давлении 0.5-2 МПа в присутствии цеолитов с содержанием Ка 1—
2 % можно получать псевдокумол [210, 211]. Триметилбензолы, в основном псевдокумол, получают и при диспропорционировании о-ксилола, например, в присутствии монтмориллонитов, сшитых с помощью А1203 и Сг203[212].
Карбонилированием о-ксилола в присутствии НЕ-ВЕ3 при температуре ниже 0°С и давлении 2 МПа с последующим окислением полученного альдегида воздухом в присутствии МпВг2/НВг при 220-230 °С, давлении 2-3 МПа и дегидратацией кислоты производится тримеллитовый ангидрид [213].
Окислительным аммонолизом о-ксилола при 380-400 °С в присутствии У205 или аммонолизом фталевого ангидрида при 400 °С на Сг203 получают 1,2-фталодинитрил [108].
Фирма «ВАЗЕ АО» в качестве катализатора процесса окислительного аммонолиза ксилолов запатентовала У205/А1203, модифицированный 8Ь203, оксидами и соединениями щелочных металлов [214]. 1,2-Фталодинитрил применяется в производстве фталоцианиновых красителей на основе фталоцианина меди, а также полифталоцианинов и пестицидов [108].
Хлорированием о-ксилола в жидкой фазе при 50-70 °С в присутствии ЕеС13 получают смесь 3- и 4-хлор-о-ксилолов. При фотохимическом хлорировании ксилолов или при хлорировании в присутствии 2,2'-азо-бис-изобутиронитрила происходит замещение атомов водорода метильных групп хлором с образованием ксилилхлоридов, ксилилендихлоридов и гексахлоркси - лолов [97]. Хлорированием о-ксилола в две стадии - сначала в ядро при 20-100 °С в среде Т1С14, затем в боковые цепи при 50- 100°С и ультрафиолетовом освещении получен о-С6С14(СНС12)2 [215].
Окислением о-ксилола НЖ)3, Сг203 или КМп04 получают о - толуиловую кислоту, применяющуюся в производстве красителей и лекарственных средств.