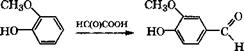Ароматические углеводороды: Выделение, применение, рынок
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ ДВУХАТОМНЫХ ФЕНОЛОВ
Гидрохинон в промышленности получают одним из следующих методов [210]:
1. Окислением сульфата анилина Мп02 при 3-10 °С или Na2Cr207 в H2S04 при 20 °С до 1,4-бензохинона, который восстанавливают порошком Fe в воде при 70-80 °С в присутствии NaHS03. Выход гидрохинона составляет 74-84 % по анилину.
2. Каталитическим гидроксилированием фенола Н202 с последующим разделением смеси гидрохинона с пирокатехином ректификацией.
3. Окислением 1,4-диизопропилбензола кислородом воздуха с последующим кислотным гидролизом бисгидропероксида до гидрохинона и ацетона.
Если при производстве гидрохинона первым способом на 1 т продукта образуется Ют неорганических солей, то новый каталитический процесс окисления 1,4-диизопропилбензола приводит к получению лишь 1 т солей на 1 т гидрохинона [10].
4. Взаимодействием фенола и пропилена с последующим окислением образующегося 4-изопропилфенола Н202 в кислой среде до гидрохинона и ацетона.
Недавно была установлена также возможность получения гидрохинона окислением фенола оксидом азота(1) [195].
В патентной литературе последнего десятилетия гидрохинон и пирокатехин предлагается получать в основном гидроксилиро - ванием фенола Н202. Так, взаимодействием фенола с водным раствором Н202 в присутствии FeS04 в качестве катализатора в насадочном аппарате колонного типа при прямотоке реагентов в свободно стекающей пленке реакционной массы и противотоке газовой фазы в виде водно-фенольных паров и выделяющегося 02 при 40-101 °С получают пирокатехин и гидрохинон с суммарной селективностью 89-90 % при степени конверсии фенола 25-40 % [363].
В качестве катализаторов гидроксилирования фенола пероксидом водорода могут служить: C6H50S02Na (выход пирокатехина и гидрохинона 48.3 и 20.4 % соответственно при 80 °С) [364]; (CH3)2C0NaHS03 (выход пирокатехина и гидрохинона 35.5 и 17.3% соответственно при 80 °С) [365]; сульфокатиониты, например амберлист-15, в присутствии бензофенона (выход пирокатехина и гидрохинона 45.5 и 33 % соответственно) [366]; P4S10 в присутствии метилизобутилкетона (выход пирокатехина и гидрохинона 52.2 и 37.6 % соответственно при 100 °С) [367,368]; дифенилкетон в присутствии НС104 с использованием сульфола - на в качестве растворителя (выход гидрохинона и пирокатехина
49 и 37.5 % соответственно) [369].
Эффективными катализаторами гидроксилирования фенола Н202 в гидрохинон и пирокатехин являются силикаты титана [370, 371], титаносиликатный цеолит [372], гидротальциты состава (Cu, А1, М(Н))С03 = НТл с соотношением Cu/Al = 3, где М = Со, Ni, Cu, Zn, Fe [373]. Использование этих катализаторов приводит к повышению производительности и селективности процесса, к меньшему загрязнению окружающей среды [371].
Применение гетерогенного катализатора TS-1 на основе си - ликалитов Ti, разработанного фирмой «Enichem», оказалось значительно экономичнее, чем гомогенных катализаторов (процесс «Rhone-Poulenc») или солей Fe2+/Co2+. Жидкофазное окисление фенола Н202 при конверсии 25 % проводится при 80 °С в растворителях - метаноле, трет-бутаноле, воде, ацетоне. Соотношение образующихся гидрохинона и пирокатехина может быть оптимизировано [10].
Возможно также окисление фенола воздухом в смеси с СО при 100 °С в присутствии Р<Ю2 и Си2С12 с суммарной селективностью образования гидрохинона и пирокатехина свыше 95 % [374].
Двухатомные фенолы получаются и при дегидрировании циклогександиолов в присутствии катализатора, содержащего платину и суспендированного в растворителе. Так, при использовании 5 % Р1/С, суспендированной в воде, конверсия 1,2-цикло - гександиола составляет 62.4 %, селективность образования пирокатехина - 61.7 % [375].
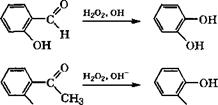
Пирокатехин и гидрохинон можно получать по реакции Дей - кина действием на ароматические о - и п-гидроксиальдегиды (или гидроксиацетофеноны) Н202 в водном растворе щелочи [334, с. 194-195]:
|
|
Резорцин получают в промышленности одним из следующих способов: щелочным плавлением 1,3-бензолдисульфокислоты; окислением 1,3-диизопропилбензола кислородом воздуха с последующим кислотным гидролизом образующегося бисгидропе - роксида до резорцина и ацетона; гидролизом 3-галогенфенолов или 1,3-дигалогенбензолов [334, с. 267-274].
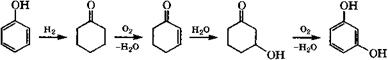
Компанией «Catalytica Inc.» запатентован четырехстадийный процесс получения резорцина из фенола по следующей схеме [376]:
|
|
Гидрирование фенола до циклогексанона проводится при 215 °С и давлении водорода 0.5 МПа в присутствии Ыа2С03 и катализатора Рс1/С, очистка от примеси циклогексанола - вакуумной ректификацией. Вторая стадия - окислительное дегидрирование циклогексанона до циклогекс-2-енона - проводится при 85 °С, давлении кислорода 0.65 МПа в присутствии палладиевого катализатора, например Р<1(СГ3СОО)2, и гетерополикислоты К5Н4РМо6У6О40 или Н9РМо6У6О40. Гидратация циклогекс-2-енона до 3-гидроксициклогексанона осуществляется при 30-90 °С водой или смесями воды с растворителями. Последняя стадия - окислительное дегидрирование 3-гидроксициклогексанона до резорцина — проводится в присутствии кислорода и Рс1/С. Отмечается, что все стадии синтеза резорцина из фенола экономичны, экологически и коррозионно безопасны. Однако существенные недостатки способа - многостадийность синтеза и невысокий выход промежуточного продукта второй стадии: конверсия циклогексанона 35-36 % , селективность образования циклогекс-2- енона около 18-21 %.
Пирокатехин применяется в производстве адреналина, в качестве антисептика, как проявитель в фотографии и как компонент красителя для меха. Метилированием пирокатехина метил - серной кислотой, диметилсульфатом или метанолом получают гваякол. Метилирование пирокатехина метанолом проводится в газовой фазе в присутствии катализаторов - фосфорной или борной кислот, алкилфосфатов или алкилборатов, оксидов бора, нанесенных на инертный носитель (а-А1203, ТЮ2, активированный уголь). Процесс осуществляется при 200-400 °С, селективность образования гваякола 98 % при конверсии пирокатехина около
50 % [377, 378].
Метилирование пирокатехина возможно также диметилкар - бонатом на А1203, модифицированном гидроксидами щелочных металлов, лучше всего 1АОН; селективность образования гваякола при 310 °С составляет 84 % [379].
Взаимодействием гваякола с глиоксиловой кислотой получают ванилин:
|
|
Ванилин - душистое вещество, применяющееся в кондитерской, пищевой, парфюмерной промышленности, а также в качестве сырья для получения фтивазида - противотуберкулезного средства.
Аллилированием гваякола получают эвгенол (З-метокси-4- оксиаллилбензол), изомеризацией которого синтезируют изоэвгенол:
Эвгенол и изоэвгенол - душистые вещества с запахом гвоздики, применяющиеся в парфюмерной, пищевой и табачной промышленности.
Конденсацией гваякола с камфеном и гидрированием промежуточного продукта получают санталидол - душистое вещество с запахом санталового масла, применяющееся в парфюмерии. Гваякол используется также для получения папаверина (6,7-ди - метокси-1-(3,4-диметоксибензил)изохинолина), гидрохлорид которого служит спазмолитическим и сосудорасширяющим средством. В парфюмерной и пищевой промышленности гваякол применяется в качестве отдушки.
Парофазным метилированием пирокатехина диметилкарбо - натом при 310 °С на КК03/А1203 получают вератрол с выходом 97 % [380].
Алкилированием пирокатехина изобутиленом при 120—130 °С в присутствии 0.8-1 % (мае.) кислотного катализатора получают 4-дгредг-бутилпирокатехин с выходом 80-90 % [382]. Алкилированием пирокатехина изобутиленом получают также 3,5-ди - трет-бутилпирокатехин, использующийся в качестве антиоксиданта [381].
Алкилированием пирокатехина олигомерами а-олефинов с 8-14 атомами С в присутствии каталитических количеств органических сульфокислот (СН3803Н, СГ3803Н, С6Н5803Н, п-толуол - сульфокислоты) получают продукты, которые могут служить основой смазочных масел или в качестве присадок к смазочным маслам [383]. Добавки пирокатехина или его ^1—С10 - алкилзаме - щенных производных по бензольному кольцу и карбоновых кислот предложено применять как антиокислительные композиции для предотвращения образования полимеров с последующим обрастанием оборудования при работе с углеводородами в высокотемпературных условиях [384].
Композиции, включающие двухатомные фенолы, можно использовать в качестве отвердителя для эпоксидных смол [385]. Пирокатехин и другие фенолы совместно с антиоксидантами применяются как антирады - вещества, повышающие стойкость пластмасс, резин, смазок, топлив к действию ионизирующих излучений [386].
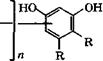
Резорцин применяется в производстве резорцино-альдегид- ных смол, красителей, как антисептик. Эфиры резорцина служат пластификаторами и стабилизаторами полимеров. Резорцино-альдегидные смолы общей формулы
|
|
|
СЩІГ) |
I 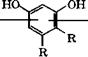
|
Н— |
И = Н, СН3, С2Н5; К = Н, иногда ОСН=СНСН=СН; п = 4-6
Получают поликонденсацией резорцина или его гомологов с альдегидами, главным образом с формальдегидом [221, 387]. Поликонденсацию можно проводить без катализатора при комнатной температуре, поскольку резорцин при взаимодействии с альдегидами значительно более активен, чем фенол.
Производство резорцино-альдегидных смол составляет около 5 % от производства смол на основе фенола. Наибольшее применение находят термопластичные резорцино-формальдегидные смолы, получаемые в водной или водно-спиртовой среде при мольном соотношении резорцин : формальдегид = 1 : (0.5-0.65). Используются также гексарезорциновая смола на основе резорцина и гексаметилентетрамина и термореактивная резорцино - фурфурольная смола.
Резорцино-альдегидные смолы применяются в основном как клеи холодного отверждения для изготовления несущих деревянных конструкций и в качестве пропиточных составов для шинного корда и резинотехнических изделий.
При взаимодействии резорцина и его производных, например бензоилрезорцина, с эпихлоргидрином получаются ароматические диэпоксиды - нетоксичные смолы с пониженной склонностью к адсорбции влаги, высокой температурой стеклования, низкой летучестью, легко обрабатывающиеся. Выход эпоксидной смолы при 100-125 °С составляет 96 % [388].
Взаимодействием водных растворов резорцинатов щелочных металлов с хлоруксусной кислотой получается 1,3-фенилендиок- сидиуксусная кислота, используемая как мономер в синтезе высокомолекулярных соединений [389]:
|
|
||
|
|||
|
|||
![]()
![]()
При pH 9.3 и температуре 70 °С конверсия резорцина 99.8 %, селективность образования целевого продукта 83.5 %.
Карбоксилированием резорцина по реакции Кольбе - Шмитта с С02 и К2С03 получают смесь 2,4- и 2,6-дигидроксибензойных кислот, которая может быть разделена кристаллизацией [390].
Нитрованием резорцина 85-92 %-й Н1Ч03 в две стадии при -(21 - ь 15) °С и при -5 °С получают 4,6-динитрорезорцин, восстановлением которого синтезируют 4,6-диаминорезорцин [391]:
02К"^'/К02
41
|
XX |
![]() НО^ ^ /ОН ‘
НО^ ^ /ОН ‘
14
Ч‘1
Н2*Г ^ КН2 Г(
|
А |
![]() Полициклоконденсацией 4,6-диаминорезорцина с дифенило - выми эфирами дикарбоновых кислот в расплаве или с ароматическими дикарбоновыми кислотами, содержащими кардовые группы, в полифосфорной кислоте или в высококипящем растворителе получают полибензоксазолы [392,393]:
Полициклоконденсацией 4,6-диаминорезорцина с дифенило - выми эфирами дикарбоновых кислот в расплаве или с ароматическими дикарбоновыми кислотами, содержащими кардовые группы, в полифосфорной кислоте или в высококипящем растворителе получают полибензоксазолы [392,393]:
Полибензоксазолы обладают высокой термо-, тепло- и химической стойкостью в кислых и щелочных средах. При нагревании на воздухе они устойчивы до 450 °С, а в инертной среде - до 500 °С. Из полибензоксазолов получают пленки, волокна, пластмассы, обладающие высокими прочностными характеристиками и хорошими электроизоляционными свойствами. Пленки из полибензоксазолов используются в электротехнической промышленности для изоляции обмоток электродвигателей. Полибензоксазолы применяются также в качестве связующих пресс - порошков, стекло - и углепластиков.
4,6- Диаминорезорцин можно получать также из 1,3-дихлор-
4,6- динитробензола действием водно-метанольного раствора щелочи: в зависимости от условий реакции с высокими выходами при этом образуются либо 5-метокси-2,4-динитрофенол, либо
1,3- диметокси-4,6-динитробензол. В качестве сырья может использоваться и 2,4-динитрохлорбензол, взаимодействующий с
кумилгидропероксидом в растворе NaOH в жидком аммиаке. Далее нитрогруппы в промежуточных соединениях восстанавливают водородом над Pt/C, получая моно - или диметиловые эфиры 4,6-диаминорезорцина, после чего действием концентрированной НС1 снимают эфирную защиту и получают 4,6-диаминоре - зорцин [394].
Фирма «Bayer AG» запатентовала способ получения дигидрохлорида 4,6-диаминорезорцина гидрированием 1,3-дибензокси-
4,6- динитробензола водородом на 5 % (мае.) Pd/C в двухфазной системе соляная кислота - органический растворитель при 80 °С и давлении 1-2 МПа [395].
Взаимодействием резорцина с безводным аммиаком в ароматическом растворителе (например, ксилоле) при 200-240 °С в присутствии цеолитов типа Y или морденита получают ж-амино - фенол [324,325]. Так, при 220 °С получается реакционная масса следующего состава, % (мае.): непрореагировавший резорцин - 5.7, ж аминофенол - 82, ж-фенилендиамин - 9, - из которой перегонкой и перекристаллизацией из метанола выделяют целевой продукт чистотой 99.3 % (мае.) [324]. лг-Аминофенол применяется для синтеза красителей, полимеров, лекарств и агрохимикатов.
Нитрозированием моноэфиров резорцина с NaN02 в среде низших карбоновых кислот (уксусной, пропионовой) при -10 + +10 °С получают 5-алкокси-2-нитрозофенолы, применяющиеся в синтезе пестицидов [396].
Взаимодействием резорцина и его производных с Я-резорци - новой кислотой в присутствии катализаторов ZnCl2 и РОС13 в ме - танольном растворе получают полигидроксибензофеноны с выходом более 70 % [397]:
|
О |
Полигидроксибензофеноны используются как стабилизаторы, полупродукты синтеза лекарств и агрохимикатов.
Гидрированием двухатомных фенолов в присутствии металлов VIII группы, например 5 % (мае.) Pd/C и алифатических аминов, получают циклогександионы. Так, из резорцина при 100 °С и давлении Н2 1.5 МПа с выходом 78.3 % синтезируют
1,3- циклогександион [398]. Циклогександионы используются в синтезе термо - и пьезочувствительных цветообразующих добавок, лекарств и агрохимикатов.
Резорцин легко вступает в реакции азосочетания, например, с диазотированной сульфаниловой кислотой с образованием красителя резорцинового желтого [356]:
ОН ОН
Н°—_/ +^2С6Н480з -► Н0н(_)-М=КС6Н480зН
І1ІІ
% Взаимодействие резорцина с карбоновыми кислотами в присутствии ZnC2 приводит к смеси 2- и 4-ацилрезорцинов, что используется для получения эффективного антисептика — 4-гек - силрезорцина:
.ОН. ОН
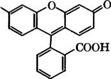
Конденсацией резорцина с фталевым ангидридом в присутствии ЪпС12 при 175-195 °С получают флуоресцеин:
1
О
Флуоресцеин применяется как желтый кислотный краситель для нетекстильных материалов, например косметических средств, и в качестве индикатора. Действием Вг2 на флуоресцеин в присутствии КаС103 получают эозин (1,3,6,8-тетрабромфлуоресце - ин) - кислотный краситель, применяющийся для изготовления красных чернил, губной помады, для окрашивания бумаги, моторных топлив, как компонент полиграфических красок и индикатор. Иодированием флуоресцеина в присутствии КЮ3 получают эритрозин (1,3,6,8-тетраиодфлуоресцеин) - кислотный красный краситель.
При взаимодействии п-фенилендиамина с резорцином или пирокатехином образуются производные оксазина и индоанили - на [318, 356]:
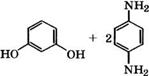 1*н2
1*н2
НО к~0“кн2 *
Они находят применение в качестве оксидационных красителей, при крашении которыми под действием окислителей (Н202, К2Сг207, КаС103) образуются цветные соединения непосредственно на окрашиваемом материале.
При взаимодействии двух - или трехатомных фенолов с ангидридами карбоновых кислот в присутствии трет-аминов получаются эфиры, применяющиеся в производстве ароматических полиэфиров [399].
Гидрохинон применяется в качестве антиоксиданта для кау - чуков, пищевых продуктов, ингибитора полимеризации виниловых мономеров, как сырье в производстве красителей, лекарств, фотоматериалов.
Гидрохинон используется в составе проявителей. Процесс проявления в фотографии может быть представлен следующей реакцией [400, 401]:
ОН
Л
4AgBr + М| + 2Ыа2803 + 2ИаОН -►
ОН
О
X. вОзШ ‘0
—► 4А£ + 4ЫаВг + 11) + 2Н20 ^
V
МаОзБ
О^
Димеризацией гидрохинона и его производных в растворителе (например, кумоле) в присутствии гетерополикислот (например, Н481Л¥1204) получают 4,4/-дигидроксидифениловые эфиры, которые используются в синтезе термостойких полимеров. Так, при 160 °С из гидрохинона образуется эфир с селективностью
96.1 % и выходом 61.2 % [402].
Алкилированием гидрохинона спиртами, например октано - лом, при 120 °С в присутствии Р205-24Мо03-л;Н20 с выходом 60 % может быть получен 1-октилоксигидрохинон - антиоксидант для продуктов питания, косметических препаратов, различного химического сырья [403].
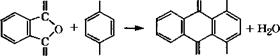
Конденсацией гидрохинона со фталевым ангидридом получают хинизарин (1,4-дигидроксиантрахинон) [130]:
|
О ОН О ОН
О ОН О ОН |
Взаимодействием хинизарина с параформом и пиперидином в диметилформамиде получают 2-пиперидинометил-1,4-дигидро- ксиантрахинон - промежуточный продукт в синтезе катионных красителей. Окислением хинизарина Мп02 синтезируют пурпурин (1,2,4-тригидроксиантрахинон). При нагревании пурпурина с анилином образуется 2-анилино-1,4-дигидроксиантрахинон, который при взаимодействии с Н3В03 при 160 °С с последующим сульфированием превращается в протравной краситель для шерсти.
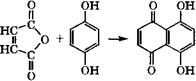
Конденсацией гидрохинона с малеиновым ангидридом получают нафтазарин:
|
|
|
Ы,№-Дифенил-п-фенилендиамин используется для получения Ы,№-дифенилхинондиимина и далее - хинониминовых кра- |
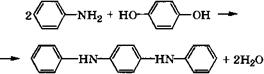
![]() При конденсации гидрохинона с анилином в присутствии 85-89 %-й Н3Р04 при 205-210 °С с азеотропной отгонкой образующейся воды получается Г^Г^'-дифенил-п-фенилендиамин [404, 405]:
При конденсации гидрохинона с анилином в присутствии 85-89 %-й Н3Р04 при 205-210 °С с азеотропной отгонкой образующейся воды получается Г^Г^'-дифенил-п-фенилендиамин [404, 405]:
|
|
Сителей, применяющихся для крашения бумаги, в полиграфии, лакокрасочном производстве, цветной фотографии.