Ароматические углеводороды: Выделение, применение, рынок
71-КСИЛОЛ
Области промышленного применения я-ксилола и перспективные направления его использования представлены на схеме (рис. 12).
Основная область применения я-ксилола - производство те - рефталевой кислоты или диметилтерефталата и на их основе - полиал килентерефтал атов.
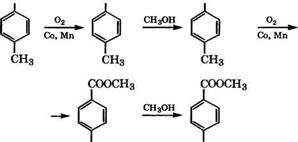
Терефталевая кислота производится окислением я-ксилола при 140 - 220 °С в среде уксусной кислоты в присутствии солей Со или Мп и промотора - солей Вг. В монографии [330] рассмотрены различные одно - и двухстадийные отечественные и зарубежные процессы получения терефталевой кислоты и ее димети - лового эфира.
Себестоимость производства диметилтерефталата на 17-37 % выше, чем очищенной терефталевой кислоты, полученной различными способами. Однако очистка терефталевой кислоты более трудоемка, при ее синтезе используются коррозионноактивные уксусная кислота и бромсодержащие соединения, поэтому оборудование должно быть из специальных сталей или армированное титаном. По этим причинам диметилтерефталат конкурирует с терефталевой кислотой при производстве полиэфирных волокон.
Отечественный двухстадийный процесс производства терефталевой кислоты проводился на кобальтбромидном катализаторе в среде уксусной кислоты, содержащей 2-3 % (мае.) воды. Очистка терефталевой кислоты проводилась доокислением примесей КМп04 в ацетатно-буферном растворе.
Японская фирма «Магигеп» разработала в 1973 г. одностадийный процесс окисления я-ксилола в волокнообразующую те - рефталевую кислоту при 190-200 °С и давлении 1.8-2 МПа в присутствии катионов Со и Мп, в качестве инициатора использовался бром. В процессе исключена стадия очистки терефталевой кислоты, на которую приходится 25-32 % общих затрат.
|
™ и 1 Сосн2сн2Ч ? /“Ч н ■СОСН2СН2СН2 |
|
СООН ”Н0СН2СН20Н |
|
СООН |
|
ПНО(СН2)3ОН ПНО(СН2)4ОН |
|
Г ИI Г0~с _у 1 I /= ] ,— V ;-/-со(Сн2)4 |
 |
|
|
![]()
|
|
|
ПО(СН2СН2ОН)2 Г I ------------------- '—о—с |
|
Сосн2сн2осн2сн2 |
|
СН3 СН3 |
|
-н, |
|
СН; Н2с_0~сн2 |
|
|
 |
![]()
|
■ксилола |
|
Сон Направления использования п- |
|
Рис. 12. |
|
|
В 1977 г. ВНИПИМ (г. Тула) также реализовал в промышленности одностадийный процесс окисления я-ксилола при 210- 230°С и давлении 2.4-2.7 МПа с применением Co-Mn-Ni-6po - мидного катализатора. Синтез протекает при интенсивном перемешивании, теплота реакции снимается за счет испарения растворителя - уксусной кислоты.
Процесс американской фирмы «Mobil Chemical Corp.» проводится при 130°С и давлении 1.7 МПа в присутствии ацетата Со в уксусной кислоте, промотором служит метилэтилкетон. Селективность образования терефталевой кислоты из я-ксилола составляет 94 %.
Процесс западногерманской фирмы «Henkel-I» состоит в получении фталата и изофталата калия из о - и ж-ксилолов, которые изомеризуют в терефталат в присутствии катализатора при 340-380 и 400-450 °С соответственно. Себестоимость производства терефталевой кислоты по этому способу наименьшая.
Диметилтерефталат получают жидкофазным окислением я-ксилола в среде метилового эфира я-толуиловой кислоты при 140-180 °С в присутствии солей Со и Мп. При этом окисляется преимущественно одна метильная группа, затем проводят эте - рификацию метанолом, окисление второй метильной группы и вновь этерификацию метанолом:
СН3 СООН СООСНз
|
СООН СООСНз |
Фирма «Witten» разработала процесс производства диметил - терефталата совместным окислением я-ксилола и метилтолуила - та в каскаде из трех оксидаторов с температурой 140-147, 150-155 и 160-167°С. Затем оксидат этерифицируют метанолом в колонне при 240-260°С и давлении 2.5 МПа. Диметилтерефталат выделяют дистилляцией, перекристаллизовывают из метанола и вновь подвергают вакуумной ректификации.
Усовершенствованные процессы производства терефталевой кислоты и диметилтерефталата, разработанные фирмами «Degussa- Hьls AG» «Glitsch Technology Corp.» рассмотрены в главе 5.
Японская фирма «Mitsubishi Kasei» производит высокочистую терефталевую кислоту последовательным окислением каждой метильной группы п-ксилола через альдегидные группы до СООН [249].
Фирма «Praxair Technology, Inc.» запатентовала способ получения терефталевой кислоты, практически не содержащей окрашенных примесей, окислением д-ксилола чистым или близким к чистому кислородом в присутствии катализатора на основе Мп и Со, а также брома в качестве инициатора [250]. Кислород вводят способом, позволяющим создавать мелкие пузырьки для наиболее быстрого расходования. Реакция проводится в течение 1 ч при 170-190 °С и при давлении 0.63-2.1 МПа.
Аналогичный катализатор, включающий соединения Мп, Со, а также инициатор - соединения Вг, предложено использовать для получения терефталевой кислоты жидкофазным окислением д-ксилола, содержащего 3-35 % (мае.) я-толуилового альдегида. Окисление проводится кислородсодержащим газом при 120-240°С в растворителе - низшей алифатической монокарбоновой кислоте [251].
Чистая терефталевая кислота с примесью 4-карбоксибензаль - дегида не более 15 ppm получается с выходом 98 % трехстадийным окислением в присутствии каталитической системы, включающей Со, Мп, Вг, а также небольшие количества Ni, Cr, Zr и Се, в среде уксусной кислоты при 190-200°С. После второй стадии примеси экстрагируют уксусной кислотой, а основной продукт вновь окисляют кислородом [252].
Выход терефталевой кислоты возрастает при окислении п-ксилола в среде уксусной кислоты в реакторе, соединенном с ректификационной колонной, для регенерации непрореагировавшего д-ксилола, а также уксусной кислоты [253].
В усовершенствованном варианте процесса производства терефталевой кислоты окисление /i-ксилола осуществляется в реакторе с импеллером, создающим циркуляцию жидкости. Отвод теплоты производится в результате испарения органических веществ [254].
Отработанные газы, получаемые при производстве терефталевой кислоты, предложено охлаждать до 40 °С и после отделения конденсата пропускать последовательно через слои активированного угля, силикагеля и вновь активированного угля. При этом адсорбируются метилбромид, метилацетат, n-ксилол, бензол и толуол [255].
Предложено много методов очистки терефталевой кислоты. Так, фирма «Mitsubishi Chemical Corp.» запатентовала способ очистки растворением сырой терефталевой кислоты в воде и гидрированием при 260-320 °С в присутствии катализаторов платиновой группы [256]. Затем проводится кристаллизация те- рефталевой кислоты методом ступенчатого охлаждения водного раствора в каскаде кристаллизаторов сначала при 240-260°С, затем при 180-230 °С [257].
По способу «Amoco Corp.» очистку терефталевой кислоты осуществляют пропусканием водного раствора через слой катализатора - Pd или Rh, нанесенных на ТЮ2, в присутствии Н2 [258-260].
Предложено также растворять сырую терефталевую кислоту в водном растворе органического ди - или триалкиламина, например триметиламина. После отделения примесей от раствора соль терефталевой кислоты разлагают при 150-180 °С в атмосфере инертного или восстанавливающего газа или пара [261].
Японская компания «Mitsui Petrochemical Ind., Ltd.» запатентовала процесс очистки терефталевой кислоты от примесей
4- карбоксибензальдегида растворением ее в воде и окислением раствора при 230-300 °С и давлении 3-10 МПа кислородсодержащим газом на слое катализатора (оксиды Си, Со, Мо, двойные оксиды Cu/Zn, Со/Мо), а затем гидрированием раствора при 270-300°С и давлении водорода 0.5-1.5 МПа в присутствии катализатора платиновой группы или Fe-Co-Ni на активированном угле [262].
Чистую терефталевую кислоту можно получать из диметил - терефталата гидролизом в проточном реакторе с применением в качестве отдувочного газа для удаления метанола водяного пара [263].
Поликонденсацией терефталевой кислоты или диметилте- рефталата с этиленгликолем получают полиэтилентерефталат
|
|
Процесс проводится обычно в две стадии: сначала при 240- 270°С и давлении 0.1-0.2 МПа получают смесь бис(2-гидрокси- этил)терефталата с его олигомерами, затем протекает поликонденсация в каскаде реакторов с мешалками при постепенном повышении температуры от 270 до 300 °С и снижении давления от
6.6 кПа до 66 Па [264].
Описание технологической схемы и технико-экономические показатели процесса производства полиэтилентерефталата по лицензии фирмы «John Brown Deutsche Engineering Germany» приведены в работе [265].
Перспективными полимерными материалами являются также полибутилентерефталат и политриметилентерефталат. Эте - рификацией терефталевой кислоты или переэтерификацией диметилтерефталата 1,4-бутандиолом в присутствии тетрабу- токсититана получают бис(4-гидроксибутил)терефталат, а затем поликонденсацией его в вакууме при 240-2 50 °С - полибутилентерефталат. Полибутилентерефталат обладает высокими прочностью, жесткостью и твердостью, хорошими антифрикционными свойствами, стоек к ползучести. Он является хорошим диэлектриком, причем, в отличие от полиамидов, высокие электроизоляционные и механические свойства сохраняются в условиях повышенной влажности благодаря незначительному водопоглощению [264].
Взаимодействием раствора полиалкилентерефталата в низкомолекулярном многоатомном спирте и смеси алкоксилиро - ванных а - и Р-метилглюкозидов при 185-230 °С в условиях вакуумной перегонки предложено получать ароматические сложные полиэфириолиолы. Второй способ их получения состоит во взаимодействии сложноэфирной полиоловой компоненты с полиоло - вой компонентой, имеющей структуру простого эфира, в массовом соотношении (80-95): (20-5) соответственно. Сложноэфирная компонента получается взаимодействием полиалкилентерефталата с низкомолекулярными многоатомными спиртами в условиях вакуумной перегонки. Полиоловую компоненту со структурой простого эфира синтезируют этоксилированием метилглюко - зида алкиленоксидом в присутствии катализатора - хелатного комплекса Т1 с триэтаноламином. Полученные ароматические сложные полиэфирполиолы пригодны для производства жесткого полиуретана и пенополиизоциануратов [266].
Ароматические полиэфирполиолы получают также из диметилтерефталата и диэтиленгликоля. Особое значение приобрело использование отходов полиэтилентерефталата - только в Западной Европе необходимо рециклировать 500 млн. бутылок ежегодно. Ароматические полиэфирполиолы из вторичных ресурсов применяются для изготовления слоистых материалов и панелей [267].
Переэтерификацией диметилтерефталата при 160-180°С тремя эквивалентами смеси ИОН и С4Н9СН(С2Н5)СН2ОН в присутствии 0.3-0.8 % (мае.) вп-органического катализатора синтезирован с выходом 99.5 % 4-КООСС6Н4СООСН2СН(С2Н5)С4Н9, где И = изобутил или высший изоалкил. Полученный эфир - новый пластификатор для поливинилхлорида с улучшенными свойствами по сравнению с диизооктилфталатом [268].
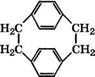
Пиролизом п-ксилола при 930-950 °С при массовом отношении я-ксилола к водяному пару 1 : (20-30) получают я-ксили - лен, при охлаждении которого в циклизаторе до 120°С образуется ди-я-ксилилен. Недостатком процесса является образование конденсированных аренов и кокса. При каталитическом пиролизе в присутствии КУ03 на корунде и металла VI группы температура процесса снижается на 70 °С, ди-я-ксилилен получается высокой чистоты [269].
В качестве катализаторов при пиролизе я-ксилола в присутствии водяного пара предлагается использовать шамот, кварцевое стекло, 3-4 % КЛГО3 на корунде, трифенилфосфин, а также инициаторы - гексан, пропан, оксид этилена. Выход ди-я-кси - лилена 98%, степень чистоты 99.9% [270]. Полимеризацией ди-я-ксилилена производятся термостойкие влагозащитные покрытия, волокна и пленки.
Пиролизом я-ксилола в других условиях может быть получен [2,2]-я-циклофан
|
|
Который также является мономером для синтеза поли-я-кси - лилена. Высокая энергия напряжения циклофанового цикла обеспечивает при термическом распаде высокую селективность образования я-ксилилена, адсорбция которого на твердых субстратах и последующая полимеризация приводят к образованию равномерных, бездефектных поли-я-ксилиленовых покрытий. Они применяются как покрытия для изделий радиоэлектроники, биосовместимые покрытия для медицины, при изготовлении мембран и в качестве влагозащиты для типографской продукции
[271].
[2,2]-я-Циклофан можно получать из я-хлорметилтолуола взаимодействием с триэтиламином в среде диоксана и элиминированием по Гофману образующейся четвертичной аммониевой соли нагреванием ее при 90 °С с 85 %-м раствором КОН. Выход продукта чистотой 99.8 % составляет 56.7 % [272].
Большой интерес для повышения теплостойкости покрытий представляет хлорзамещенный [2,2]-я-циклофан, получаемый либо хлорированием, либо реакцией Гофмана четвертичной аммониевой соли а,2-дихлор-я-ксилола [271]. Получение, свойства и применение поли-я-ксилилена и его производных рассмотрены в обзоре [273].
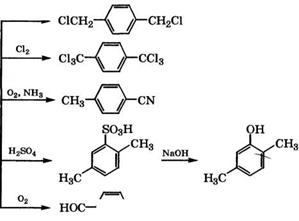
2,2'-Дихлор-ди-д-ксилилен может быть получен фотохимическим хлорированием 2-хлор-д-ксилола при 160-170 °С и далее взаимодействием образующегося 2-хлор-д-ксилилхлорида с три - метиламином при 0-5 °С. Полученный 2-хлор-4-метилбензилтри- метиламмонийхлорид термически расщепляют при 110-120 °С в концентрированном растворе щелочи, и целевой продукт выделяют экстракцией [274].
Д-Ксилилендихлорид, используемый для получения поли-д - ксилилена, образуется в качестве промежуточного продукта при хлорировании д-ксилола до гексахлор-д-ксилола. При прямом хлорировании д-ксилола содержание д-ксилилендихлорида в реакционной смеси составляет 40-50 % [94]. При хлорировании д-ксилола КаОС1 в присутствии катализатора - соли четвертичного аммониевого основания (хлорида бензилдиметилалкилам - мония) в хлороформе при добавлении концентрированной соляной кислоты (pH 1-5) получается реакционная смесь состава, % (мол.): д-ксилилендихлорид - 71.1, ксилилхлорид - 26.6, тере- фталевая кислота - 2.3 при почти полной конверсии д-ксилола [275].
Гексахлор-д-ксилол в промышленности получают жидкофазным хлорированием д-ксилола в присутствии 2,2'-азо-бис - изобутиронитрила в каскаде эмалированных реакторов при
85- 120 °С с выходом 80-85 %. Для ингибирования хлорирования в ядро процесс рекомендуется проводить в среде тетрахлормета - на или гексахлор-д-ксилола в присутствии 0.4-0.8 % (мае.) три - бутилфосфата, диметилформамида или их смесей [276].
Гексахлор-д-ксилол используется в производстве терефтало - илдихлорида и диметилового эфира тетрахлортерефталевой кислоты, применяющегося в качестве активатора вулканизации бутилкаучука, противоглистного средства.
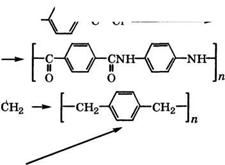
Поликонденсацией дихлорангидрида терефталевой кислоты с д-фенилендиамином или его дигидрохлоридом в среде амидных или амидно-солевых растворителей (гексаметилфосфотри - амид, N - мети лпирро лидон с СаС12, диметилацетамид с 1лС1) в промышленности производится поли-д-фенилентерефталамид [277]. Полученный полиамид применяется в основном для производства высокопрочного высокомодульного термостойкого волокна. Вместо д-фенилендиамина возможно использование при поликонденсации 3,4'-диаминодифенилоксида, хлор-д-фенилен - диамина, а вместо дихлорангидрида терефталевой кислоты - ди - хлорангидридов адипиновой, нафталиндикарбоновой кислот, хлор - ангидрида д-аминобензойной кислоты.
Взаимодействием дихлорангидрида терефталевой кислоты с
1,2,4- триаминобензолом получают д-фенилен-бис-5(6)-аминобен-
зимидазолы и на их основе - огнестойкое и высокопрочное волокно Туллен [54]:
О
II
С—С1
НгК-—МН2 + сі—с—
|
-2НгО |
![]() МН2
МН2
С—с—ИИ—ын2
*ш2 Н2М
|
Ин2 |
|
I Н |
![]() I
I
I
+ 2пНС1
|
|
Волокно Туллен имеет высокий кислородный индекс (более 21 %), поэтому отличается огнестойкостью на воздухе; в поглощении влаги не уступает хлопку; имеет высокую адгезионную способность к резине, механически прочное, может применяться и в качестве шинного корда.
Окислением п-ксилола кислородсодержащим газом при 390- 410 °С в присутствии ГШ3 и катализатора мольного состава У205: 8Ь205: ¥03= 1 : (1-2): (4-10) может быть получен /г-толу - нитрил. Мольное соотношение /г-ксилол : 02: КН3 = 1 : (40-65): : (10-15) [278]. /г-Толунитрил является исходным продуктом для синтеза производных триазина, применяемых для получения термостойких полимеров и физиологически активных веществ.
Сульфированием /г-ксилола при 142-145 °С в течение 4 ч может быть получена 2,5-диметилбензолсульфокислота с выходом 90 %, при сплавлении которой со щелочью при 320-330 °С в течение 2 ч образуется 2,5-ксиленол с общим выходом 77.3 % и степенью чистоты 98.3 % [279].
Селективным окислением д-ксилола в смеси изомеров ксилола можно получать диальдегид терефталевой кислоты в присутствии Fe-Мо-боросиликатных молекулярных сит в качестве катализатора. Боросиликат частично деборируется, селективность образования альдегида повышается при обработке внешней поверхности катализатора тетраметилортосиликатом [280].