ОСНОВЫ ПРОЕКТИРОВАНИЯ. ХИМИЧЕСКИХ ПРОИЗВОДСТВ. И ОБОРУДОВАНИЯ
Термодинамический анализ процессов
Термодинамический анализ позволяет оценить:
• энергетическую возможность и направление протекания реакций;
• сопровождающие реакции тепловые изменения, позволяющие рассчитывать тепловые балансы процессов;
• предпочтительность реакций и устойчивость образующихся соединений;
• пути подавления нежелательных реакций и устранения побочных продуктов;
• выбор оптимального режима протекания реакций (температуры, давления и концентрации реагирующих веществ).
7.2.1. Равновесие химической реакции
Константа равновесия, как постоянная величина, определяется через равновесные активности компонентов реакции:
Ж=№*Л (7.1)
где Ка - константа равновесия, выраженная через равновесные активности; а* - равновесная активность і-го компонента реакции; v, - стехиометрический коэффициент /-го компонента с соответствующим знаком (минус - для реагентов, плюс - для продуктов реакции).
Большинство химических процессов протекает при практически постоянном давлении. В этом случае равновесие можно характеризовать энергией Гиббса (изобарно-изотермическим потенциалом). Изменение энергии Гиббса в процессе химической реакции описывается соотношением:
AG = - RTIпШ-W + /Г/'In ГК'- (7.2)
Если исходные реагенты находятся в стандартном состоянии, т. е. Qi= 1, то второе слагаемое в уравнении (7.2) равно нулю и получается известная изотерма Вант-Гоффа:
AG° =-RTnKa, (7.3)
где AG0 - стандартное изменение энергии Гиббса.
Величину ДС/° можно определить по стандартным изменениям энтальпии и энтропии
AG0 =АН° - Ш°. (7.4)
Уравнения (7.3) и (7.4) являются основой для расчета равновесий. Следует указать, что при равновесии равно нулю AG, но не AG0, поэтому знак AG определяет направление реакции. При AG < 0 реакция идет в прямом направлении, а при AG > 0 - в обратном. При AG = 0 система находится в равновесии.
Стандартным состоянием для газов и паров принято считать идеальное газовое состояние при давлении 101,325 Па» 0,1 МПа (1 ата) и при температуре 298,15 К (25 °С). Именно при этих параметрах приведены в термодинамических таблицах значения Д, ДЯ^, AS^.
Для химической реакции изменение энергии Гиббса, энтальпии и абсолютной энтропии можно вычислить как их сумму для продуктов реакции и реагентов с учетом знака стехиометрических коэффициентов:
Д^298 = Z v/AG/,298> Л^298 = Z ^уДЯуд98^ ^298 = ^Уі^іЛ98 • Обычно активность идеального газа равна отношению его парциальных давлений в данном и стандартном состоянии:
В физической системе единиц pf =1 атм, поэтому безразмерная активность численно равна его парциальному давлению. При переходе к системе СИ это соответствие нарушается, вследствие чего
^(мпа)=^ки„)-0.101325^'
![]()
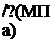 ■•^^ + EVi-ln(0,101325) = _^L-2,28942E
■•^^ + EVi-ln(0,101325) = _^L-2,28942E
RT RT
Приближенный метод оценки константы равновесия для идеального газа дает соотношения
AG029s = AH°29s-TAS°29s; In
Ошибка в определении Кр в этом случае достигает 20 %, и тем выше, чем выше температура процесса. Термодинамические функции за
висят от температуры, что должно учитываться при точном расчете константы равновесия для идеального газа.
Функциональная зависимость константы равновесия от температуры при постоянном давлении определяется уравнением изобары Вант - Гоффа
где А//1 - изменение энтальпии процесса в стандартном состоянии.
Если А/7° не зависит от температуры, что справедливо в узком интервале температур, то уравнение (7.6) можно проинтегрировать. Интегрируя его в пределах от Т до 72, получим
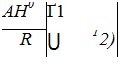
![]()
![]() кр(т2)
кр(т2)
КМ)
Отсюда видно, что если Т < Т2, то при эндотермической реакции Л К(Т2)
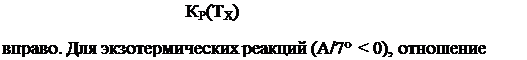 (ATT > 0) отношение —----- больше единицы и равновесие сдвигается
(ATT > 0) отношение —----- больше единицы и равновесие сдвигается
КР(Т2)
КЛТХ) меньше единицы и равновесие сдвинуто влево.
Используя уравнение (7.7) для узкого интервала температур, можно найти значение константы равновесия для температуры Т2, если известно аналогичное значение для температуры Т.
Более точное определение константы равновесия с учетом ее температурной зависимости заключается в следующем. Для энергии Гиббса зависимость от температуры имеет вид:
Стандартное изменение энтальпии также зависит от температуры в соответствии с законом Кирхгофа:
![]() d(AH°)
d(AH°)
dT
где АСР - разность изобарных теплоемкостей продуктов реакции и реагентов, определяемых уравнением при учете стехиометрии
А Ср=^Срі.
Тогда стандартные значения энтальпии и энтропии примут вид:
т т АС
![]()
![]() ДЯ» = ДЯ2% + J £CpdT; AS? = AS2% + J —£
ДЯ» = ДЯ2% + J £CpdT; AS? = AS2% + J —£
298 298 L
При этом точное уравнение для энергии Гиббса будет
ДС/у1 = АН^ - TASy ;
Приближенным решением этого уравнения является решение, предложенное Темкиным и Шварцманом [68]. Метод основан на применении регрессионного уравнения зависимости теплоемкости от температуры вида:
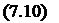 С =а + ЬТ + сТ2
С =а + ЬТ + сТ2
і у Z
где а, Ь, с и с_2 - постоянные для данного вещества.
Тогда, после использования последних, получается:
AGj = ДЯ298 - У'ДД298 - Т(АаМ0 + ДШ, + АсМ2 + Ас_2М_2)
где Mo, Mi, М2 и М_2 - интегралы, выраженные в виде
![]() т dT т т dT т
т dT т т dT т
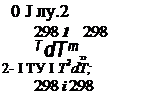 j^jdT - Mj = j I TdT
j^jdT - Mj = j I TdT
298 I 298
_ dT T. dT
^-2 I r2 J r2
298 У 298 1
Формулы расчета этих интегралов для базисной температуры
Т0 = 298,15 К имеют вид:
Т Т (Т — Т Л2
М0 =1п---- ь —-1; ML = 0,0005--------
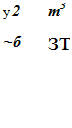 |
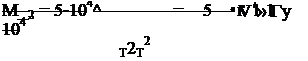 |
||
Tq Т Т
Значения этих интегралов табулированы (см. например [68, 71]) в пределах от 300 до 3000 К через 100 К и могут использоваться при интерполяции.
Тогда уточненный расчет константы равновесия можно произвести по формуле
При повышенном давлении или при состоянии системы, близком к насыщенному пару, газы не могут считаться идеальными. В этом случае используют выражения констант равновесия и изотермы Вант-Гоффа через активности компонентов. Для этого вводится понятие летучести или фугитивиости/ удовлетворяющей условию
dG = - RTd( In/).
При этом стандартная летучесть/0 равна летучести газа в идеальном состоянии при давлении 101,325 кПа.
Активность - это отношение фугитивиости газа в данном и в идеальном состоянии:
![]() ft
ft
fl
Коэффициентом активности газа называют отношение его фуги- тивности к парциальному давлению:
При давлении 1 атм реальный газ можно считать идеальным, поэтому /° = 1 атм. Тогда
Изотерму Вант-Гоффа для реальных газов можно привести к следующему виду (Кр выражена в атм.):
AGj = - RTnKa = - RTnUa-v' = - Я7’1п(п рГ ' П У Г ) = - RTn(Kp • Ку).
Коэффициент активности определяется различными методами, которые описаны в литературе по физической химии [68] или по расчету физико-химических свойств газов [20, 28, 29].
Коэффициент активности для реального газа можно найти по принципу соответствующих состояний. Согласно этому принципу значения коэффициента активности для любых реальных газов являются одинаковыми, если они находятся при одинаковых приведенных температуре и давлении (см. рис. 7.1). При этом
Т Р
Т =----------- 71 =----------------------- ,
Т V
*кр /кр
где т и п - приведенные температура и давление;
Тир - действующие температура и давление;
УКр и /Лер - критические температура и давление.
Данные по коэффициенту активности табулированы и имеются в литературе (см., например, [18]). Значения критических температур и давлений можно найти в литературе в специальных таблицах или рассчитать. Их расчет описан в [20, 28].
Изменение стандартной энергии Гиббса для жидкофазной реакции будет равно:
дс"=дог° + га-1п(пй")>
где Pi - парциальное давление пара і-го компонента над жидкостью.
Соотношение между константами равновесия в жидкой и газовой фазе составляет:
к„ = кр[пргУ,
где К„ - константа равновесия, выраженная через молярные доли компонентов, при этом Кп = ППГ (пі ~ молярная доля компонента).
|
Коэффициент активности у |
|
Рис. 7.1. Зависимость коэффициента активности газов от приведенных давления и температуры |
Рассмотренный метод не пригоден для растворов сильно отклоняющихся от законов Генри и Рауля. К таким растворам относится большинство систем, представляющих практический интерес. В этом случае необходимо использовать константу равновесия, выраженную через коэффициенты активности [28].