Доклады о будущих и современных технологиях
СИНТЕЗ 3-АЦИЛЗАМЕ ЩЕННЫХ 1-ГИДРОКСИИНДОЛ-5,6-ДИКАРБОНИТРИЛОВ
М. В. Кабанова, А. В. Шалина, Ж. В. Чиркова
Научный руководитель - Ж. В. Чиркова, канд. хим. наук, ст. преподаватель
Ярославский государственный технический университет
Синтез замещенных 3-ацилиндолов весьма актуален, поскольку ин - дольный цикл является одним из ключевых фрагментов для получения многих биологически активных соединений и лекарственных субстанций. Как правило, подобные соединения получают ацилированием или форми - лированием по реакции Вильсмайера-Хаака предварительно синтезированного индола, либо циклизаций этенильных субстратов, содержащих в Орто-положении нитрогруппу, с использованием катализаторов на основе комплексов палладия или родия. Данных о получении 3-ацилзамещенных 1-гидроксииндол-5,6-дикарбонитрилов в литературе нет.
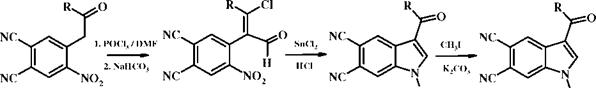
На основе ранее синтезированных соединений 1 (а-с) был разработан двустадийный метод синтеза новых 3-ацилзамещенных 1-гидроксииндол-
5,6- дикарбонитрилов 3 (а-с).
|
|
|
Он |
|
4 (a-c) |
|
1 (a-c) 2 (a-c) 3 (a-c) 1, 2, 3, 4: a - R=4-MeC6H4; b - R=4-MeOC6H4; c - R=2-thienyl |
|
О |
|
/ |
Установлено, что на первой стадии в результате использование двукратного избытка хлорокиси фосфора происходит формилирование с одновременным хлорированием карбонильной группы соединений 1 (а-с) с образованием соединений 2 (а-с). На второй стадии при восстановлении синтезированных субстратов 2 (а-с) двухвалентным оловом в соляной кислоте одновременно происходило гидролитическое замещение атома хлора и внутримолекулярная циклизация с образованием соответствующих
3- карбонилзамещенных 1-гидроксииндол-5,6-дикарбонитрилов 3 (а-с). Образование именно 1-гидроксииндолов 3 (а-с) было доказано алкилировани - ем ОН-группы с образованием соединений 4 (а-с). Строение всех полученных соединений было установлено на основании совокупности данных ИК-, 1Н ЯМР-спектроскопии и масс-спектрометрии и подтверждено результатами двумерной 1Н-1Н и 1Н-13С ЯМР-спектроскопии.