СТРУКТУРНАЯ ТЕОРИЯ БУТЛЕРОВА
Александр Бутлеров с детских лет увлекался химией, и когда пришло время поступать в университет, он без колебания выбрал естественное отделение философского факультета. В Казанском университете, куда поступил Бутлеров, преподавали выдающиеся учёные, которые горячо любили химию сами и умели увлечь за собой студенческую молодёжь. Огромное влияние оказал на Бутлерова его учитель — знаменитый химик Николай Николаевич Зинин.
Особенно заботливо относился к Бутлерову гениальный русский математик Николай Иванович Лобачевский, бывший в то время попечителем учебного округа. По рекомендации Зинина, Лобачевского и других учёных Бутлеров был оставлен при университете.
Защитив магистерскую, а затем и докторскую диссертацию, Бутлеров в 26 лет стал профессором химии. К 30 годам он был одним из самых образованных химиков своего времени.
Уже первые работы А. М. Бутлерова затрагивали очень важные вопросы органической химии.
В 1861 году Бутлеров впервые осуществил синтез сахара, действуя на водный раствор формальдегида (применяемого для протравливания семян и известного под названием «формалин») раствором гашёной извести.
Сахарй — это сложные органические соединения. Даже такой сравнительно простой сахар, как виноградный, называемый глюкозой, содержит в своей молекуле 24 атома. Сахарй относятся к важным для питания человека и животных веществам — углеводам. Из этого ясно, какой выдающийся интерес представлял синтез. сахара.
В том же 1861 году А. М. Бутлеров начал блестящие теоретические исследования, прославившие русскую науку.
До Бутлерова учёные думали, что установить, как построены молекулы,— невозможно-Такая задача была объявлена неразрешимой. Любые попытки определить взаимное расположение атомов в молекулах считались безнадёжным занятием. Многие учёные, последователи фи- лософа-идеалиста Канта, объявили, что строение молекул
|
Александр Михайлович Бутлеров (1828—1886). |
Является непознаваемой «вещью в себе». Считалось поэтому, что химики должны ограничиться только изучением поведения химических веществ во время реакций и не пытаться проникнуть в тайны строения самих молекул.
А между тем накопленный в химии большой фактический материал находился в явном противоречии с такими взглядами.
Ещё в 185Э году при исследовании леггучих органиче - еких соединений металлов было обнаружено, что различные атомы соединяются друг с другом только по определённым затонам. Каждый атом одного вещества способен соединяться только с определённым числом атомов другого вещества. Чтобы сравнивать атомы в этом отношении, рассматривают их способность соединяться с атомами водорода.
Есть атомы (например, атомы хлора), способные соединяться не более чем с одним атомом водорода. Атомы серы и кислорода соединяются с двумя атомами водорода, азота — с тремя, а углерода — с четырьмя атомами водорода. Водород может всегда соединяться только с одним атомом какого-либо другого элемента.
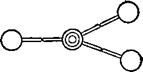
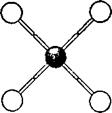
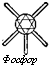
Способность атома соединяться с определённым числом атомов другого элемента называется валентностью. Атом хлора может соединиться только с одним атомом водорода, и поэтому хлор считается одновалентным; кислород и сера — двухвалентны, азот — трёхвалентен, углерод — четырёхвалентен.
Ниже условно изображены атомы наиболее часто встречающихся в органических соединениях элементов с их валентностями.
|
|||
|
|
||
|
|||
|
Азот |

|
Фосфор |
 Т
Т
Углерод
Глубоко изучив весь этот материал, Бутлеров неопровержимо доказал, что молекулы представляют собой не хаотические скопления атомов, а стройные устойчивые системы, где существует определённый порядок в расположении атомов. В самом деле, молекула воды, например, может быть построена только так, что оба атома водорода соединены с одним атомом кислорода. Никакого другого порядка связи быть не может. Если бы оба атома водо-
Рода были прямо связаны друг е другом, то они использовали бы свои валентности полностью и не смогли бы со* единиться с кислородом.
|
|
Молекула воды
Единственный порядок расположения атомов возмо-- жен и для молекулы аммиака, состоящей из одного атома азота и трёх атомов водорода.
|
|
Молекула аммиака Точно так же обстоит дело и с метаном, или болотным газом, в котором молекула вещества состоит из одного атома углерода и четырёх атомов водорода.
|
|
Молекула метана
В молекуле углекислого газа на один четырёхвалентный атом углерода приходится два двухвалентных атома кислорода.
|
Молекула углекислого газа |
Химики изображают атомы различными буквами латинского алфавита. Вот современное изображение некоторых элементов: водород — Н (аш), хлор — С1 (хлор), кислород О (о), сера — Э (эс), азот — N (эн), фосфор — Р (пэ). Соответственно, молекулы изображаются следующим образом: вода Н—О—Н (чёрточки между
Атомами обозначают валентность), аммиак Н—N,
I
Метан Н—С—Н, углекислый газ О = С = (X Н
Таким образом, атомы в молекулах расположены в определённом порядке; молекулы обладают определённым химическим строением, которое химик может установить, исследуя вещество.
Основную идею своей теории А. М. Бутлеров высказал так: «Исходя из мысли, что каждый химический атом, входящий в состав тела, принимает участие в образовании этого последнего и действует здесь определённым количеством принадлежащей ему химической силы (сродства), я называю химическим строением распределение действия этой силы, вследствие которого химические атомы, посредственно или непосредственно влияя друг на друга, соединяются в химическую частицу».
Установив понятие химического строения, А. М. Бутлеров создаёт новое понятие природы вещества вообще. Он пишет:
«Химическая натура сложной частицы (то-есть молекулы) определяется натурой элементарных составных частей (то-есть атомов), количеством их и химичеоким строением».
Создав понятия химического строения и природы вещества, А. М. Бутлеров вывел органическую химию из теоретического тупика, указал путь к проникновению в глубь молекул, к познанию их внутреннего строения. Он дал основу для понимания химических процессов, для открытия новых путей органического синтеза.
Теория Бутлерова сразу же получила боевое крещение, блестяще объяснив ряд вопросов, раньше совершенно непонятных.
Следуя за Берцелиусом, химики считали, что свойства вещества могут изменяться только после изменения его
Состава. Другими словами, если молекула вещества состоит, например, из двух атомов углерода, шести атомов водорода и одного атома кислорода (С2Н60), то никак нельзя ожидать, чтобы нашлось другое вещество, обладающее таким же составом, но другими свойствами.
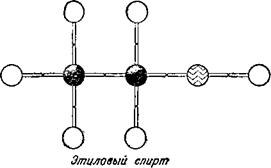
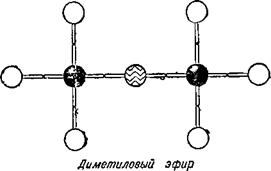
Однако химики открыли два различных вещества с одинаковым составом: С2Н60. Одно из них было давно известно: это — этиловый или винный спирт — жидкость, кипящая при 78,4°. Другое вещество, открытое значительно позднее,— диметиловый эфир —
Представляет собой газ с приятным эфирным запахом, превращающийся в жидкость при охлаждении его до минус 23,6°. Два совершенно различных вещества имеют одинаковый состав! Как это можно объяснить?
Да ведь всё это совершенно ясно,— решил Бутлеров,— что из того, что состав этих веществ один и тот же? Ведь из одинакового количества строительного материала, например, кирпича, досок, железа, стекла, можно выстроить различные здания. Сходным образом природа построила из двух атомов углерода, шести атомов водорода и одного атома кислорода две различные молекулы, расположив в каждой из них «строительный материал» по - разному.
В молекуле спирта кислород связан с углеродом и водородом, а в молекуле эфира — с двумя атомами углерода.
Бутлерову стала ясной тайна огромного многообразия органических соединений. Оказывается, дело не только в том, что углерод способен образовывать длинные цепи. Не менее важная причина заключается в возможности различного расположения атомов в молекулах, обладающих одинаковым составом.
Честь открытия и объяснения этого замечательного явления, называемого изомерией, принадлежит Бутлерову.
Число изомеров — веществ с одинаковым составом, но разным строением — может быть огромным даже для таких веществ, которые в своём составе имеют только два рода атомов — углерод и водород. Так, для г е к - с а н а, молекула которого состоит из шести атомов углерода и 14 атомов водорода, возможно пять изомеров; у эйкозана, молекула которого состоит из 20 углеродных и 42 водородных атомов, число возможных изомеров рав-
няегся 366 319, а у тетраоконтана (40 углеродов и 82 водорода) может быть 62 491 178 805 831 изомер!
 Молекулы изомеров отличаются друг от друга внутренним расположением атомов, то-есть своим строением, структурой. Свойства органических веществ в пер-
Молекулы изомеров отличаются друг от друга внутренним расположением атомов, то-есть своим строением, структурой. Свойства органических веществ в пер-
Вую очередь определяются строением, структурой молекул. Вот почему Бутлеров назвал свою теорию теорией строения, или структурной теорией.