«Современные химические источники тока»
Никель-кадмиевые и никель-железные аккумуляторы Cd ½ KOH ½ NiOOH и Fe ½ KOH ½ NiOOH
Рассмотрим эти две электрохимические системы вместе, так как они имеют много общего. Никель-кадмиевые (НК) и никель-железные (НЖ) аккумуляторы долгое время занимали второе место в мире после СА по распространенности. Но в XXI веке их выпуск постепенно снижается: начиная с 1990-х годов их стали теснить новые системы – литий-ионные и металлогидридные аккумуляторы. При этом Россия остается ведущей страной по выпуску НЖ аккумуляторов.
НК аккумулятор был предложен в 1899 году, серийное производство началось в 1910 году. Начало производства герметичных НК аккумуляторов относится к 1950 годам.
Удельная энергия НК и НЖ аккумуляторов практически такая же, как у свинцовых, и в зависимости от типа и условий эксплуатации лежит в интервале 20 – 35 Вт×ч/кг или 40 – 70 Вт×ч/л, но они имеют гораздо больший ресурс – до 2000 циклов, могут разряжаться большими токами (до 10С у некоторых разновидностей) и могут изготавливаться в полностью герметичном исполнении, не требующем никакого ухода. Герметичные – это только НК аккумуляторы, для них достигнута энергия 30 – 50 Вт×ч/кг или 60 – 150 Вт×ч/л. НК имеют лучшие характеристики, а НЖ – хуже, но в них нет дорогого и токсичного кадмия.
Fe имеет чуть более отрицательный равновесный электродный потенциал (E0 = –0.05 В), чем водородный электрод, а Cd чуть более положительный (E0 = +0.02 В). Другими словами, Fe расположен в ряду напряжений левее Н, а Cd – правее. Поэтому для Cd процесс коррозии за счет вытеснения Н2 из воды термодинамически невозможен, а Fe может медленно корродировать (и корродирует).
Основные полуреакции следующие:
(–) Cd + 2OH - « Cd(OH)2 + 2e
(+) NiOOH + H2O + e « Ni(OH)2 + OH -
Суммарная токообразующая реакция:
разряд
Cd + 2 NiOOH +2H2O « 2 Ni(OH)2 + Cd(OH)2
заряд
Для железа – аналогичные реакции. Это упрощенная схема. На положительном электроде протекают более сложные процессы, так как оксиды никеля существуют в нескольких модификациях, различающихся степенью гидратации (NiOx∙yH2O). Из-за образования при заряде оксидов четырехвалентного никеля НРЦ свежезаряженного аккумулятора достигает 1.45 – 1.7 В, что намного превышает теоретическое значение ЭДС, равное 1.30 В для НК и 1.37 В для НЖ. Постепенно высшие оксиды распадаются, и НРЦ принимает стационарное значение 1.30 – 1.34 В для НК и 1.37 – 1.41 В для НЖ, что также выше ЭДС.
Электролитом является 20 – 28 масс.% раствор KOH. Щелочь не участвует в суммарной токообразующей реакции, поэтому контроль плотности электролита не используют. При работе до –150С употребляют 20% КОН (r = 1.2 г/см3) с добавкой 10 г/л LiOH. Если аккумулятор рассчитан на работу до –400С, применяют 28% КОН (r = 1.27 г/см3) для увеличения электропроводности и снижения температуры замерзания.
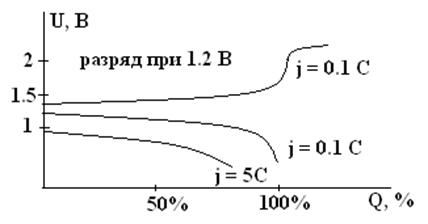
Зарядные и разрядные кривые никель-кадмиевого аккумулятора (схематично)
Температурная зависимость емкости и напряжения НК и НЖ аккумуляторов выражена менее резко, чем у других электрохимических систем. НК вполне работоспособны при –400С, причем они даже способны и заряжаться при –400С! Для НЖ рабочим пределом является температура –100С. Ресурс работы для разных типов составляет от 500 до 2000 – 5000 циклов. Срок службы – 10 лет, а для некоторых типов – 25 лет и более. Для НЖ характерен высокий саморазряд, до 25 – 35% в месяц при 200С.
Конструктивно выпускаются несколько различных вариантов. В негерметичных аккумуляторах используют обычный принцип призматической баночной конструкции, аналогично рассмотренным выше. Требуется периодически доливать дистиллированную воду. Герметичные НК аккумуляторы изготавливают призматические баночные, дисковые и цилиндрические.
Герметичные НК аккумуляторы не требуют никакого ухода. В них при избыточном заряде (перезаряде) реализуется так называемый кислородный цикл. После полного окисления Ni(OH)2 избыточный заряд тратится на окисление гидроксид-ионов щелочи по реакции
перезаряд
2OH - → 1/2O2 + H2O + 2e
Выделяющийся на «плюсе» кислород проникает через сепаратор на отрицательный электрод и восстанавливается на нем по обратной реакции
1/2O2 + H2O + 2e → 2OH-
Суммарно никаких химических изменений в электролите не происходит, вся энергия превращается в тепло. По этой причине в конце разряда герметичный аккумулятор нагревается. Если ток заряда меньше критического значения, герметичные НК аккумуляторы допускают неограниченный перезаряд.
НК и НЖ аккумуляторы заряжают постоянным током. В отличие от СА, они могут длительно храниться как в заряженном, так и в полуразряженном или разряженном состоянии. Наиболее высокие удельные характеристики имеют цилиндрические рулонные конструкции аккумуляторов, наиболее низкие – дисковые конструкции. Это связано с толщиной электродов и с особенностями конструкции. Из-за сравнительно низкого напряжения НК и НЖ систем требуется большее число элементов в батарее (например, 10 штук для создания 12 В батареи). Это, а также сравнительно высокая цена являются недостатками, в остальном же НК превосходят СА.