ЭЛЕКТРИЧЕСТВО В АТОМАХ
|
Ярибор, измеряющей пок |
|
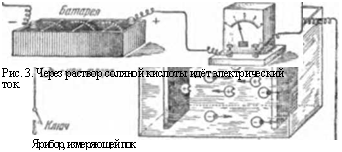
Рис. 3. Через раствор соляной кислоты идёт электрический ток. |
 |
Т) тридцатых годах прошлого века при изучении дей - ствия тока на различные растворы учёные впервые столкнулись с одним очень интересным явлением. Это яв-
Ление можно обнаружить в следующем простом опыте.
Нальём в стакан (рис. 3) крепкий раствор соляной кислоты (соляная кислота — это химическое соединение
водорода с хлором) и опустим туда две платиновые пластинки — электроды. Соединим их с полюсами какого-нибудь источника постоянного электрического тока, например, батареи. Мы увидим, что на электродах начнут появляться пузырьки газов. На электроде, соединённом с положительным полюсом батареи, выделяется газ хлор, а на отрицательном — водород.
Будем пропускать через раствор соляной кислоты ток силой в один ампер. Это значит, что каждую секунду через раствор проходит громадный электрический заряд, равный одному кулону.
Заметим кстати, что ток силой в один ампер — это сравнительно слабый ток. В технике часто приходится иметь дело с токами в десятки тысяч ампер.
Но если бы нам удалось получить два заряда в один кулон каждый на двух телах, удалённых один от другого на целый километр, то они оттолкнулись бы или притянулись (в зависимости от знаков зарядов) с силой приблизительно в 900 килограммов. Практически такие заряды получить нельзя. В рассмотренных нами опытах по электризации трением мы имеем дело с зарядами, которые едва ли достигают стомиллионных долей кулона.
Если собрать и взвесить весь хлор, который выделился при прохождении через раствор одного кулона электричества, то оказалось бы, что на электроде выделилось 0,367 миллиграмма хлора. Когда через раствор пройдёт 10 кулонов электричества, хлора выделится ровно в 10 раз больше, то-есть 3,67 миллиграмма. То же самое можно заметить и на отрицательном электроде: если через раствор пройдёт один кулон электричества, то выделится одна сотая миллиграмма водорода, а если пройдёт 10 кулонов, то выделится одна десятая миллиграмма водорода, то-есть опять-таки ровно в 10 раз больше. Сколько бы раз мы ни повторяли этот опыт, результат будет один и тот же.
Вместо соляной кислоты можно взять, например, поваренную соль — соединение хлора с металлом натрием — и проделать такой же опыт с раствором этой соли. Оказывается, и в этом случае можно подметить то же самое: при прохождении через раствор одного кулона электричества на положительном электроде всегда выделяется именно 0,367 миллиграмма хлора.
Как можно объяснить это поразительное соотношение? Почему одному и тому же количеству электричества так строго соответствует одно и то же количество вещества?
Вспомним, как построены окружающие нас тела. Все они состоят из мельчайших частиц — атомов. Атомы могут соединяться друг с другом в более сложные частицы — молекулы. Соляная кислота, например, состоит из таких сложных частиц. В каждую молекулу её входит один атом водорода и один атом хлора. Но если оба эти газа начинают выделяться из раствора соляной кислоты под действием тока, то, значит, молекулы соляной кислоты разрушаются, распадаются в растворе на отдельные атомы.
Водород всегда выделяется из раствора на отрицательном электроде. Не означает ли это, что атомы водорода каким-то путём получают в растворе положительный заряд? Тогда они, конечно, будут притягиваться к отрицательному электроду, как притягивается положительно заряженный бузинный шарик к наэлектризованной палочке сургуча.
Так же просто мы можем объяснить и выделение хлора на положительном полюсе: атомы хлора получают отрицательный заряд и поэтому идут к положительному электроду.
Но почему же одинаковое количество электричества, прошедшего через раствор, всегда связано с одним и тем же количеством выделенного у электродов вещества, то-есть с одним и тем же числом атомов? Может быть, и электрический заряд тоже состоит из отдельных атомов электричества? Тогда можно предположить, что каждый атом вещества несёт с собой один или несколько атомов электричества. И если это действительно так, то мы легко объясним результаты опыта: если через раствор прошёл заряд в один кулон, то, значит, этот заряд был перенесён каким-то совершенно определенным числом атомов вещества.
Можно ли узнать, какой заряд несёт с собой через раствор каждый атом, например атом хлора? Можно. Для этого нужно только подсчитать, сколько всего атомов хлора выделилось на электроде. Мы знаем, что если через раствор прошёл один кулон электричества, то
Выделилось 0,367 миллиграмма хлора. Вес одного атома хлора, как и вес атома любого другого элемента, хорошо известен; значит, можно подсчитать, сколько атомов находится в таком количестве хлора. Зная число атомов, которые перенесли с собой заряд в один кулон, нетрудно вычислить, какая доля кулона приходится на каждый атом.
Опыты по определению зарядов атомов проводились с растворами самых различных веществ, и вычисления зарядов привели к замечательным результатам. Оказалось, что атом хлора, атом водорода, атом натрия, а также атомы некоторых других веществ несут с собой всегда один и тот же и притом очень маленький заряд.
Он равен всего 1х710 ооо ооо ООО ООО ооо сюо кулона (у хлора этот заряд отрицательный, а у водорода и натрия положительный). Есть атомы, у которых заряд ровно вдвое или ровно втрое больше, чем у атомов водорода, но заряд атома никогда не бывает равным полутора, двум с половиной или вообще дробным долям заряда атома водорода.
Какой важный вывод мы можем отсюда сделать? По - видимому, наше предположение о том, что электрический заряд состоит из мельчайших неделимых порций положительного и отрицательного электричества, из атомов электричества, вполне справедливо, и мы вправе считать, что электрические частицы тесно связаны с атомами любых веществ. При растворении эти электрические частицы перемещаются от одного атома к другому так, что один «осколок» молекулы оказывается заряженным положительно, а другой — отрицательно. Такие заряженные осколки молекул были названы ионами, — от греческого слова «ион», означающего идущий, странствующий. Электрический ток в растворах — это два встречных потока положительных и отрицательных ионов.