Роль котлов в промышленной теплоэнергетике
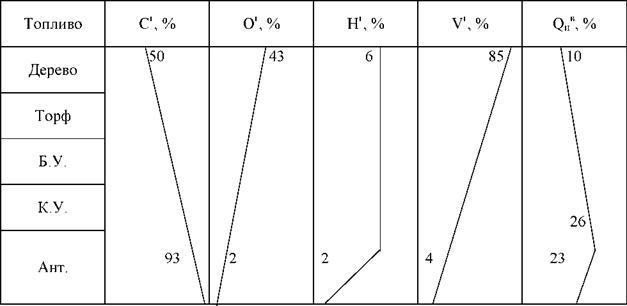
Приведенные характеристики топлива
Для сравнения экономичности котлов сжигающих различное топливо введено условное
|
Р МДж |
![]() Топливо.
Топливо.
0рн.(усл.) = 29, 3
Кг
В = В • "н
Усл нат
^усл
|
1. п =- |
![]() Для оценки массовых расходов влаги, золы и серы существуют приведенные характеристики:
Для оценки массовых расходов влаги, золы и серы существуют приведенные характеристики:
О н Р
Если Wп < 0.75, то топливо маловлажное, если же Wп > 2 — высоковлажное.
АР
2. Ап =■А
|
О |
![]() Р
Р
Н
Если Ап < 1, то топливо малозольное, а если Ап > 4 - высокозольное. БР
3. Бп =
Р
Н
Если Бп > 0, 05 — мазут высокосернистый, если Бп > 0.2 — высокосернистый уголь.
|
Изменение характеристик топлива:
|
Газовое топливо.
Состав:
СН4 + !СтИп + СО + НзБ + Н2 + СО2 + N2 + Б02 + О2 = 100% СН4 + £СтН„ + СО + Н2Б + Н2 — горючие вещества,
С02 + N2 + Б02 + 02 — негорючие вещества.
0 Нв = 0, 01 ■ (СН4 ■ 0еН4 + !СтИп ■ ОюшИп + СО ■ О СО + Н2Б ■ О И28 + Н ■ Ои2),
Кг
Природный газ.
Имеет органическое происхождение. Природный газ образовался в полостях земли при давлении более 200 атм.
Месторождения:
1 Тюменская область;
2^ Республика Коми;
3^ Южный Урал;
4^ Ставрополье.
Состав:
СН4 + ХСтНп + СО2 + N2 = 100%,
СН4 = 70-99%, ХСтНп = 1-10%, СО2 < 2%, N2 < 14%^
Особенности:
1 ■ Отсутствие внешнего балласта (влажность и зольность),
2^ мало внутреннего балласта ( содержание азота менее 14%, а кислорода равно 0%),
3 ■ содержание серы равно 0%,
МДж
4^ высокая удельная теплота сгорания (Осн. = 34-38, --- 3—),
М
Кг
5^ плотность рг = 0, 7-0, 9, —,
М3
6^ взрываемость
Взрыв
|
Горит |
![]() Не горит
Не горит
---------------------- +У
Сниз Сверх т %
Возд
7^ токсичность за счет СО, Н2Б
ПДКСО = 0, 024%(предельная допустимая концентрация),
ПДКшэ = 0, 01%^
8^ нет цвета и запаха.
Для обнаружения природного газа в него вводят одерант в количестве 10 г на 1000 м3 газа.
Попутный газ.
Образуется при добыче нефти, при резком снижении давления.
Состав:
СН4 = 40-60%, ХСтНп = 25-35%, N2 = 20°% дс,. = 36-46
М3
|
} |
![]()
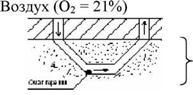 Подземный (генераторный) газ. генераторный газ + О2
Подземный (генераторный) газ. генераторный газ + О2
Порода
Угольный пласт
Во входном штреке происходит окисление С и Н:
С + О2 = СО2
Н2 + О2 = Н2О
В выходном же штреке протекают восстановительные реакции:
СО2 + С = СО Н2О + С = СО + Н2 Состав:
СО = 15%, Н2 = 15%, СО2 = 10%, N2 = 60%. д%. = 4
М
|
Состав: СО = 30%, Н2 = 1%, СО2 = 10%, N2 = 60%. |
![]()
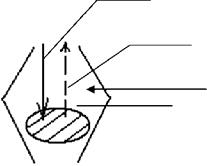
|
СО2 + С = СО Воздух Зона активного горения С + О2 = СО2 |
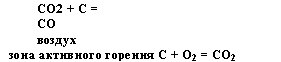 Доменный газ. Шихта(руда + кокс)
Доменный газ. Шихта(руда + кокс)
Р%. = 4
М
Коксовый газ.
Получается при производстве кокса при 1 = 500 - 1000?С. Состав:
СН4 = 25%, Н2 = 45%, N2 = 5%.
Р%. = 38
М
Жидкое топливо.
Природное топливо - нефть, имеющая органическое происхождение, представляет собой смесь жидких углеводородов. Добывается через скважины за счет собственного давления. Месторождения:
1. Тюменская область;
2. Республика Коми;
3. Башкирия;
4. Татарстан;
5. Северный Кавказ.
Мазут - остаток нефтепереработки на нефтеперерабатывающем заводе = 25-40%.
1кип = 200 - 250 - 300 - 350, ?С
Бензин керосин дизельное топливо мазут
Состав мазута:
|
МДж |
![]() Ср = 84%, Нр = 11%, Бр = 0, 3-3%, ^ + О2)р = 0, 5%, = 3%, Ар = 0, 1%.
Ср = 84%, Нр = 11%, Бр = 0, 3-3%, ^ + О2)р = 0, 5%, = 3%, Ар = 0, 1%.
Орн. = 40
Кг
Марки мазута:
1. Флотские Ф5, Ф12;
2. Топочные М40, М100;
3. Мартеновских печей МП.
Если Бр < 0.5%, то мазут малосернистый; Если Бр = 0, 5-2%, то сернистый;
Если Бр > 2%, то высокосернистый.
Температурные характеристики:
1 ■ Вязкость. Она влияет на продолжительность слива, на эффективность перекачивания насосами и на качество распыления форсунками.
Условная вязкость:
X ‘ маз
ВУ = —0-------- , ?УВ. С ростом температуры вязкость снижается.
X н2о
2^ Температура застывания - температура, при которой мазут теряет свою текучесть.
Испытания на текучесть происходят так:
В пробирку наливают мазут; охлаждают до определенной температуры; затем пробирку наклоняют (45?), если в течение минуты уровень жидкости в пробирке не стал параллелен горизонту, то мазут застыл.
1заст. = 10-40?С
3^ Температура вспышки - температура мазута, при которой его пары образуют горючую смесь, вспыхивающую при поднесении пламени.
1всп = 90-140?С
4^ Температура воспламенения - температура мазута, при которой пары воспламеняются и горят более 5 секунд.
1восп = 1всп + 15?С
Г
5^ Плотность рмаз = 0, 96 - 1, 05 —-
См
При эксплуатации влажность возрастает до 6 -15%, возникает эффект обводнения. В результате обводнения:
А) снижается Орн (так как снижается концентрация горючих элементов), а значит растет расход топлива В;
Б) снижается температура пламени в топке, поэтому снижается паропоизводительность котла;
В)растет объем водяных паров УН2О, а значит растет температура уходящих газов, поэтому снижается КПД котла.
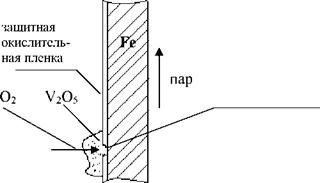
6^ Зольность мазута очень мала Ар < 0, 1%, но она на 50% состоит из пятиокиси ванадия У2О5(1пл = 700?С). Она разрушает защитную окислительную пленку на поверхностях нагрева, открывая доступ кислорода к металлу, и начинается процесс ванадиевой коррозии.
|
|
|
Начинается процесс ванадиевой коррозии Бе + О2 = Бе2Оэ |
Топочные процессы.
С, Н, Б - горючие элементы.
Г орение - химический процесс окисления горючих элементов кислородом, протекающий при высокой температуре, с высокой скоростью о сопровождающийся значительным выделением теплоты.
С + О2 = > СО2 + ОсТ 2Н2 + О2 = > 2Н2О + ОшТ Б + О2 = > БО2 + Об2Т
Горение
Полное неполное
(образуются продукты (дополнительно образуются
СО2, Н2О, 802) СО, Н2, СН4)
Причины неполноты горения:
1. Локальный недостаток окислителя:
С + 0, 502 = > СО
2. Температура газов < 1000?С, либо > 2000?С;
3. Недостаточный контакт горючих элементов и окислителя.
Расчет процессов горения твердого (жидкого) топлива. Топливо: С + Н + 8 + 0 + N + + А = 100%
Топочные газы: (СО2 + Н2О + 8О2) + (СО + Н2 + СН4) + N2 + 02Из6 = 100%
Воздух: 02 + N = 100%
Элементарные реакции горения:
1. Горение С
Ср
С + О2 = > СО2 Мо2С = 2, 67-----
100
12 32 44
1кг 2, 67кг 3, 67кг
2. Горение Н
Н Нр
2Н2 + О2 = > 2Н2О Мо2Н = 8-------
100
TOC o "1-5" h z 4 32 36
1кг 8Кг 9кг
3. Горение 8
8 8Р
8 + О2 = > 8О2 М028 =
100
32 32 64
1Кг 1Кг 2Кг
Теоретический расход 02:
Ср „ Нр 8Р 0р кгО
2
М02 = М02 + М02 + М02 - М02 = 2, 67--------- + 8 + ,
100 100 100 100 кгтопл
Теоретический объем воздуха - это то количество воздуха, которое необходимо израсходовать
Для полного сжигания 1 кг топлива, при условии, что весь кислород прореагировал с горючими.
П М0 100 м3
V 0 =_^ = 0.085СР + 0.265НР + 0.033(8 - 0)р,
8 02 21 кг
С увеличением балласта V? снижается
М3
V? = 3 - 6 - 10, —
Кг
Б. У. Антр. Мазут
Коэффициент избытка воздуха.
В топке не удаётся обеспечить идеального перемешивания горючего с окислителем. При подаче V? (т. е. объёма воздуха фактически необходимого для сжигания данной массы топлива) происходит недожог. Для полноты сгорания воздух подают с избытком ^.
V V ° + V
А = коэф. избытка воздуха = В > 1
Итопочной камеры зависит °Т:
1)
|
Слоевое |
![]() Способа сжигания (факельное сжигание твёрдого топлива о/' = 1,2? 1,25,
Способа сжигания (факельное сжигание твёрдого топлива о/' = 1,2? 1,25,
Сжигание о/' = 1,4? 1,7).
2) Вида и марки топлива (природный газ и мазут о/' = 1,05? 1,1).
3) Конструкции горелочного устройства.
|
|
|
Присосы холодного воздуха в газовый тракт |
|
Атм |
1- уравновешенная тяга (работает и вентилятор и дымосос).
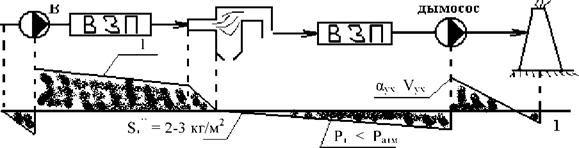
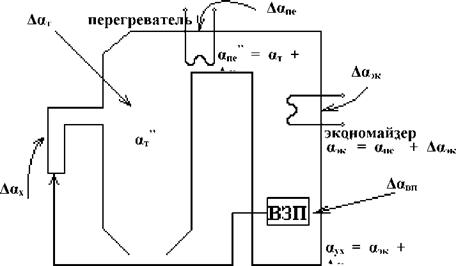
Обмуровка котла имеет неплотности, т. к. засчёт работы дымососа газоходы находятся под разрежением, поэтому холодный воздух присасывается к газам, увеличивая при этом коэф. избытка воздуха и объём уходящих газов.
Аух = От + Ла ух = V + ЛVв
|
|
|
Агв = а - - Лаг - Лап |
Присосы влияют отрицательно:
1) ЛОтТ ^ иср. фак! ^ Ят! ^ Щ ^ Б|,
2) ЛОтТ ^ иг! ^ ЛЦ = иг - ^.с. ^ Оотд! ^^ухТ ^ КПД!,
3) ЛаТ > иухТ > идымТ.
Меры борьбы с присосом
1) Уплотнение обмуровки.
2) Б и Д настраивают так, чтобы 8Т = шт (2? 3) кг/м2
3) Работа котла под наддувом (без дымососа, работает только мощный вентилятор).
Расчёт объёмов продуктов сгорания твёрдого/жидкого топлива
При полном сгорании:
А = 1: CO2 + SO2 + N2 + H2O = 100%
V.__ ,,____ )
Y
RO2 - трёхатомные газы (абстрактная характеристика).
А > 1: CO2 + SO2 + N2 + H2O + O2 = 100%
V.________ )
Y
RO2
Теоретические объёмы (а = 1):
Объём 3-х атомных газов:
MCO MSO
V Ro = Vco + Vso =-^ + —^ = 0,0187(CP + 0,375 • SP) м3/кг ;
Pco2 Pso2
Объём водяных паров:
Vh20 = Vhho + VHW2O + УВ°Од = 0,111 • HP + 0,0124 • WP + 0.016 • vO a Б в
TH = MH2O Б) VW = MH2O = 1 W? _) vВозд = MH2<3 = pВозд • V°
H2O, Б) VH2O • 1AA , В) VH2O ^Возд'
P h2o p h2o p h2o 100 p h2o p H2O
Объём азота:
V° = vN°ra + vN^ = 0,008 • np + 0,79 • vO.
Суммарный объём:
|
VRO = VR2O + VH020 + VN°. |
![]() VO
VO
N2 •
Действительные объёмы (а > 1):
УN2 = У° + АУ^2Б = V" + 0,79(а -1) • УО,
Ун2о = Ун°2о + 0^016(а-1) • УО,
Уо2 = 0,21 • (а-1) • У° ■
Суммарный объём: УГ = УК2° + Ун2° + УN2 + У°2 ■
Расчёт процессов горения газового топлива
Особенности:
1. Расчёты ведут на 1 м,
2. Состав в объёмных процентах:
1 топливо: (С°2 + Н2 + + СН4 + СтНп) + (N2 + СО2 + О2) = 100%
2^ воздух: О2 (21%) + N2 (79%) = 100%^
3^ продукты сгорания: (СО2 + Н2О + БО2) + (СО + Н2 + СН4) + N + О2 = 100%
Элементарные реакции горения:
СО СО
1. TOC o "1-5" h z 2СО2 + О2 = 2СО2 = > требуется У™ = 0,5 ,------------------------------------------------------------------------- получается УСО = ;
10, 5 1 м3 2 100 2 100
Н Н
2. 2Н2 + О2 = 2Н2О = > требуется УО = 0,5—-, получается УН1" =—-;
1 0 5 1 м3 Р °2 100 Н2° 100
Н 8 Н 8
3. 2Н28 + 302 = 2802 + 2Н20 = > требуется У1^8 = 1,5——, получается V8I028 =——
, 02 100 802 100
1 1, 5 1 1 м3
V H2S = Н28 .
Н20 100 .
СН СН
4. СН4 + 202 = С02 + 2Н20 = > требуется V(CH4 = 2---------------------------------------------------------------------------------- -, получается V(C0І4 =------ 4,
1 2 1 2 м3 2 100 2 100
^ГСН4 = 2 СН4 .
Н20 100 .
П С Н С Н
5. СшНп требуется = 2 (ш + — )-^—-, получается Х^Н11 = 2 ш ™ ”
4 100 2 ^ 100
^Стнп _ П СтНп
УН20
2 100
Теоретический расход кислорода:
V0l = ХС2° + VoH22 + VoH228 + ХС2тНп - ^пл м3/м3;
V0 = = °-°476(0,5С02 + 0,5Н, + 1,5Нг8 +1°° + £(т + - 0Гл) м3/м3.
Расчёт объёмов продуктов сгорания:
При полном сгорании топлива состав газов следующий:
При о = 1 С02 + 802 + N2 + Н20 = 100%
Объём 3-атомных газов:
Л, т _С0 Н2^ ^пСтНп С0 2опл
^^П0 = VC0 + V80 =-------- 1------ + /-------------- 1-------- ;
2 С02 802 100 1°° 2 100 100
Объём воды:
П С Н
<0 = + <20 + V^^ + V” + V” = °,°1(Нг + Н,8+2 +0,124а „.)+°,°l6L• V0.
Объём азота:
Лт топл
VN = 0,79 • V0 + —^;
^ 100
Суммарный объём:
О.
V0 = VR20 + ^0 + VN2;
При а > 1 С02 + 802 + N2 + Н20 + 02 = 100% Объём 3-атомных газов:
^02 = с°^;
Объём воды:
Vн20 = <0 + °,°16(а-1) • V0;
Объём азота:
VN2 = VN02 + ЛV—^ = VN02 + °,79(а -1) • V0;
Объём кислорода:
0
Vo2 = 0,21 • (а-1) • V Суммарный объём:
Основное уравнение газового анализа. Материальный баланс Кислорода (автор Бунте)
Я0Г (1+ Р) + СО г (0,6 + р) + 02 = 21%
К----- У--- * ^----- V-------- ^
А б в
|
АУ У7 |
|
1 - |
|
• N 2, то при полном сгорании топлива |
|
79 |
|
100 21 |
|
• 0 Г 2. |
|
Если Ау = |
|
При полном сгорании топлива и а > 1 состав газов - Я02 + N + Я0Т |
|
02 = 100%, здесь Я02 < Я02 |
|
А = |
|
Я0, |
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
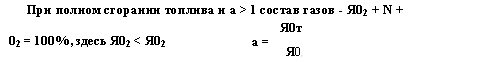 |
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
|
|||||||||||||
1
А =
79 • 0 г 2
1 -
21-Nг 2
Если недожег представлен виде СО, то с учетом СО + 0, 5О2 = СО2, выражение принимает вид
1
А =
79 • (0Г2 - СОг)
1-
21-Nг 2
Если СОтопл = 0 и N = 0, то 21
А:
21 - Ог 2
|
|
|
|
||