СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Изучение процессов высаливания
Как показано в § 3, присутствующие в системе ионы по - разному влияют на структуру воды. В результате упоря - дочивающе-разупорядочивающего действия ионов на структуру воды при введении неэлектролита должны наблюдаться процессы высаливания (обезвоживания) или всаливания (оводнения). Вопросу высаливания неэлектролитов посвящено большое число работ, основйые по ложения которых приводятся в обзорах [271—277].
В качестве основного параметра, характеризующего процесс высаливания, обычно используется сеченовский коэффициент высаливания Ks* [278], связанный с растворимостью неэлектролита в воде (Sг°) и в растворе соли (Si) уравнением
/<;Cs = ig(s»/s(.),
Где Cs — концентрация электролита в водном растворе (S»°, S,- и Cs берутся в молярной шкале, поскольку линейная зависимость lg (Sf/Si) от концентрации имеет место в большом интервале Cs).
Используемый в ряде случаев коэффициент высаливания Мак-Девита и Лонга [6]
Й1П fi V°i(Vs-K)
Ks = lim
Cs-»o Dcs 2,3|30W
Обычно имеет заниженные по сравнению с экспериментом значения, в результате чего Лонг и Мак-Девит [277] вводят фактор самовысаливания
|
|
С другой стороны, используя представления о гидратации ионов, развиваемые О. Я. Самойловым, как действие этих ионов на трансляционное движение молекул воды, Гури - ковым [103] было теоретически показано, что существенный вклад в процесс высаливания оказывает изменение структуры воды под действием ионов электролитов; была вычислена для некоторых систем структурная поправка AKS (для бензола она составляет около 0,175, что сравнимо с величинами Ks° Лонга и Мак-Девита). Таким образом, полное значение коэффициента высаливания имеет вид Ks*=Ks°+AKs--Ki, т. е. в уравнение Сеченова включены все основные моменты, характеризующие процесс высаливания.
Расчет значений Ks* производился из экспериментальных данных по растворимости МЭК (а в некоторых случаях циклогексанона) при приведении кетона в равновесие с растворами соответствующих солей (концентрации солей составляли 0,1; 0,5; 1,0; 2,0 моль/л). Определение кетона в аликвотной части равновесной водной фазы производилось гидроксиламиновым методом, описанным в [279][7]. Полученные результаты [152, 280] с привлечением некоторых литературных данных [103, 281, 282] позволяют сделать вывод, что по своему высаливающему действию ионы могут быть расположены в ряды:
Na+ > К+ > Rb+ > Cs+; Cd2+ > Mg2+ > Ca2+ > Sr2+ > Ba2+;
SOS" > F" > OH" > CI" > Br" > NO" > J" > CIO7,
Т. е. наблюдается общая тенденция к понижению значения Ks* при увеличении разупорядочивающего действия ионов высаливающих агентов на структуру воды. Аномальное положение лития при высаливании анилина, этилацетата, диацетонового спирта и бензола (Na+^: rs=Li+>K+) объясняется локальным гидролизом и связанной с этим переориентацией воды, что приводит к менее выгодному для процесса высаливания ее состоянию [282]. Кроме того, обращает внимание сильное всали - вающее действие J - и С104~.
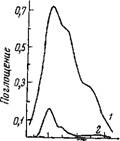
С другой стороны, представлялось целесообразным проследить за состоянием воды в органическом растворителе, приведенном в равновесие с водными растворами соответствующих солей, и оценить значения Кв* — коэффициента высаливания воды из фазы растворителя. Даже предварительные данные по сопоставлению ИК-спектров насыщенного водой кетона и этого раствора, приведенного в равновесие с 16 М раствором KF, показали (рис. 52), что до 90% воды высаливается из фазы растворителя в водную фазу.
Изучение спектров воды в метилэтилкетоне, приведенном в равновесие с рядом растворов солей (Li2S04, Rb2S04, CH3COONa, MgS04, ZnS04, NiS04, KF, NH4F,
NaCl, СаС12, ВаС12), показало, что и анионы й катионы
|
7100 6700 кем-' |
Высаливающих агентов оказывают значительное влияние на содержание воды в растворителе, причем чем сильнее гидратируется соответствующий ион, тем меньше воды содержится в равновесной органической фазе. Аналогичные результаты (только с несколько меньшим изменением) наблюдались и в случае равновесий водный раствор
Рнс. 52. ИК-спектры поглощения воды в МЭК
1 — насыщенный раствор воды в кетоне, 2— то же, приведенное в рав новесие с 16 М раствором KF
Электролита — ТБФ. Из спектров по методу [280] определялось содержание воды в фазе метилэтилкетона и рассчитывались приближенные значения коэффициента высаливания воды Кв*, которые показали, что и в данном случае наблюдаются ряды значений Кв* для катионов и анионов:
Li+ > NH+ > Rb+ > Cs+; Zn2+ > Ni2+ > Mg2+; Al3+ > Cr3+;
> WO2- > CO2-; CH3COO - > F - > CI" > Br - > N03~.
Хотя полученные данные для ионов Со2+, Sr2+, Ва2+ и положение С032~ выпадают из закономерностей, обнаруженных для изменения структуры воды и для значений Ks* (причины таких отклонений пока не совсем ясны), в общем наблюдается закономерность: чем сильнее гидратируется данный ион, тем сильнее высаливается кетон из водной фазы и вода из фазы растворителя. К аналогичному выводу приводит и рассмотрение некоторых тройных систем [282а]. Так, при повышении концентрации NaOH, КОН, KF и СаС12 в системах соль—вода - ацетон (изобутиловый спирт, МЭК) по мере повышения концентрации высаливающего агента наблюдается уменьшение содержания воды и соответствующего электролита в фазе органического растворителя, т. е. происходит обезвоживание как неэлектролита, так и растворяющихся в
растворителе гидратированных ионных ассоциатов, что и приводит к снижению их растворимости.
Весьма интересными оказались качественные данные по равновесию водный раствор перхлората натрия — хи - нолин. Так, при приведении в равновесие хинолина с 10 М водным раствором ЫаС1С>4 объем органической фазы возрастает на 60—65%, а водной фазы соответственно уменьшается. Этот факт может быть объяснен переходом в фазу растворителя довольно больших количеств воды. Сопоставление этих данных с всаливанием кетонов (даже ацетофенона и метилизобутилкетона) в водную фазу хорошо подтверждает роль структурных изменений воды под действием ионов электролитов и большое значение энергии водородной связи вода — растворитель. Действительно, поскольку энергия водородной связи (Ев.) типа кетон — вода меньше энергии водородной связи вода — вода, то даже при значительном разрушении структуры воды хотя и происходит частичный переход ее в фазу растворителя, все же преобладает процесс высаливания неэлектролита. В случае же хинолина, когда Ел для связи хинолин — вода больше £н связи вода — вода, имеет место обратная картина.
На основе анализа полученных результатов и сопоставления с литературными данными может быть высказано также следующее предположение о роли процессов гидратации, всаливания и высаливания при извлечении некоторых ионных ассоциатов [152, 280].
Анионы, разупорядочивая структуру воды, оводняют и катион, и неэлектролит, создавая этим условия для образования гидратно-сольватных оболочек катиона (устойчивость таких комплексов катион—вода—растворитель будет тем прочнее, чем сильнее поляризована вода, т. е. чем больше заряд и меньше радиус катиона). Склонность упомянутых выше ионов к образованию дальних, «небьерру - мовских» (по терминологии Даймонда [283]) ионных ассоциатов приводит к повышению вероятности образования их с заранее «подготовленной» смешанной гидратно-соль- ватной оболочкой. Среди большого числа разнообразных по своему составу и строению сольватов имеются такие, значения параметров растворимости которых довольно близки к значениям этого параметра равновесной фазы растворителя, в результате чего произойдет их распределение между обеими фазами.