СОСТОЯНИЕ ВОДЫ В ОРГАНИЧЕСКИХ И НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Н-связь воды, теория водородной связи
Способность образовывать водородные связи является, пожалуй, наиболее интересным свойством воды. Эти связи определяют полностью или частично все физические и химические свойства воды, ее структуру, характер и величину взаимодействия. Это утверждение справедливо, однако, не только для воды.
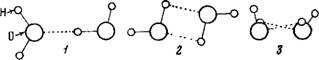
Каждая молекула воды способна образовать четыре водородные связи за счет неподеленных пар электронов атома кислорода [84]. Наличие такой связи создает упорядоченность в расположении молекул в жидкой воде И обусловливает" образование ассоциатов. Простейшие ассоциации воды — димеры. Существуют различные формы димеров: в виде плоского и неплоского кольца, сдвоенного кольца, открытой цепи [72] (рис. 5). Возможно образование ассоциатов и более сложных.
Работы по изучению водородной связи ведутся на протяжении нескольких десятков лет, причем развитию теории водородной связи в значительной степени способствовало изученИе колебательных спектров соединений с Н-связью. Однако природа ее до настоящего времени окончательно не выяснена.
|
Рис. 5. Возможное строение ди меров воды |
|
|
1 — открытый, или цепной димер. циклические димеры 2 — плоское кольцо; 3 — иеплоское кольцо, 4 — «сдвоенное» кольцо
Ранее считалось, что водородная связь обусловлена электростатическим притяжением диполей или остаточных зарядов взаимодействующих групп [84]. Это положение лежит в основе электростатической теории. Согласно последней, атом водорода, обладая только одной устойчивой орбитой, не способен образовать более одной ковалентной связи. В связи с этим предполагалось, что возникновение водородной связи обусловлено ионными силами.
Леннард-Джонс и Попл [85, 86] предложили модель водородной связи молекулы воды с таким расположением зарядов, которое предполагало правильную величину ди - польного момента. Расчет энергии электростатического взаимодействия, проведенный на основе такой модели, дал величину 6 ккал. Это было вполне приемлемое значение для энергии водородной связи, поэтому электростатическая модель была принята и в дальнейшем с успехом использовалась многими исследователями [87—92].
Вместе с тем рассмотренная теория не может описать всех явлений, связанных с образованием водородной связи. Так, увеличение интенсивности полосы ИК-погло - шения в области основных частот при образовании Н-связи во много раз превосходит то, которое может быть объяснено электростатической теорией [93—95].
Кроме того, отсутствует соответствие между энергией связи и дипольным моментом (87, 96, 97].
Так же несостоятельна электростатическая модель в объяснении основного спектроскопического проявления водородной связи — смещения частоты валентных колебАний группы ОН в сторону низких частот [98. 99]
$ последние два десятилетия получила развитие дру - гая модель водородной связи, доНорно-акцепторная, пред; ЛожещшЯ Соколовым (100, 101]} ина основывается на йВантовомеханических расчетах и дает возможность понять многие явления, необъяснимые с точки зрения электростатической теории.
По теории Соколова, при образовании водородной связи в системе А — Н...В происходит перераспределение электронной плотности электроотрицательного атома В. Для того чтобы пара электронов от В переместилась к акцептору электронов — атому Н, необходимо, чтобы последний обладал остаточным положительным зарядом [100, 102]. Необходимо было допущение того, что в процессе образования водородной связи происходит также смещение электронного облака от Н к атому А. Таким образом, атом Н как бы освобождает свою 5-орбиту для приема пары электронов атома В.
В этом случае образование Н-связи не определяется дипольным моментом молекулы (или полярностью связи* ОН), а только донорно-акцепторными свойствами вещества. Возможность образования молекулой воды водородной связи объясняется ее способностью поляризоваться под влиянием молекулы, с которой эта связь образуется. Перераспределение электронной плотности в молекуле воды эквивалентно появлению диполя, положительный конец которого располагается на протоне, а отрицательный — в центре деформированного электронного облака, создаваемого неподеленной парой электронов атома кислорода. Это как бы эффективный диполь^ ный момент молекулы воды, который зависит от распределения электронной плотности в водородном мостике [103]. Если облако неподеленной пары электронов имеет ось симметрии, то энергетически выгодной должна быть такая конфигурация ассоциата, при которой линия связи ВА — Н примерно совпадает с направлением этой осн, ' поскольку в этом случае перекрывание орбит атомов В и Н будет наибольшим. Теория донорно-акцепторного
Взаимодействия получила широкое распространение, так как с ее помощью стало возможным понять и объяснить некоторые закономерности в ИК-спектрах, физико-химические свойства систем с водородной связью. В то же время, основываясь на электростатических представлениях, осуществить это было невозможно.