Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СУЛЬФАТ АММОНИЯ
Сульфат аммония (NH4)2S04 — бесцветные кристаллы ромбической формы с плотностью 1,769 г/см3. Технический сульфат аммония имеет серовато-желтоватый оттенок. При нагревании сульфат аммония разлагается с потерей аммиака, превращаясь в кислые соли. Давление NH3 над сульфатом аммония равно при 205°
|
1 1 |
--- j |
||||||||||
|
--ia. os- |
|||||||||||
|
К |
|||||||||||
|
- - | |
|
108,9° |
|
О -20 -10 0 10 20 30 40 50 60 70 80 90 100 110 Температура ,°С |
|
Рис. 361. Растворимость (NH4)2S04 В воде. |
0,5 мм рт. ст., при 300° 50,8 мм рт. ст. К При 513° он полностью разлагается на NH3 и H2S04. При растворении 1 г-экв соли в 1 л воды поглощается при 19,6° около 1 ккал тепла. При кристаллизации сУльфата аммония из раствора выделяется 2,6 кал/г-мол. Растворимость (NH4)2S04 в воде показана на рис. 3612>3. В присутствии аммиака растворимость сульфата аммония значительно снижается. Температура кипения насыщенного водного раствора (NH4)2SOi пРи 760 ммрт. ст. равна 108,9°.
Промышленное использование сульфата аммония весьма ограничено, — небольшие его количества потребляют в производств аккумуляторов и в медицине. Очень большие количества сульфат аммония применяют в сельском хозяйстве в качестве азотного удобрения. Оно содержит 20,5—21% азота (химически чисты* (NH4)2S04 содержит 21,2% N).
Объем производства сульфата аммония в капиталистических странах составлял в 1960 г. приблизительно 30% от общего объема производства азотных удобрений (в пересчете'на азот). Мировое производство сульфата аммония в 1960 г. равнялось 15 млн. т. Особенно велика доля сульфата аммония в производстве азотных удобрений в Японии, Италии, Великобритании, США и Индии 4~15. В СССР доля сульфата аммония в общем балансе азотных удобрений (N) составляла в 1967 г. — 8,5%.
Сульфат аммония физиологически кислое удобрение. Для устранения его подкисляющего действия требуется вносить в почву в 1,7 раза больше СаС03, чем при пользовании аммиачной селитрой.
|
Сей |
|
Высший |
1-й |
|
Сорт |
Сорт |
|
(в %) |
(В %) |
|
21,0 |
20,8 |
|
0,025 |
0,05 |
|
0,2 |
0,3 |
|
85 |
70 |
|
2-й сорт <в %) 20,8 0,05 0,3 Не нормируется |
|
Азот (иа сухое вещество), не менее. Свободная серная кислота, не более Влага, не более.................................... Фракция более 0,25 мм, не менее. |
|
Сульфат аммония упаковывают в мешки и отгружают в крытых железнодорожных вагонах; допускается (по согласованию с потребителем) отгрузка навалом в крытых железнодорожных вагонах. Сульфат аммония аккумуляторный получают из синтетического аммиака и аккумуляторной серной кислоты. Его выпускают двух сортов и используют в производстве свинцовых аккумуляторов. Согласно ГОСТ 894—41, в обоих сортах должно содержаться (в пересчете на сухое вещество) не менее 99,05% (NH4)2S04 и не |
По своим физическим свойствам сульфат аммония лучше аммиачной селитры, он не огнеопасен, меньше слеживается и обладает значительно меньшей гигроскопичностью. Равновесная относительная влажность воздуха над насыщенным раствором сульфата аммония при 30° равна 79,2% (для аммиачной селитры 59,4%) 1б_18- Сульфат аммония должен иметь крупнокристаллическую структуру и содержать наименьшее количество влаги и смолистых приме
19-32
Сульфат аммония (для удобрения), выпускаемый на коксохимических предприятиях, должен удовлетворять следующим требованиям (ГОСТ 9097—65):
более 0,3% кислоты (в пересчете на H2SO4). В продукте допускаются незначительные примеси хлоридов, железа, мышьяка и марганца. Продукт упаковывают в деревянные бочки.
Сульфат аммония очищенный, изготовленный из синтетического аммиака и серной кислоты, согласно ГОСТ 10873—64, должен содержать не менее 21% азота (в сухом веществе) и не более: 1% влаги, 0,15% свободной серной кислоты, 0,002% хлоридов, 0,015% Fe, 0,00005% As, 0,00005% Мп, 0,015% не растворимого в воде остатка, 0,001 % азотной и азотистой кислот, 0,005% роданидов (SCN), 0,0005% тяжелых металлов сероводородной группы (РЬ) и 0,02% фосфатов (Р04).
Для производства сульфата аммония используют аммиак, получающийся как побочный продукт при сухой перегонке каменного угля в коксохимической и газовой промышленности, а также синтетический аммиак 33~48.
В СССР сульфат аммония-—удобрение производят только из аммиака, содержащегося в коксовом газе. Синтетический аммиак предпочитают перерабатывать в аммиачную селитру, являющуюся более концентрированным азотным удобрением, стоимость единицы азота в котором ниже, чем в сульфате аммония.
Основными промышленными способами производства сульфата аммония являются следующие 49~50:
поглощение серной кислотой аммиака, содержащегося в газе коксовых печей 51_61;
нейтрализация серной кислоты газообразным синтетическим аммиаком 62>63;
обработка гипса растворами карбоната аммония 64-74;
переработка растворов, являющихся отходом производства капролактама75~77.
Кроме этих основных широко применяемых способов, сульфат аммония может быть получен окислением сульфита аммония, образующегося из NH3 и SO2 (стр. 534). Сульфит аммония окисляется под давлением 2—3 ат 82—98%-ным кислородом в сульфат аммония. Получаемый 40% раствор (NH4)2S04 выпаривают и криСталлизуют.
Для производства 1 т сульфата аммония требуется 100—106 ж3 кислорода (100%) и 80—90 квт-ч электроэнергии78"82.
Разработан способ производства сульфата аммония из дымовых газов электростанций (и выхлопных газов сернокислотных заводов). Газообразный аммиак вводят в горячие дымовые газы между экономайзером и подогревателем воздуха. Аммиак связывает содержащиеся в газе окислы серы в сульфит, бисульфит, сульфат, тиосульфат аммония. Эти соли улавливают нз газоврго потока.
'5 .4. Г. Г"! ин вместе с золой в электрофильтрах и после отделения золы перерабатывают в сульфат аммония 83~88.
В СССР в НИУИФ разработан способ, дающий возможность одновременно получать из природного сульфата натрия два ценных продукта — соду и сульфат аммония. Он основан на реакции: Na2S04 + 2С02 + 2NH3 + 2Н20 = 2NaHC03 + (NH4)2S04
Процесс аналогичен аммиачному способу получения соды из поваренной соли, с той лишь разницей, что здесь вместо хлорида аммония образуется сульфат аммония, который, после отделения ют кристаллов бикарбоната, извлекается из раствора путем его выпаривания и охлаждения. Использование сырья здесь значительно выше: натрий используется не на 60—70%, а на 95—97%; кроме того, отсутствуют отходы загрязненных растворов хлорида Кальция, получаемые при регенерации аммиака из хлорида аммония и сливаемые в «белые моря» 89-91.
- Разработаны способы получения сульфата аммония из отходов производства метилметакрилата 92, из кислого гудрона 93>94, из промывных вод от травления металлов94, из сточных вод96 и др.97.
Физико-химические основы получения сульфата аммония нейтрализацигй серной кислоты
Аммиаком
Сульфат аммшия получается по реакции
2NH3(r.) + H2S04 = (NH4)2S04 + 66,9 Ккал
Путем нейтрализации газообразного аммиака серной кислотой. При мокром способе производства продукт кристаллизуется из пересыщенных растворов, при сухом — осуществляется нейтрализация мелких брызг серной кислоты в газообразном аммиаке.
При насыщении аммиаком 75—78%-ной серной кислоты в реакционном аппарате выделяется значительное количество тепла, достаточное для нагрева реакционной смеси до температуры кипения и для испарения из нее значительного количества воды. Башенная серная кислота, часто применяемая в этом производстве, содержит сотые доли процента окислов азота в виде нитрозилсерной кислоты. В непрерывном производственном процессе башенную кислоту смешивают с реакционным раствором; при этом она разбавляется и нагревается за счет тепла гидратации и нейтрализации аммиаком. Вследствие этого происходит денитрация с выделением окислов азота в газовую фазу по реакции:
2SOsNH + Н20 = 2H2S04 + NO + N02
При больших масштабах производства сульфата аммония количество выделяющихся окислов азота велико, несмотря на незначительное содержание их в серной кислоте. Поэтому должны приниматься меры к тому, чтобы эти газы, вредно действующие на человеческий организм, не проникали в атмосферу цеха.
Наиболее целесообразно производить денитрацию серной кислоты до нейтрализации ее аммиаком, так как в противном случае некоторое количество аммиака теряется вследствие следующей реакции:
NO + N02 + 2NH3 = 2N2 + 3H20
Обычно и осуществляют Цредварительную денитрацию башенной кислоты, разбавляя ее водой или маточным раствором сульфата аммония, причем концентрация кислоты, направляемой на нейтрализацию, снижается на 8—10%.
HjS04
|
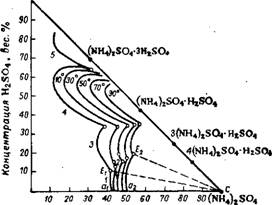
Концентрация (NH4)j SO.,, вес. % Рис. 362. Изотермы растворимости в системе (NH4)2S04—H2S04— Н20 при 10, 30, 50, 70 и 90°- |
Из примесей, находящихся в башенной серной кислоте (около 0,2%), наиболее вредное влияние в процессе получения сульфата аммония оказывают сульфаты железа и алюминия 98. При нейтрализации кислоты из этих солей образуются коллоидные гидроокиси железа и алюминия
(Fe, Al)2 (S04)3 + 6NH3 + 6Н20 = 2 (Fe, Al) (ОН)3+ 3 (NH4)2 S04
Обволакивающие кристаллы сульфата аммония и тормозящие их Рост. Устранение этого явления достигается путем неполной нейтрализации кислоты — в непрерывно действующих реакторах поддерживают кислую реакцию среды.
На рис. 362 изображены изотермы растворимости в системе (NH4)2S04— H2SO4— Н20 99-10°. В этой системе в твердой фазе могут существовать различные кислые соли. Отдельные участки кривых соответствуют насыщению раствора: 1—(NH4)2S04; 2 — 4(NH4)2S04-H2S04; 3 — 3(NH4)2S04-H2S04; 4 — (NH4)2S04-H2S04; •5—(NH4)2S04-3H2S04. Поле кристаллизации (NH4)2S04 лежит в области систем, содержащих небольшие количества серной кислоты — A^Ic при 10° и а2Е2с при 90°. Во избежание выпадения кислых солей содержание H2S04 в жидкой фазе системы должно быть меньше, чем в точках Е, т. е. меньше 11,08% при 10° или 19,77% при 90°. Хотя в процессе нейтрализации реакционная масса имеет высокую температуру, но при последующем отделении кристаллов она охлаждается, поэтому при выборе состава реакционного раствора необходимо исходить из положения поля кристаллизации сульфата аммония при невысоких температурах. Практически кислотность раствора поддерживают на уровне 6—7% свободной H2S04, что исключает возможность кристаллизации кислых солей.
Кристаллы сульфата аммония, выделяющиеся из такого кислого раствора, сравнительно мелки, что несколько затрудняет их отфиль - тровывание и отмывку от маточного раствора. Для получения более крупных кристаллов содержание свободной кислоты в растворе должно было бы быть в пределах 9—15 г H2S04 в 1 л. При еще меньшей кислотности раствора опять получаются мелкие кристаллы21'101. Как при высокой, так и при очень незначительной кислотности раствора сульфат аммония образует пересыщенные растворы, что ведет к появлению мелких кристаллов. Указанная же кислотность соответствует условиям, при которых кристаллизация идет медленнее, а кристаллы получаются крупнее 102. Однако работа с такой кислотностью допустима лишь при незначительном содержании в растворе веществ, образующих коллоидные осадки 103.
Вредное влияние коллоидных осадков при кристаллизации из слабокислых растворов может быть устранено путем осаждения соединений железа и алюминия добавкой небольших количеств суперфосфата, фосфорной кислоты и других реагентов 26>28' 29> 104>1®5.
Величина кристаллоз увеличивается также с возрастанием продолжительности их роста. В непрерывно действующих аппаратах интенсивное перемешивание кристаллической суспензии инертным тазами — воздухом или водяным паром — препятствует осаждени" кристаллов плотным слоем на дно аппарата, где их рост прекра щается. Замедление процесса кристаллизации достигается такж при двухступенчатой нейтрализации—в первой ступени получается кислый насыщенный раствор сульфата аммония, который после охлаждения донасыщается аммиаком во второй ступени. Равномернее распределение аммиака по всему объему нейтрализуемой массы обеспечивает равномерное распределение тепла и зарождающихся центров кристаллизации 10®> 107.
При отжиме образовавшихся кристаллов сульфата аммония на центрифугах в нем остается часть маточного раствора (до 1,5% влаги). При охлаждении соли продолжается ее кристаллизация из Оставшегося маточного раствора, что приводит к срастанию поверхностей отдельных кристаллов, и вся масса цементируется в сплошную глыбу. Во избежание этого после отжима от маточного раствора соль следует промывать на центрифуге водой. При промывке вода растворяет мелкие кристаллы, и масса становится более рыхлой. Иногда для уменьшения кислотности продукта его промывают аммиачной водой. Когда центрифугированию подвергается соль, имеющая щелочную реакцию, т. е. содержащая свободный аммиак, промывку лучше производить горячей водой, так как выделившиеся в этом случае гидроокиси железа и алюминия, забивающие поры между кристаллами, коагулируют в более крупный осадок и Промывка облегчается.
С целью улучшения физических свойств готового продукта и уменьшения слеживаемости его подвергают сушке 108' 109. Сушку сульфата аммония проводят различными способами — на вибротранспортере и в барабанных сушилках. В последнее время в связи с повышенными требованиями к влажности продукта (влажность должна быть ^1%) сушку стали осуществлять в псевдоожи - женном слое110-116. Кроме того, испытана высокоэффективная сушка в вихревой камере, дающая продукт с влажностью 0,1— 0,6% "7, и в вертикальной трубе, в которой удается высушить продукт до содержания влаги 0,02—0,08% 118. Сушится сульфат аммония воздухом, предварительно нагретым паром до 110—130°.
Производство сульфата аммония из аммиака. коксового газа
Содержащийся в коксовом газе аммиак (7—10 г/ж3) можно перерабатывать в сульфат аммония тремя способами: косвенным, прямым и полупрямым 119-134.
Косвенный способ состоит в следующем: коксовый газ подвергают охлаждению в газовых холодильниках для выделения из него смолы и водяных паров. Оставшийся в газе аммиак поглощают водой в аммиачных скрубберах. Затем из аммиачной и надсмольной воды, образовавшейся вследствие расслоения смолы и сконденсировавшихся водяных паров, в дистилляционных колоннах отгоняют аммиак, который связывают серной кислотой с образованием сульфата аммония. Этот метод требует больших капиталовложений на сооружение аммиачных скрубберов, а также большого расхода электроэнергии воды и пара. Кроме того, он связан с большими потерями аммиака. Вследствие своей нерентабельности этот способ в СССР не применяется.
В прямом способе поглощение аммиака серной кислотой с образованием сульфата аммония производится непосредственно из горячего коксового газа, температура которого превышает температуру конденсации содержащихся в газе водяных паров.
Обычно температуру поддерживают на уровне 110°. Этот способ также не применяется в нашей промышленности из-за сложной технологии, а также потому, что не позволяет улавливать ценные пиридиновые основания.
Полупрямой способ как наиболее экономичный получил самое широкое применение в коксохимической промышленности. Сущность этого способа состоит в том, что вначале из коксового газа выделяют смолу и водяные пары путем его охлаждения. Образовавшаяся жидкая фаза расслаивается на два слоя: нижний — смолу и верхний — надсмольную воду, в которой частично растворен аммиак.
Надсмольную воду подвергают обработке для выделения из нее аммиака, который затем направляют на поглощение серной кислотой вместе с очищенным от смолы коксовым газом, содержащим оставшееся количество аммиака 16> 135-'3?.
Для выделения из надсмольной воды аммиака ее подвергают дистилляции. При нагревании до 100° острым паром из нее выделяется растворенный аммиак и происходит разложение части аммонийных солей, образовавшихся при взаимодействии аммиака коксового газа с содержащимися в нем примесями — двуокисью углерода, сероводородом, серным и сернистым ангидридом, хлористым водородом, цианистыми соединениями и др. Такие аммонийные соли, как (NH4)2C03, NH4HC03, (NH4)2S, легко разлагаются при нагревании с выделением аммиака. Для разложения остальных аммонийных солей надсмольную воду обрабатывают в дистилля - ционной колонне известковым молоком, например:
(NH4)2 S04 + Са (ОН)2 = 2NH3 + 2Н20 + CaS04 2NH4NCS + Са (ОН)2 = 2NH3 + 2Н20 + Са (NCS)2
Поглощение аммиака из коксового газа можно производить в сатураторах (сатураторный метод) или в скрубберах (бессатураторный метод) 138. До последнего времени переработку аммиака коксового газа в сульфат аммония производили в сатураторах, в которых совмещены процессы поглощения аммиака серной кислотой и кристаллизации сульфата аммония. Совмещение этих двух процессов в одном аппарате не позволяет поддерживать технологический режим, который бы являлся оптимальным одновременно для обоих процессов, т. е. обеспечивал бы более полное поглощение аммиака из коксового газа и способствовал бы образованию крупнокристаллического сульфата аммония. Было установлено, что наиболее рационально процессы поглощения и кристаллизации проводить раздельно — поглощение аммиака вести в скрубберах, а кристаллизацию сульфата аммония на кристаллизационных установках (бессатураторный метод). По этому методу теперь работают многие заводы и получают крупнокристаллический продукт с хорошими физическими свойствами.
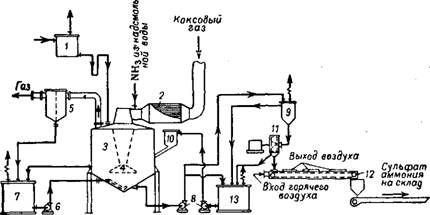
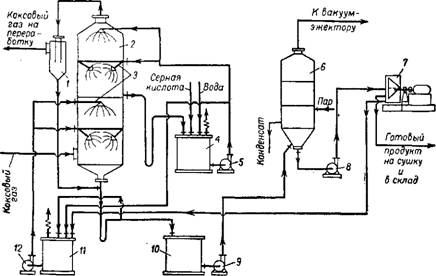
На рис. 363 представлена схема производства сульфата аммония из аммиака коксового газа сатураторным методом 16.
Коксовый газ, охлажденный в холодильниках до 25—30° и очищенный от смолы, подогревают паром в решофере 2 до 60—80° и направляют в сатуратор 3. Перед сатуратором к коксовому газу примешивают паро-аммиачную смесь, полученную при переработке цадсмольной воды.
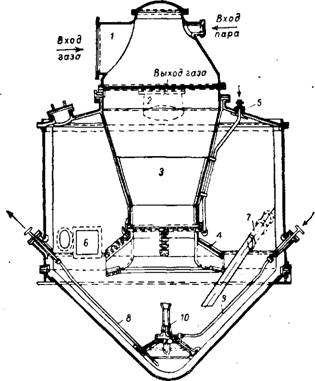
Сатуратор (рис. 364) представляет собой цилиндрический аппарат с коническим днищем, выполненный из углеродистой стали и
|
Рис. 363. Схема производства сульфата аммония из аммиака коксового газа Сатураторным методом: 1- напорный бак для серной кислоты; 2 - подогреватель газа (решофер); 3 — сатуратор; 4-Барботажиая труба; 5 —кислотная ловушка; 6—8 — насосы; 7 —циркуляционный бак; 0 —кристаллоприемиик; 10 — приемный сосуд; //- центрифуга; 12 — внбрацнонно-сушильйы!} транспортер; 13 — резервный сборник. |
Футерованный внутри кислотоупорными плитками. Он снабжен выносной кислотной ловушкой. Применяются также сатураторы с внутренней ловушкой, а также с несколькими барботажными трубами и с принудительной циркуляцией, создаваемой мешалкой пропеллерного типа, вмонтированной в конус сатуратора 136>139"149.
Сатуратор заполнен насыщенным (маточным) раствором сульфата аммония, в который непрерывно дозируется 78%-ная сернай кислота.
Коксовый газ подается через барботажное устройство 4. Распределение газа происходит по тангенциальному направлению, ко-* торое приводит раствор во вращательное движение, способствуя лучшему контакту и перемешиванию газа с раствором. Образующийся сульфат аммония выделяется в виде кристаллов, осаждающихся на дно сатуратора 123>125'130' iso—155 g НИЗУ сатуратора находится перемешивающее сопло (ажитатор). Циркуляция PacTBopat Подаваемого насосом в сопло ажитатора, также улучшает перемешивание.
Выходящий из сатуратора газ, содержащий водяной пар, освобождается от брызг и направляется на дальнейшее использование.
|
Рис. 364. Сатуратор с одной центральной барботажной Трубой и выносной кислотной ловушкой: / — штуцер для входа газа; 2 — штуцер для выхода газа; 3 — центральная барботажная труба; 4 — барботажный зонт; 5 — труба для подвода кислоты; б—штуцер для перетока маточного раствора в циркуляционную кастрюлю; 7 —труба для возврата раствора из кастрюли обратных токов; 8 — труба для выдачи кристаллов сульфата; 9 — труба для подачи раствора в перемешн - вающее сопло; 10 — перемешивающее сопло. |
Концентрация аммиака в газе, выходящем из сатуратора, должна быть не более 0,02—0,03 г/л3.
Равномерная концентрация кислоты в растворе поддерживается непрерывной циркуляцией маточного раствора при помощи центробежного насоса 6. Пульпа, состоящая из кристаллов сульфата аммония и маточного раствора, непрерывно удаляется со'дна сатуратора и центробежным насосом 8 передается в кристаллоприемник 9.
Маточный раствор из кристаллоприемника возвращается в сатуратор через приемный сосуд 10, а кристаллы поступают в центрифугу непрерывного действия 11 для полного отделения от маточного раствора. Сульфат аммония, содержащий после центрифугирования около 2% влаги, при хранении слеживается, слипаясь в комки и глыбы. При содержании влаги менее 0,2% сульфат аммония практически не слеживается. Поэтому после центрифуги сульфат аммония поступает на вибрационно-сушильный транспортер 12, Где он высушивается в токе горячего воздуха, подогретого до 110—130°.
Для сушки сульфата аммония применяют также другие сушилки 108-118. 156-159.
Для получения 1 г (NH4)2S04, содержащего 20,5% азота, необходимо израсходовать 0,75—0,76 г серной кислоты (100%), 0,26— 0,27 т аммиака, 2,7—6 т пара, 8 м3 воды и 25—30 квт-ч электроэнергии.
Для уменьшения слеживаемости предложено покрывать кристаллы сульфата аммония красителем 160"162, или вводить добавки 25~29. Уменьшить слеживаемость сульфата аммония можно также, выпуская его в гранулированном виде 163~168.
По бессатураториому методу поглощение аммиака проводят в скрубберах. Последние применяют как с насадкой (керамические кольца или деревянная хордовая насадка), так и без насадки (с брызгалами). Орошение скрубберов производится раствором сульфата аммония, содержащим 5—6% свободной серной кислоты. Температуру поддерживают в пределах 47—55°.
Из скрубберов насыщенный раствор сульфата аммония поступает на кристаллизацию. Иногда раствор вначале упаривают, затем охлаждают и из полученного пересыщенного раствора производят кристаллизацию 169. В других случаях кристаллизацию проводят под вакуумом (600—700 мм вод. ст.) с одновременным кон - Центрированием раствора.
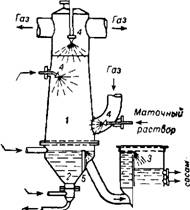
Разработана новая конструкция сатуратора брызгального типа с кристаллизационной ванной (рис. 365). Расположение брызгал (одного во входном штуцере газа и двух в самом скруббере на разных уровнях) обеспечивает почти полное улавливание аммиака из газа.
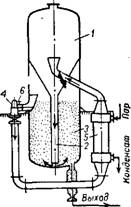
Кристаллизатор «Кристалл» английской фирмы «Пауэр-Газ» (рис. 366) состоит из испарительной части 1 и контейнера суспензии 3. Из испарительной части насыщенный маточный раствор по трубе 2 поступает в контейнер, где происходит рост и классификация кристаллов. Крупные кристаллы оседают на дно, откуда отводятся на фильтрацию. Маточный раствор с мелкими кристаллами Из верхней части контейнера вместе со свежим раствором циркуляционным насосом 4 через подогреватель 5 возвращается в испарительную часть, где расгвор концентрируется за счет испарения
Части воды. По данным фирмы, в этом кристаллизаторе 94—98% получающихся кристаллов имеют размеры 0,42—1,68 мм 170>171.
|
■*— Маточный I Раствор |
|
Маточный раствор |
|
Маточный раствор |
|
Маточный раствор |
|
Пульпа кристаллов ннасосу |
|
Рис. 365. Сатуратор с брызгалами И кристаллизационной ванной: J—сатуратор; 2 — кристаллизационная ванна; 3— циркуляционная кастрюля; 4 — брыз - галы; 5 — перегородка. |
На рис. 367 приведена бессатураторная схема английской фирмы «Саймонс-Карвэ». Коксовый газ поступает в безнасадочный скруббер 2, снабженный брызгалами 3, где улавливается аммиак. Скруббер разделен на две ступени. Первая ступень (нижняя часть скруббера) орошается маточным раствором, содержащим 1 % из -
|
Суспензии на фильтрацию Рис. 366. Кристаллизатор «Кристалл»: |
1 — испаритель; 2—центральная труба; 3 — контейнер суспензии; 4 — циркуляционный насос; 5 — подогреватель; б —штуцер для ввода свежего раствора
Быточной серной кислоты, вторая — (верхняя часть скруббера) орошается маточным раствори, содержащим 10—12% избыточной серной кислоты. Коксовый газ из абсорбера проходит ловушку 1 и направляется на дальнейшую переработку.
Серная кислота и вода поступают в сборник 4, из которого на-'" сосом 5 осуществляется циркуляция раствора в верхней части скруббера. Маточный раствор, вытекающий из нижней части скруббера, содержащий 40% сульфата аммония, поступает в сборник 11 И насосом 12 подается на орошение нижней части скруббера. В сборник 11 поступают также раствор из верхней части скруббера от насоса 5 и маточный раствор из центрифуги 7. Для обеспечения хорошей циркуляции в скруббере насосы 5 и 12 имеют большую производительность (по 220—240 ж3/ч).
Часть раствора из нижней зоны скруббера отбирается в сборник 10 и насосом 9 подается на сгущение в выпарной аппарат 6. Выпарка осуществляется под вакуумом 650—680 мм рт. ст., образовавшиеся кристаллы опускаются в коническую нижнюю часть, где они поддерживаются длительное время во взвешенном состоянии путем подачи свежего раствора в низ конуса. По данным фирмы, при такой системе кристаллизации не менее 60% кристаллов получаются с размером более 0,5 мм.
|
Рис. 367. Схема произвздства сульфата аммония из аммиака коксового газа Беесатураторным методом: / — ловушка; 2 — абсорбер брызгального типа; 3 — брызгалы; 4, 10 и 11— сборники; В, 8, 9 И 12 — центробежные насосы; 6— выпарной аппарат; 7 —центрифуга. |
Пульпа из выпарного аппарата центробежным насосом 8 подается для фильтрации на центрифугу 7. Затем соль сушится, упаковывается и направляется в склад I3S.
Проведены опыты гранулирования кристаллического сульфата аммония с добавкой примерно 25% фосфоритной муки. Получаемые гранулы достаточно прочны 172.