Природа силикатных растворов
Основные равновесия в системе, о которых упоминалось выше, представляются следующим образом:
Si02 + 2H20=Si (ОН)4 (1)
Si (ОН)4 + 0H-=HSi03~ +2Н20 (2)
2HSiOj = Si2Og~ - j - Н20 (3)
HSi03"~ - f0H_ = Si02- +;Н20 (4)
Для этих уравнений, принимая константу диссоциации воды равной Ю-14, имеем при 25°С:
= или [ОН-][51(ОН)4]==10_4,2
|
-4,2 |
[Si (ОН)4] [HSiOg-]
[HSi03-] [SiO2-]
Г][3120Г] =10_9|3 или [0H-][HSi05-] =10 [HSi2o5-] [Si2o|-]
[H^Hhsi203-] -8 или fQH-Ifs^I =
[Si2Ol"I
-1,84
= 2200
[HS103-]2
Вышеприведенные константы измерялись Роллером и Эрвином [27] в системе, содержащей в качестве основания кальций. В настоящее время имеются некоторые сомнения, будут ли в растворе силиката натрия образовываться дисиликат-ионы в соответствии с этими уравнениями. Наблюдения Айлера показывают, что в присутствии коллоидных частиц кремнезема и при очень низкой концентрации ионов натрия в равновесии с мономером Si (ОН) 4 и ионами ОН - находятся лишь ионы
НБіОз - и БЮз-. 1 %-ный золь, состоящий из очень небольших частиц коллоидного кремнезема, приготовляли полимеризацией монокремневой кислоты, полученной в свою очередь из этилси - ликата, в течение 24 ч при 25°С и рН 7,8. Отмечалось некоторое повышение значения рН по мере того, как удельная поверхность, определенная по методу Сирса [28], падала до значения 1040 м2/г, а частицы кремнезема вырастали приблизительно
|
Время, мин Рис. 2.2. Зависимость скорости реакции молибденовой кислоты с образцами золя кремнезема от времени при различных значениях рН (указаны цифрами На кривых). |
До 2,6 нм в диаметре. Для регулирования рН до различных значений в интервале 8,5—10,5 к отдельным порциям этого золя добавляли раствор NaOH. Затем золи подвергали старению при 25°С, в процессе которого многократно отбирали небольшие образцы проб с целью измерения скорости развития окрашивания в реакции с молибдатным реактивом. Через два часа после начала старения в величинах скорости этой реакции для разных образцов не было зарегистрировано каких-либо дальнейших изменений. На рис. 2.2 представлены кривые, показывающие количество прореагировавшего кремнезема в зависимости от времени. Примерно через 5 мин после начала процесса наклоны прямолинейных участков всех кривых становятся одинаковыми и соответствующими скорости реакции коллоидных частиц с молибденовой кислотой. Представлялось интересным определить скорость такой реакции. Для общего количества кремнезема 104 мг в образце золя с суммарной поверхностью Si02 Ю 400 м2 скорость реакции оказалась примерно равной 300 мг Si02/4. Удельная скорость реакции составила 3-Ю-5 г/(м2-ч).
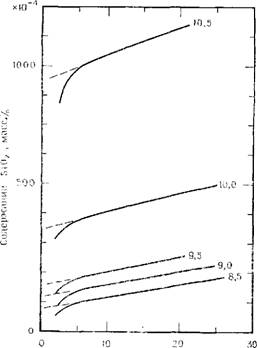
Путем экстраполяции прямолинейных участков кривых, показанных на рис. 2.2, к нулевому моменту времени определены суммарные концентрации растворимого кремнезема, т. е. мономерного и ионного кремнезема в исходных образцах золя:
|
Концентрация |
||
|
РН золя |
Масс. % |
Ммоль/л |
|
8.5 |
0,0175 |
2,9 |
|
9,0 |
0,0220 |
3,7 |
|
9,5 |
0,0260 |
4,3 |
|
10, D |
0,0450 |
7,5 |
|
10,5 |
0,0950 |
15,8 |
На рис. 1.10 6 для случая линии В было показано, что равновесная растворимость частиц размером 2,6 нм при рН 8 приблизительно составляет 150 млн-1 (0,015%) или 2,5 мМ. Эта величина достаточно близка к значению, полученному из вышеприведенных данных экстраполяцией к рН 8 (см. рис. 2.3).
Принимая значение 2,5 мМ как концентрацию Si(OH)4, а в качестве констант химического равновесия — константы по Роллеру и Эрвину, можно подсчитать концентрацию различных разновидностей в состоянии равновесия системы:
. [HSi03-]=fSl(0H)4] [Н+]-1 . 10_!,'S
[Si0,r] =[HSi03-] [н+]-' • ur12-lfi
[Si2Og~] =2200 [HSi03~]2
[HSi2or] = fSi2o?-][H+].io+^
На рис. 2.3 приведены рассчитанные концентрации Si (ОН) 4, HSiOT и Si03~ для различных значений рН. Хотя такие кривые отчасти различаются при рН 9, ясно, что при рН 10,5 общая концентрация растворимого кремнезема может быть объяснена присутствием Si (ОН) 4 И HSiOjT и, вероятно, небольшим количеством ионов Si03~. Таким образом, никакие другие ионные разновидности не могут присутствовать в заметных количествах.
Согласно вышеприведенным уравнениям, дисиликат-ионы Si2Og - и HSi2Or также должны присутствовать в более высоких концентрациях, чем HSiO^. Поскольку хорошо известно, что дикремневая кислота полностью вступает в реакцию с мо
либденовой кислотой за время менее 5 мин, то, если бы к настоящей системе были применимы уравнения, относящиеся к дисиликат-ионам, количество суммарного кремнезема, прореагировавшего за 5 мин, должно было быть гораздо больше, чем это наблюдалось в эксперименте.
Поэтому приходится сделать вывод, что наблюдения, выполненные Роллером и Эрвином [27] относительно образования
20
К
О
2
2 ю
См
О
ІП
СЕ
|
2 |
3
Дисиликат-ионов, правомерны только для изученной ими кальциевой силикатной системы. Тот факт, что двухзарядный ион кальция способствует формированию сложных дисиликат-ионов, в которые включены связи Si—О—Са, не вызывает удивления.