ОПРЕДЕЛЕНИЕ ТИТРУЕМОЙ КИСЛОТНОСТИ НАТУРАЛЬНЫХ ПИЩЕВЫХ КРАСИТЕЛЕЙ
Титруемую кислотность обычно выражают в градусах кислотности, т. е. в количестве миллилитров І н. щелочи, израсходованной на нейтрализацию кислоты в 100 г вещества (или 0,1 н. щелочи на 10 г вещества). Если известно количество миллилитров 1 II. щелочи, затраченное на нейтрализацию кислоты в 100 г вещества, то можно пересчитать градусы кислотности на содержание соответствующей кислоты в процентах: яблочной, лимонной, винной, молочной и др. При этом следует количество миллилитров 1 н. щелочи, израсходованное на нейтрализацию кислоты в 100 г вещества, т. е. градусов кислотности, умножить на миллиграмм-эквивалент соответствующей кислоты [34].
Определение титруемой кислотности в натуральных пищевых красителях осуществляют методом потенцио - метрического титрования, так как растворы их окрашены и при титровании щелочью маскируют окраску фенолфталеина (индикатора).
Навеску концентрированного красителя в количестве 10 г отвешивают с точностью 0,01 г, растворяют в дистиллированной воде в химическом стакане и количественно переносят в мерную колбу вместимостью 200 мл. Содержимое колбы разбавляют дистиллированной водой до метки. Затем отмеривают пипеткой 20 мл приготовленного раствора красителя в стакан потенциометра и титруют 0,1 н. раствором едкой щелочи, измеряя рН в процессе титрования до тех пор, пока стрелка прибора не остановится на цифре 6,8—7,0, т. е. до рН 6,8—7,0.
Титруемую кислотность х в градусах или в мл 1 н. щелочи на 100 г красителя рассчитывают по следующей формуле:
Vi— объем мерной колбы, в которой растворена навеска красителя, мл;
Уг — объем раствора красителя, взятый для титрования, мл; т — масса навески испытуемого красителя, г.
Подставляя значения соответствующих величин в приведенную формулу, получим
К я-200-100
Х _--------- ~ К) К п граЛ.
20-10.10
Следует отметить, что графически построенная кривая зависимости величины рН от объема прибавляемого раствора при потенциометрическом титровании похожа на кривую титрования, используемую при выборе индикатора. Характерным для кривых потенциомет - рического титрования является максимальная крутизна их в точке перехода из кислой среды в щелочную и наоборот.
При потенциометрическом титровании минеральной кислоты едкой щелочью точка перехода из кислой'среды в щелочную находится на вертикальном отрезке кривой титрования и соответствует рН 7,0.
При определении кислотности органических и биологических продуктов установление точки перехода из одной среды в другую в испытуемом растворе представляет некоторые затруднения, обусловленные его буферными свойствами.
Например, при титровании соляной кислоты переход из кислой среды в щелочную происходит от одной капли щелочи и точка перехода (рН 7) находится на середине вертикального отрезка кривой титрования. В случае определения кислотности такого продукта, как какао-порошок, кривая потенциометрического титрования будет наклонена к горизонтальной оси (будет отлогой) тем больше, чем сильнее выражены буферные свойства вещества. Точка перехода в этом случае будет соответствовать рН, близкому к 7.
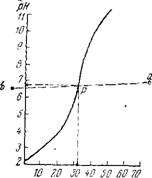
Туббс предложил графический метод определения точки перехода из кислой среды в щелочную при потенциометрическом титровании [103]. Испытуемый раствор титруют 0,1 и. раствором едкой щелочи, приливая ее небольшими порциями и каждый раз отмечая пока
зания прибора. Вблизи точки перехода дозы щелочи уменьшают до 0,1 мл и титрование продолжают до рН 11 и более. По полученным данным строят кривую титрования, откладывая на оси абсцисс количество израсходованной щелочи (в мл), на оси ординат — соответствующие значения рН.
Для графического нахождения точки перехода при потенцнометрическом титровании изготавливают шаблон из прозрачной плотной пленки в виде квадрата размером 15X15 см. Из вершины одного из углов квадрата при помощи циркуля описывают концентрические дуги с расстоянием между ними точно 5 мм.
Готовый шаблон помещают сначала на нижнюю часть кривой титрования и располагают так, чтобы кривая большинства точек совместилась с одной из дуг шаблона, и на графике отмечают точку а, соответствующую общему центру всех дуг шаблона. То же проделывают и с верхней частью кривой титрования, отмечая на графике точку b■ Затем точки а и Ъ соединяют на графике прямой линией- Точка р, в которой эта прямая пересечет кривую титрования, является точкой перехода из кислой среды в щелочную для данного конкретного продукта. Опуская из этой точки р на графике перпендикуляры на оси абсцисс и ординат, узнают соответствующие точке перехода количество миллилитров израсходованной при титровании щелочи п значение рН (рис. 10)-
|
Млґ/аОИ Рис. 10. Кривая потенцио - метрнческого титрования энокрасителя. |
Авторы проводили опыты по определению точки перехода из кислой среды в щелочную при потенцнометрическом титровании образца энокрасителя - Получены данные, позволившие установить графическим способом, что при потенцнометрическом определении титруемой кислотности энокрасителя точка перехода из кислой среды в щелочную соответствует рН 6,8 (см - рис. 10).