АППАРАТЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
СОРБЦИОННЫЕ МЕТОДЫ РАЗДЕЛЕНИЯ ГАЗОВЫХ СМЕСЕЙ
Во многих химических производствах используются Jh получаются газообразные продукты, представляющие собой гомогенные смеси. Часто приходится из таких смесей выделять какой-либо продукт в чистом виде или разделять смесь на составляющие ее компоненты.
Разделение гомогенных газовых смесей в промышленности осуществляется:
1) Сорбцией;
2) Физико-механическим путем;
3) Химическим взаимодействием. 4
Собственно химические методы не являются темой данного курса и они в этой книге не рассматриваются; физико-механические методы разделения будут рассмотрены в главе, посвященной глубокому охлаждению, здесь же остановимся на сорбционных процессах.
Сорбционными процессами в общем случае называются такие процессы, в которых происходит поглощение вещества на поверхности раздела двух фаз, независимо от механизма поглощения.
Частными случаями сорбции являются процессы абсорбции и адсорбции. Абсорбцией называется сорбция газа при проникновении его фШффузии) в массу сорбента (жидкость, твердое тело), приводящая к образованию раствора. Потт ядспрбтгирй понимают сгущение газа на поверхности твердого вещества, не сопровождающееся сжижением газа.
Конденсация паров в тончайших порах (капиллярах) твердого вещества есть также процесс сорбции, который называется в отличие от адсорбции капиллярной конденсацией.
В тех случаях, когда поглощаемый газ ооразует с поглотившим его веществом новое химическое соединение, процесс называется х е м о - сппб тт и е й.
Поглощаемый газ называется абсорбтивом илиадсорбти - в о м,1в зависимости от характера процесса сорбции, а поглощающий агент соответственно абсорбентом или адсорбентом.
Процессы сорбции являются процессами селективными (избирательными), т. е. каждый абсорбент или адсорбент обладает способностью поглощать лишь некоторые вещества (абсорбтивы) и не поглощать вовсе * или поглощать весьма незначительно другие вещества. Это свойство абсорбентов (адсорбентов) дает возможность осуществить разделение газовых смесей без затраты механической энергии. .
Рассмотрим газовую смесь, состоящую из компонентов А и В, и абсорбент, который легко поглощает компонент А и не поглощает компонента В. Если такую смесь привести в соприкосновение с абсорбентом, то компонент А будет поглощен и газовая смесь может быть разделена на составные части путем выделения компонента А из полученного раствора.
Процесс выделения поглощенного компонента из раствора называется десорбцией.
Во многих случаях проводить десорбцию не обязательно, так как часто абсорбент и абсорбтив являются дешевыми или отбросными продуктами, которые можно после абсорбции не использовать, вновь. Еще чаще образующийся продукт абсорбции (раствор) является конечным продуктом производства и дальнейшие операции по разделению (десорбция) теряют смыСл. Таким образом, при рассмотрении сорбционных процессов будет правильнее говорить об абсорбции и адсорбции не только как о методах разделения газообразных смесей на составные части, но и как о методах выделения чистых компонентов в виде раствора иг газовой смеси, и методе очистки газов.
78. Физические основы абсорбции
Растворимость газов в жидкостях. При взаимодействии какого-либо газа с жидкостью возникает система, состоящая из двух компонентов и двух фаз—жидкой и газообразной. Такая система имеет по правилу фаз две степени свободы (С= 2, Р=2 и К=2+2—2—2), т. е. так же, как и двухкомпонентные жидкие смеси, система будет двухвариант - ной. Из трех основных параметров, определяющих фазовое равновесие: давление температура и концентрация, принимаем температуру постоянной и тогда получаем однозначную зависимость растворимости газа в жидкости от давления.
Эта зависимость, как было показано выше, для идеальных газов выражается законом Генри и вытекающим из этого закона уравнением
YP = K ХХ (3-68)
Где kx = - р—константа фазового равновесия, величина безразмерная
—коэффициент Генри; Р—общее давление).
<ь
Из соотношения следует, что в принятой нами системе еди
Ниц измерения коэффициент Генри выражается в единицах давления. Числовые значения коэффициентов Генри зависят от свойств газа и температуры: с повышением температуры числовое значение f увеличивается и растворимость газа в жидкостях уменьшается. Соответственно с повышением температуры числовое значение коэффициента фазового равновесия kx увеличивается. Числовые значения коэффициента Генри для некоторых газов в водных растворах при разных температурах приведены в табл. 21.
Уравнение (3—68) показывает, что для идеальных газов линия равновесия в координатах у—х представляет собой прямую, проходящую через начало осей координат и имеющую угол наклона, тангенс которого равен kx.
Закон Генри хорошо согласуется с данными опытов и для реальных газов при низких концентрациях растворенного газа, а также при малой растворимости газа. Для систем, не подчиняющихся закону Генри, можно пользоваться уравнением (3—68Х принймая коэффициент фазового равновесия kx переменной величиной, зависящей от состава раствора х; при этом линия равновесия изобразится кривой, которую наносят на диаграмму у—х по опытным данным.
При расчете абсорбционной аппаратуры обычно концентрацию абсорбируемого газа в газовой смеси выражают в кг-мол на 1 кг-мол инерт -
|
Таблица 21 Числовые значения коэффициента Генри для водных растворов газов (ф■ 10 ® мм рт. ст.) Температура в °С
|
Ного газа, а содержание того же газа в растворе—в кг-мол на 1 кг-мол растворителя. В этом случае
У = ТГу (3-69)
X=y^tx (3—69а)
И линию равновесия строят на диаграмме у—х в виде прямой. Если же диаграмму строить в координатах У—X, то
^Т+Еух <3-70>
И линия равновесия в этом случае всегда будет кривой.
Уравнения абсорбции. При выводе уравнений абсорбции обычно исходят из так называемой пленочной теории абсорбции. Согласно этой теории на поверхности раздела жидкой и газообразной фаз имеется пограничный слой, который оказывает основное сопротивление прохождению газа из газовой смеси в жидкость. Пограничный слой образуют две прилегающие друг к другу пленки: первая пленка состоит из молекул газа, а ■ вторая—из молекул жидкости. Под действием конвекционных токов, происходящих в жидкостях и газах, частицы легко перемещаются одна относительно другой и свободно движутся по пространству, в котором заключены газ или жидкость. Поэтому находящийся над жидкостью газ имеет одинаковую концентрацию в любой точке пространства, которое он занимает над жидкостью, а концентрация раствора в жидкости одинакова во всем его объеме. Концентрации же жидкости и газа в пограничных жидкой и газообразной пленках соответствуют равновесным концентрациям, т. е. соответствуют фазовому равновесию. Таким образом, согласно пленочной теории абсорбции абсорбируемый газ диффундирует через пленку инертного газа, затем, попадая в жидкостную пленку, образует раствор, из которого в свою очередь диффундирует в жидкость. Следовательно, процесс абсорбции сводится к диффузии газа через газовую и жидкостную пленки.
При таком представлении о механизме процесса диффузии, по аналогии с теплопередачей, сопротивление абсорбции выражают суммой частных сопротивлений указанных пленок, а обратную величину коэффициентов абсорбции определяют как сумму обратных величин частных или пленочных коэффициентов абсорбции.
В действительности, в процессе абсорбции, особенно в статических условиях и при небольших скоростях жидкости и газа, газообразная и жидкостная пленки, очевидно, имеются. Однако такой подход к обоснованию методики расчета абсорбционных аппаратов, по нашему мнению, не вполне пригоден. В современной промышленности при больших масштабах производства стремятся интенсифицировать производственные процессы путем максимально возможного увеличения скоростей жидкостей и газов. В этих условиях массообмен обусловливается главным образом конвективным переносом, а не молекулярной диффузией, и решающее влияние на величину коэффициента массопередачи оказывает скорость протекания газа. В связи с этим пленочная теория абсорбции, построенная только на молекулярной диффузии, является до известной степени тормозом для разработки методов интенсификации процесса абсорбции. В диффузионных процессах обе фазы непосредственно соприкасаются, вследствие чего общий коэффициент массопередачи для каждой пары жидкости и газа зависит исключительно от их свойств и скорости протекания жидкости и газа, и поэтому нет необходимости вводить частные коэффициенты, тем более что опытным путем определить непосредственно величины этих частных или пленочных коэффициентов не представляется возможным. Гораздо проще, и надежнее сразу определить опытным путем общий коэффициент массопередачи в зависимости от условий проведения процессов, как коэффициент скорости переноса массы из одной фазы в другую.
Следует иметь в виду, что коэффициенты массопередачи, предложенные разными исследователями по опытным данным, фактически являются общими коэффициентами, а не фазовыми. Поэтому для расчетов абсорбционной 4 аппаратуры мы исходим из общих уравнений массопередачи, изложенных в главе X.
|
[Kv} = |
Если поверхность межфазового контакта вполне определима, то для расчета абсорбционных аппаратов следует пользоваться уравнениями (3—34) и (3—37). В применении к процессам абсорбции Ку представляет собой коэффициент абсорбции при выражении движущей силы процесса в молярных концентрациях газовой смеси и Кх—тот же коэффициент при выражении движущей силы процесса в молярных концентрациях жидкой фазы. Эти коэффициенты имеют следующую размерность:
Кг-мол
Кг-мол
|
1**1 = |
М2*час•
.кг-мол
Кг-мол м2-час• —-—
Соотношения между К у и Кх находим из сопоставления уравнений (3—34) и (3—37):
G = KyFi&Ycp. = KxFxkxcp.
Так как t/p—ktx, то
Kx = KxKy ' (3-71
В уравнении (3—34) молярные концентрации газовой фазы можно заменить парциальными давлениями газа, выраженными в долях от общего давления:
|
(3—73) |
|
ДРн |
(3—72) где
ДРср.=
2,3 lg
ДРк
|
G=KpFxLpcp. ЛРн — ЛРк |
ЬРн = Рн — Ррк ЬРк = Рк — Ррн
|
(3-74) |
Если парциальные давления выражены в долях от общего давления, то коэффициенты Кр и Ку численно равны друг другу. Если же парциальные давления выражены в единицах давления, например в мм рт. ст., то
Кр = РКу
|
|
Расход поглощающей жидкости (абсорбента). При расчете абсорберов задаются количеством газовой |^смеси, подлежащей обработке, начальной концентрацией поглощаемого газа в газовой смеси, конечной концентрацией его и начальной концентрацией абсорбента. Обозначим:
Gy—количество газа, поступающего в абсорбер, в кг-мол! час\ Ун—начальная концентрация абсорбируемого газа в
Кг-мол! кг-мол инертного газа; Ук—конечная концентрация абсорбируемого газа в
Кг-мол! кг-мол инертного газа; Хп—начальная концентрация абсорбированного газа в
Жидкости в кг-мол! кг-мол чистого абсорбента; Хк—конечная концентрация абсорбированного газа в жидкости в кг-мол/кг-мол чистого абсорбента; У—концентрация абсорбируемого газа в газовой смеси в любом сечении абсорбера в кг-мол! кг-мол инертного газа;
X—концентрации абсорбированного газа в жидкости в любом сечении абсорбера в кг-мол! кг-мол чистого растворителя;
W—количество чистого абсорбента, протекающего через
Абсорбер, в кг-мол! час\ 0И—количество инертного газа в газовой смеси, протекающей абсорбер, в кг-мол! час, причем
Ga = Gy (1 — уИ) = Gy —Кг-молічас
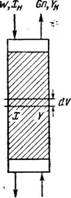
Рассмотрим процесс абсорбции, протекающий в пределах элементарно малого объема абсорбера dV (рис. 323). Количество газа G, поглощенное абсорбентом при прохождении газового потока через элемент объема в час, может быть выражено следующим уравнением материального баланса:
DG = —GKdY == — WdX .
Где dY и dX—изменение концентрации поглощаемого газа в пределах элемента объема dV абсорбера.
|
ЩХК Gn, YH Рис. 323. К материальному балансу абсорбера. |
|
Через |
3 1 А. Г. Касаткин.
Для всего объема абсорбера надо взять интегралы от левой и правой частей равенства в пределах заданных начальных и конечных концентраций абсорбируемого газа в газовой смеси и в жидкости, считая величины GH и W постоянными:
К Лн
С = --6И f DY = — W f DX
Из последнего уравнения имеем
G = Ga (YH — YK) = W (XK - XH) (3-75) откуда общий расход абсорбента:
W = GH vH~vK кг-мол/час (3—76) а удельный расход его: '
M=-g-= хн кг-мол/кг-мол инертного газа (3—76а)
Уравнение (3—76а) можно переписать следующим образом:
YH-YK = m{X К-Хн) (3-77
Выражение (3—77) показывает, что изменение концентрации в абсорбере происходит прямолинейно и, следовательно, в координатах Y—X линия рабочих концентраций при абсорбции представляет собой прямую с углом наклона, тангенс которого равен
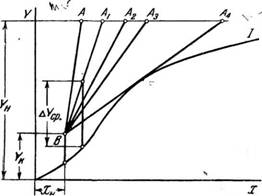
Между удельным расходом абсорбента в абсорбере и размерами абсорбера существует определенная связь. Пусть линия / (рис. 324) является линией равновесия У—; (X). Через точку В с координатами по уравнению (3—77) проводим линии рабочих концентраций ВА, ВАг, ВА2, ВА3, ВА±, соответствующие различным концентрациям абсорбента или различным удельным его расходам. При этом точки А, Аг, АА3, А 4 лежат на одной горизонтальной прямой соответствующей заданной конечной концентрации газовой смеси Кн.
Рассмотрим полученную диаграмму совместно с основным уравнением массопередачи (3—34):
G-=-KvFLycv, кг-мол/час
При заданных условиях величины G и Ку в уравнении массопередачи являются постоянными и, следовательно, постоянным должно быть и произведение F&ycp; таким образом, поверхность фазового контакта F может меняться только при соответствующем изменении величины движущей силы Дг/Ср. Иными словами, поверхность F может быть уменьшена при соответствующем увеличении Д^ср. и» наоборот, F увеличивается с уменьшением ДуСр. Величина поверхности фазового контакта F опре-
деляет размеры абсорбера любой конструкции и, следовательно, с увеличением поверхности F в колоннах с насадкой должна соответственно увеличиться высота насадки Я, а в колоннах тарельчатых — число тарелок NT.
На графике рис. 324 для любого значения X и выбранного m разность концентраций или движущая сила процесса выражается разностью ©рдинат Y—Yр, изображенных вертикальными отрезками, соединяющими соответствующие точки линии рабочих концентраций А В и линии равновесия I. Для всего абсорбера можно принять среднее? значение Д#ср., величина которого для рабочей линии ВА1 изображена на рисунке отрезком Ьуср..
Величина Дг/Ср. будет тем большей, чем круче наклон линии рабочих концентраций и, следовательно, чем больше удельный расход абсорбента. Если линия рабочих концентраций В А будет совпадать с вертикалью, то в этих условиях движущая сила процесса имеет максимальное значение, однако удельный расход абсорбента т при этом равен бесконечности. Если же линия рабочих концентраций БЛ4 является касательной к линии равновесия, то при этих условиях удельный расход абсорбента будет минимальным, а движущая сила в точке [касания равна нулю. В первом^ случае размеры абсорбера будут наименьшими при бесконечно~большом~расходе абсорбента, во втором—расход абсорбента" найМеныний при бесконечно больших" размерах абсорбера, и, таким образом, оба случая являются предельными и практически непригодными.
В тех случаях, когда удельный расход абсорбента не задан технологическими условиями, т. е. когда не задана конечная концентрация абсорбента, следует выбирать такое соотношение между поверхностью F или вообще размерами абсорбера и удельным расходом абсорбента т, при котором удельный расход абсорбента и размеры абсорбера будут ©птимальными.
Влияние упругости паров поглотителя. В предыдущих выводах не учитывалось влияние упругости паров поглотителя на процесс абсорбции, что допустимо в тех случаях, когда эта упругость мала по сравнению с парциальным давлением абсорбируемого газа. Можно принимать, что уходящий из абсорбера газ насыщен парами поглотителя независимо от присутствия их в поступающем газе.
При расчете следует во всех уравнениях за Gx Принимать количество сухого, т. е. не содержащего паров поглотителя, инертного газа. Моль-доля компонента в газовой смеси при этом определяется из расчета на сухой газ (т. е. на газ, состоящий лишь из адсорбируемого компонента и сухого инертного газа). Давление Р во всех уравнениях должно рассматриваться как парциальное давление сухого газа; иначе говоря, Р есть полное давление газовой смеси минус парциальное давление паров поглотителя.
Неизотермическая абсорбция. Если абсорбцию ведут без отвода тепла или с недостаточным его отводом, то в процессе абсорбции температура повышается вследствие выделения тепла при поглощении газа в жидкости. Значительное повышение температуры должно быть учтено при расчете. Простых методов расчета неизотермической абсорбции нет, но для технических расчетов можно пренебречь нагреванием газовой фазы и считать, что все выделяющееся тепло абсорбции идет на нагрев жидкости.
|
Рис. 324. К определению удельного расхода абсорбента. |
Если линия равновесия при температуре TH Поступающей жидкости изображается кривей 0D (рис. 325), то при температуре TH Уходящей жидкости линия равновесия рас
положится выше (кривая ОС) и действительная линия равновесия при переменной температуре жидкости изобразится кривой АВ.
Ординату Ур некоторой точки М на кривой, соответствующую составу жидкости X, можно найти, если известна температура T При данном составе жидкости. Для этого необходимо составить уравнение теплового баланса для части абсорбера выше сечения
С концентрациями жидкости и газа X и Y. Это уравнение может быть написано в виде
QGMy = Wc (T — /н) Мх (3—78)
Где Q—количество тепла, выделяемого при поглощении 1 кгс газа, в Ккалікгс;
G—количество газа, поглощенного в рассматриваемой части абсорбера, в кг-мол/час, W—количество жидкости в кг-мол/час\ С—теплоемкость жидкости в
Ккал/кгс °С; T—температура жидкости в рассматриваемом сечении в °С; /н— начальная температура жидкв-
|
|
Сти в °С; Му—молекулярный вес абсорбируемого газа; Мх—молекулярный вес жидкости.
Подставив ^уравнение (3—78) значение G=W(X—Хн), получим ДМу (X - Хн) = сМх (T - TH)
Откуда искомая температура жидкости
(3-79)
Промышленные методы абсорбции. Из основных уравнений абсорбции видно, что количество абсорбированного вещества прямо пропорционально поверхности контакта фаз, и, следовательно, абсорбционная
Аппаратура] должна иметь развитую поверхность соприкосновения проходящих через нее жид - Чл кости и газа. Для этого необходимо постоянное
Обновление поверхности контакта между жидкой и газообразной фазами.
Контакт между жидкостью и газом создается по одному из следующих методов:
V; 1) пропусканием газа над поверхностью жидкости;
\}2) пропусканием газа через башню с насадкой, которая орошается жидкостью, покрывающей насадку в виде тонкой пленки; Tjr у 3) пропусканием газа в виде мелких пу -
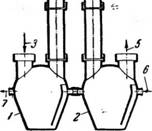
СорберыИЧеСКИе зырьков сквозь слой жидкости (барботирова -
/, 2—абсорберы; 3—вход газа; НИЄМ);
Соединительный газопровод; 5-вы - - ч) 4) пропусканием Газа ЧЄрЄЗ ПрОСТраИ -
Ход газа; 6—вход жидкости; 7—вы - - r„rr
Ход раствора. ство, заполненное разбрызгиваемой ЖИДКОСТЬЮ.