КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Поляризационная кривая и диаграмма Пурбэ
При появлении электрохимического (электродного) потенциала катодного или анодного процесса (р в растворе возникает движение ионов, а в металле — электронов, т. е. в системе возникает ток і. Анодный ток характеризуется удалением от металла его ионов, т. е. он показывает скорость анодного растворения металла, скорость его коррозии. На катодном участке электроны передаются деполяризаторам, находящимся в растворе, которые восстанавливаются. Сам металл этого участка защищается от окисления, т. е. не корродирует.
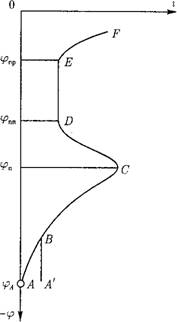
Зависимость потенциала электрода ір от проходящего через него тока г показывает поляризационная кривая.
Для анализа коррозионного процесса большое значение имеет поляризационная кривая (рис. 12.46).
Поляризационная кривая неоднозначна. На участке ABC происходит увеличение скорости растворения при увеличении потенциала — растворение металла в активном состоянии. После достижения максимального значения в точке С при <рп скорость растворения металла снижается из-за образования защитной пленки. От точки Д до точки Е скорость растворения минимальна, постоянна, не зависит от (р. Участок ДЕ — область пассивации или пассивного состояния металла. На участке EF при росте <р скорость растворения опять увеличивается — область перепассивации. Потенциал в точке Д <^пм называют потенциалом пассивации (Фладе — потенциалом), в точке Е — потенциал пробоя (рир (потенциал перепассивации). В ряде случаев вместо участка АВ может быть участок А'В, где г не зависит от кр — участок псевдопассивации. В некоторых водных средах область пассивации
Отсутствует — идет непрерывный процесс растворения металла. Отсюда возникает одна из задач водного режима — создать такой водно-химический режим, при котором достигается пассивность металла.
Поэтому важно знать характеристики системы железо-вода-кислород. Для анализа свойств этой системы используются диаграммы </?-рН или диаграммы Пурбэ. Эти диаграммы показывают связь между электродным потенциалом металла <р водородного показателя рН водного раствора и термодинамически устойчивыми формами оксидов железа, при этом учитывается и растворимость получаемых оксидов или гидрооксидов железа (Fe(OH)2, Fe(OH)3, FeO, Fe304, Fe203 и др.).
На рис. 12.47 показана упрощенная диаграмма Пурбэ для системы железо-вода-кислород. При определенных сочетаниях <р и рН могут быть: зона коррозии металла (присутствуют ионы Fe2+, Fe3+, HFeO^T);зона иммунитета (железо не корродирует; ср < (рА — см. рис. 12.46); зона пассивации (область пассивности; железо не корродирует из-за образования защитной оксидной пленки из Fe203 и Fe304). Сопоставление рис. 12.46 и 12.47 показывает, что поляризационная кривая соответствует диаграмме Пурбэ при рН = = const.
Из диаграммы Пурбэ (рис. 12.47) видно, что для системы железо-вода-кислород имеются две зоны (при высоком и низком значениях рН), коррозия металла в которых равномерна. Воздействуя на среду каким-либо восстановителем, потенциал электрода можно понизить до значений зоны иммунитета. Металл в зоне иммунитета термодинамически устойчив и не корродирует.
|
Рис. 12.46. Поляризационная кривая. |
Второй способ защиты металла: воздействуя на систему окислителем, увеличить значение окислительно-восстановительного потенциала до значений, при которых наступит зона пассивности. Железо в зоне пассивности термодинамически неустойчиво. Железо покрывается слоем Fe203 или Fe304, который защищает его, изолируя от водного теплоносителя. Если пленка твердая, то железо не корродирует. Если же пленка неплотная, то
Корродируют слабо защищенные места, т. е. коррозия питтинговая. Увеличение концентрации окислителя увеличивает защитные свойства пленки.
Проведенный анализ показывает, что кислород, с одной стороны, способствует протеканию коррозионных процессов, с другой — создает защитные оксидные пленки на металле. Для воды высокой чистоты перевод металла в область пассивации достигается при относительно невысоких концентрациях кислорода (десятки-сотни мкг/кг), что может быть реально осуществлено на электростанциях. Для вод с большим солесодержанием (при электрической проводимости свыше 0,2-0,3 мкСм/см) для пассивации металла необходима высокая концентрация кислорода (десятки граммов на литр воды), что обеспечить на станциях практически невозможно. Поэтому такие воды надо деаэрировать для удаления кислорода и предотвращения коррозии металла.