КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Примеры растворимости примеси в водном теплоносителе
Примеси, поступающие в водный теплоноситель, можно разделить на две группы: естественные примеси и продукты коррозии. Естественные примеси поступают в водяной тракт за счет присосов воды в конденсаторе и сетевых подогревателях, с добавочной водой; остаточная концентрация катионов Na, К, Са, Mg не изменяется после блочной обессоливающей установки (БОУ) (после конденсатора, если нет БОУ). Продукты коррозии (катионы Fe, Си, А1 и др.) образуются в самом водяном тракте, их количество увеличивается по мере прохождения среды по тракту.
Естественные примеси делятся на трудно (мало) растворимые и легко (хорошо) растворимые. К труднорастворимым соединениям относятся соединения Са и Mg: сульфат CaSC>4, карбонаты СаСОз, MgCC>3, силикаты CaSiC>3, MgSiC>3, гидроокиси Са(ОН)2, Mg(OH)2. К легкорастворимым соединениям Са и Mg относятся: сульфат MgSC>4, хлориды СаСЬ, MgCh, бикарбонаты Са(НСОз)2, Mg(HC03)2. Все натриевые соединения обладают высокой растворимостью в воде.
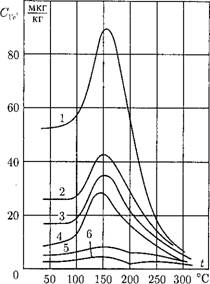
Труднорастворимые соединения. Поступление в паровой котел труднорастворимых соединений кальция и магния с питательной водой лимитируется на достаточно низком уровне. При нарушениях в работе конденсатоочистки, увеличении присосов воды в конденсаторе количество поступающих соединений Са и Mg значительно возрастает. Такие соединения, как CaSC>4, СаСОз, Mg(OH)2, имеют отрицательный температурный коэффициент растворимости, т. е. с ростом температуры растворимость падает (рис. 12.20). В природных водах содержание Са существенно выше, чем Mg, поэтому при анализе поведения труднорастворимых соединений обычно рассматривают только соединения Са.
Труднорастворимые соединения в воде частично диссоциируют на ионы (катионы Ме7П+ и анионы Ап"~). Например:
CaS04 - Са2+ + SO^".
Степень диссоциации К равна (вместо активностей рассматриваем концентрацию ионов, что для разбавленных растворов допустимо)
[Ca2+][SOM [СаС04]
Отсюда
[Са2+] [SO^~] = К [СаС04] = ПР.
Так как для труднорастворимых соединений [Са2+] и [SO2-] <[CaS04], то при изменении .концентрации ионов концентрация молекул [CaS04] практически не меняется:
К[С aS04] = ПР = const.
Рис. 12.20. Растворимость Произведение концентраций (активностей)
Основных накипеобразо - ионов труднорастворимой соли в насыщенном вателей, присутствующих растворе, называемое произведением раствори - в воде - мости ПР, остается постоянной величиной при
Данной температуре. Величина ПР зависит от температуры системы.
В воде присутствует не только анион SO2-, но и анионы CO2"", SiO2-, Р04~ и другие, с которыми Са образует труднорастворимые соединения типа СаАп. Для каждого из э^их соединений определяется величина ПРсаАп - Кальций (аналогично — магний) будет находиться в воде в молекулярной и ионной форме при соблюдении неравенства
[Са2+] [Ап~] < ПРсаАп.
При упаривании воды в испарительных поверхностях нагрева концентрация всех ионов повышается и может достигнуть насыщения. В первую очередь кристаллизоваться из водного раствора будут те соединения, произведение растворимости которых минимально. Соединения с отрицательным коэффициентом растворимости кристаллизуются в основном на поверхности нагрева, образуя накипь. Такие вещества называются накипеобразовате - лями. Другие вещества, с положительным коэффициентом растворимости, кристаллизуются в объеме раствора на грубодисперсных и коллоидных частицах, образуя шлам, т. е. мелкие взвешенные в воде частички (вещества — шл амообразователи).
|
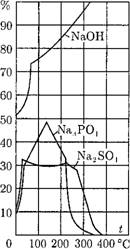
Рис. 12.21. Растворимость основ - Рис. 12.22. Растворимость магнетита в ных легкорастворимых соедине- воде при различных концентрациях ам - ний, находящихся в воде. миака, выраженных в мг ЫНз/кг: 1 — 0,1; 2 - 0,2; 3 - 0,3; 4 - 0,45; 5 - 1,0; 6 - 2,0. |
Легкорастворимые соединения. На рис. 12.21 приведены значения растворимости для некоторых легкорастворимых соединений. Видно, что некоторые из них (NaOH) имеют положительный коэффициент растворимости во всем приведенном диапазоне температур, другие (Na3P04, Na2S04) — только до 100-150°С, а при температуре свыше 200°С имеют отрицательный коэффициент растворимости. При нормальной работе барабанных котлов концентрация этих примесей обычно значительно меньше их растворимости и кристаллизоваться на стенках трубы или в объеме среды они не будут. Только в местах упаривания воды (в отложениях на стенке, в прикипевшем к стенке шламе и т. п.) и в зоне кризиса кипения возможно достижение насыщения и выпадение легкорастворимых соединений.
|
|
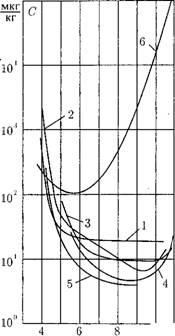
Растворимость в воде продуктов коррозии. В питательной воде содержится заметное количество различных продуктов коррозии конструкционных материалов. Наиболее важную роль в образовании внутритрубных отложений, в интенсивности коррозии играет магнетит Рез04. Растворимость магнетита в воде представлена на рис. 12.22.
|
40 |
|
20 |
|
10 |
|
450 |
|
500 |
|
°С |
|
10 рЩ |
|
Мг/кг 50 |
|
30 |
400
Рис. 12.23. Зависимость растворимо - Рис. 12.24. Растворимость NaCl в пе - сти кислородных соединений в кипя - регретом паре, щей воде (р = 7 МПа): 1 — Fe (окислительная среда); 2 — Fe (восстановительная среда); 3 — Си; 4 — Zn; 5 — Ni; 6 - AI.
Видно, что максимум растворимости магнетита приходится на температуру порядка 150°С, а затем растворимость уменьшается до температуры 300-350°С. С увеличением концентрации аммиака (при этом величина рН растет с 8,75 до 9,7) растворимость магнетита падает. В действительности, концентрация магнетита в питательной воде может быть значительно выше растворимости. Это означает, что в воде магнетит находится не только в растворенной форме, но и имеются коллоидные и грубодисперсные частицы. Растворимость других оксидов металлов в воде имеет такой же порядок, что и растворимость магнетита (рис. 12.23).
Растворимость примесей в перегретом паре докритического давления (ДКД). Растворимость веществ в воде и паре определяется физико-хими
ческими свойствами вещества и водного теплоносителя, которые, в свою очередь, зависят от температуры и давления. По мере перегрева пара плотность его уменьшается. Соответственно, «растворяющая» способность его снижается. С другой стороны, как видно из уравнения растворимости Шредера, с ростом температуры пара растворимость возрастает. В результате, как это видно из рис. 12.24, при давлении 14 и 18 МПа имеются минимумы растворимости при температуре 470- 500°С. С увеличением давления плотность пара и растворимость веществ в нем растет.
Растворимость примесей в водном теплоносителе сверхкритического давления (СКД). При сверхкритическом давлении плотность среды плавно изменяется от плотности воды до плотности пара, наиболее интенсивное (по температуре) изменение плотности происходит в ЗБТ. Поэтому растворимость веществ в жидкой фазе (до ЗБТ) при СКД аналогична растворимости в воде при ДКД, т. е. может иметь положительный или отри; дательный коэффициент растворимости. В зоне большой теплоемкости растворимость веществ из-за резкого уменьшения плотности среды снижается, а затем, при переходе в область перегретого пара может дальше снижаться или, после прохождения мини - Рис - 12.25. мума, растет (рис. 12.25). г? Шл)