КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Горение газового топлива
Ранее были изложены основные законы кинетики (законы действу - К)ндих масс и Аррениуса), позволяющие определять скорость химических
|
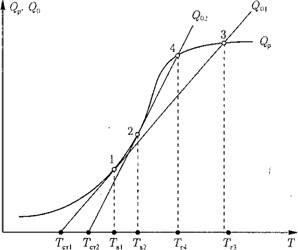
Рис. 4.3. Графическое определение температуры воспламенения Тв, горения Тг при разной интенсивности теплоотвода к стенам топки (Q02 > Q01): QP — тепловыделение в результате реакции горения; Тст — температура стен (экранов) топки. |
Реакций. В основе этих реакций лежат стехиометрические соотношения молекул исходных и конечных продуктов. Экспериментально установлено, что скорости протекания реакций существенно превышают их расчетные значения, полученные с применением закона действующих масс и закона Аррениуса. В действительности, реакции в вещестах, находящихся в парогазовом состоянии, происходят чаще не между исходными молекулами горючего и окислителя, а через ряд промежуточных стадий, в которых вместе с молекулами участвуют активные осколки молекул — радикалы и атомы, имеющие свободные связи Н, ОН, О, СН и др. При этом переход от исходных веществ к конечным продуктам происходит через ряд промежуточных реакций, протекающих с большой скоростью, так как они обладают низкой энергией активации. Такие реакции, отличительной особенностью которых является огромная скорость их протекания, получили название цепных.
При горении газов протекают разветвленные реакции, в процессе которых один активный центр порождает два или большее число новых активных центров. Теорию цепных реакций разработал академик Н. Н. Семенов. Согласно этой теории цепная разветвленная реакция включает следующие процессы: зарождение цепей — образование активных частиц из исходно
го продукта; разветвление цепей — процесс, при котором одна активная частица, реагируя с исходными, вызывает образование двух или нескольких новых активных частиц; по мере убывания горючих компонентов реакция замедляется, наступает обрыв цепей и реакция вырождается — горение прекращается. Началу реакции между веществами предшествует период накопления активных центров реакции в виде заряженных частиц за счет разрушения части исходных молекул другими, обладающими большими энергиями движения, выше энергии связи атомов в молекуле. Этот период называют периодом индукции. При высокой температуре вступающих в реакцию веществ период индукции занимает от долей секунды до 1-2 секунд.
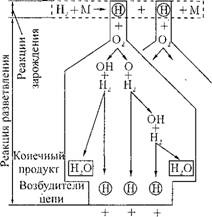
Рассмотрим механизм цепной разветвленной реакции на примере горения водорода (рис. 4.4). Из цикла цепной реакции следует, что наряду с образованием конечного продукта Н20 увеличивается число активных частиц — возбудителей цепи Н (на один вступивший в реакцию активный атом водорода после первого цикла образуется 3 атома водорода, после второго цикла — 9, после третьего — 27 и т. д.), что приводит к дальнейшему лавинообразному ускорению реакции. В реальных процессах одновременно с лавинообразным ускорением образования активных центров часть их по ряду причин при контакте со стенками сосуда, друг с другом погибает, что ведет к постепенному снижению скорости нарастания реакции и переходу ее в установившееся состояние, если имеет место постоянный подвод кислорода и водорода в зону реакции.
Горение газового топлива в смеси с воздухом идет с очень большой скоростью (готовая смесь метана с воздухом объемом 10 м3 сгорает за 0,1 с). Поэтому интенсивность сжигания природного газа в топках паровых котлов 0пределяется скоростью его смешения с воздухом в горелочном устройстве.
|
|
|
О, о, о, /ч / / |
|
И т. д. Рис. 4.4. Цикл ценной реакции горения водорода: О ~ возбудитель цепной реакции; □ — конечный продукт. |
В турбулентном потоке горючей смеси метана с воздухом скорость Распространения пламени С/„л, м/с, определяется турбулентной диффузией
где wrop — скорость воздуха на выходе из горелки, м/с; Тг — расчетная температура газовой среды, °К; п = 0,6 - т - 1,65 — показатель степени, изменяется в зависимости от состава горючей смеси и скорости потока, Для промышленных горелок, сжигающих природный газ; значение п близко к единице; £т = 0,25 - 0,3 — степень турбулентности потока воздуха. В итоге скорость распространения газового пламени обычно составляет С/пл =8-12 м/с.
Трудность обеспечения полного смешения расхода газа с воздухом за короткий промежуток времени связан с большим различием объемных расходов газа и воздуха — на сжигание 1 м3 газа требуется 10 м3 воздуха. Для полноты перемешивания приходится вводить газ в поток воздуха внутри горелки большим количеством мелких струй малого диаметра и с большой скоростью. Воздушный поток также сильно турбулизуется в специальных завихривающих устройствах.