КОТЕЛЬНЫЕ УСТАНОВКИ И ПАРОГЕНЕРАТОРЫ
Основы кинетики химических реакций
Процесс горения характеризуется быстрым протеканием реакций окисления горючих элементов топлива кислородом воздуха, при котором имеет место значительное тепловыделение и создается высокий уровень температуры. Реакции с выделением теплоты называют экзотермическими. Преимущественное тепловыделение при горении топлив определяется содержанием в топливе углерода. Горение углерода в основном характеризуется протеканием трех химических реакций:
— полное окисление углерода кислородом с образованием диоксида углерода
TOC o "1-3" h z С + 02 = С02 + 409,1 МДж/моль, (4.1)
— частичное окисление с выходом монооксида углерода
2С + 02 = 2СО + 2 • 123,3 МДж/моль, (4.2)
— доокисление монооксида до диоксида в объеме около поверхности горения
2СО + 02 - 2С02 + 2 • 285, 8 МДж/моль. (4.3)
Реакции по уравнениям (4.1) и (4.2) являются гетерогенными, так как в реакции участвуют горючее и окислитель, находящиеся в разном фазовом состоянии (твердое горючее и газообразный окислитель — кислород). Реакция по уравнению (4.3) относится к гомогенной, так как здесь оба вещества, вступающие в реакцию, являются газообразными (возможны гомогенные реакции веществ в жидком состоянии).
|
109 |
|
(4.4) |
|
(4.5) |
4.1. ОСНОВЫ КИНЕТИКИ ХИМИЧЕСКИХ РЕАКЦИЙ
В условиях высоких температур в ядре факела могут протекать реакции с поглощением тепла. Они являются эндотермическими. К ним, например, оТносятся реакция образования оксидов азота:
N2 4- 02 = 2NO - 180 кДж/моль
Или восстановление диоксида углерода на раскаленной поверхности углерода при недостатке кислорода:
С + С02 = 2СО - 162,5 кДж/моль.
Реакция является химически обратимой, если она может идти как в прямом, так и в обратном направлении, однако внешне условия для протекания реакции в том или другом направлении могут существенно отличаться. Так, реакция образования окислов азота имеет место только в зоне весьма высоких температур, а обратная реакция их разложения на газообразные кислород и азот протекает в земной атмосфере под действием солнечной радиации. При горении топлива в топочных камерах скорость прямого процесса окисления горючих кислородом несоизмеримо больше скорости обратного, поэтому химическое равновесие этих реакций смещено в сторону образования конечных продуктов, и в указанных условиях эти реакции можно считать необратимыми.
|
(4.6) |
Однако всегда по мере роста концентрации продуктов реакции и температуры в зоне горения находится в равновесии с конечными продуктами какое-то количество исходных веществ. Этот процесс связан с термической диссоциацией части образовавшихся продуктов сгорания. В топочных камерах при температуре горения выше 1 600°С подвергаются термической диссоциации в заметном количестве диоксид углерода СО2 и водяные пары Н20:
2С02 ^ 2СО 4- 02 2Н20^2Н24-02.
Таким образом, в зоне высоких температур горения всегда останется небольшое количество СО, Н2 и О2, догорание которых возможно при более низких температурах.
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимают массовое количество вещества, реагирующее в единице объема и в единицу времени. Скорость реакции в этом случае измеряют по изменению концентрации одного из реагирующих веществ. Например, в реакции (4.3) средняя скорость реакции гїїр, моль/(м3-с), промежуток времени Дт, с, имеет выражение
|
|
(4.7)
Где АС со — изменение концентрации СО в объеме, моль/м3. Скорость гетерогенной реакции (4.1) и (4.2) Ks, г/(м2-с), выражается количеством углерода Ад, г, прореагировавшим с кислородом на единице поверхности контакта с окислителем S, м2, в единицу времени Ат, с:
- - цгЬ-у (4-8>
Скорости реакций подчиняются закону действующих масс, согласно которому в однородной среде при постоянной температуре в каждый момент времени скорость реакции пропорциональна произведению концентраций реагирующих веществ с учетом числа молей. Так, для уравнения (4.3) скорость реакции составит
— р^со
Здесь Кр — константа скорости реакции, зависящая от температуры и химической природы реагирующих веществ.
В условиях гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции на основе закона действующих масс будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива:
Ks =КрСп0°*. (4.10)
Здесь Cq0,8 — концентрация кислорода у поверхности топлива. При неизменной концентрации реагирующих веществ во времени (постоянный подвод топлива и окислителя в зону горения) скорость реакции зависит от константы скорости реакции Кр, 1/с, значение которой выражается законом Аррениуса:
Кр = /<0е-Е/ят, (4.11)
|
Wp = KpC2coC о2. (4.9) |
Где Ко — предэкспоненциальный множитель, 1/с; Е — энергия активации, кДж/моль; R — универсальная газовая постоянная, кДж/моль-К); Т — абсолютная температура процесса, °К. Величины Кр и Е называются кинетическими константами реакции, они определяют реакционные свойства топлива. Химическая реакция может происходить при столкновении молекул, вступающих в реакцию веществ. Если бы все столкновения приводили к реакциям, то горение происходило бы с огромной скоростью и константа скорости равнялась бы Ко - В действительности, реакция может произойти только в том случае, когда за счет энергии соударения произойдет разрушение старых молекулярных связей и образовавшиеся осколки молекул (заряженные радикалы) могут перегруппироваться и создать молекулы новых веществ.
К»
Энергия, достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации Е. Так, при горении кокса по реакции (4.1) энергия активации зависит от вида кокса: для кокса бурого угля Е =92-105, для кокса каменных углей — 117-134, для антрацита - 147 МДж/моль. В результате число молекул Ne, обладающих необходимым уровнем энергии Е, определяется статистическим законом Максвелла - Бол ьцмана:
NE = N0e~E/RT, (4.12)
|
|
Где No — полное число молекул в единице объема. Энергия активации зависит не только от величины внутриатомных связей в молекулах, но и от того, в каком состоянии находятся вступающие в реакцию вещества. При высоких температурах в зоне реакции за счет диссоциации молекул с более слабыми внутренними связями накапливается определенное количество заряженных частиц (радикалов) типа ОН", Н+, О2", которые легко вступают в промежуточные реакции с исходными молекулами (такие реакции имеют низкие значения Е) и способствуют ускорению реакций горения.
|
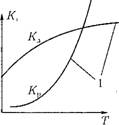
Рис. 4.1. Кинетические характеристики процесса горения: а — зависимость константы реакции горения Кр и диффузионного массообмена Ка от температуры; б — изменение скорости реакции гир от энергии активации Е в — изменение скорости Реакции при повышении концентрации горючего вещества (7гор в смеси с воздухом; НП, ВП — нижний и верхний предел концентрации. |
На рис. 4.1 показана зависимость константы скорости Кр и скорости Реакции шр от определяющих факторов. Рост скорости химической реакции с температурой на известном уровне тормозится аэродинамическим фактором — возможностью доставки в зону горения окислителя (кислорода), определяемого скоростью диффузионного массообмена Кл, который слабо зависит от температуры (рис. 4.1, л). Повышение энергии активации
вступающих в реакцию веществ требует больше энергетических затрат на каждый акт реакции, что ведет к торможению скорости (рис. 4.1,6).
В топочных устройствах происходит постоянная подача топлива и окислителя в зону горения, и, следовательно, в ядре горения сохраняется практически постоянная концентрация реагирующих веществ во времени. В этих условиях максимальная скорость реакции может быть достигнута при соотношении концентраций исходных веществ, близком к стехиомет - рическому С°0р, когда в результате реакции не остается избытка любого из них (рис. 4.1, в). При избытке горючего (богатая смесь) или при малой его концентрации (бедная смесь) скорость реакции снижается ввиду уменьшения тепловыделения на единицу объема. Как видно, существует нижний предел концентраций горючего (НП), ниже которого горение становится невозможным, и верхний предел (ВП), когда дальнейшее увеличение концентрации горючего в смеси также прекращает горение. Во всем диапазоне
Концентраций между этими пределами горение возможно. При сгорании горючей смеси в замкнутом объеме и отсутствии отвода теплоты во вне тепловыделение в процессе реакции передается продуктам сгорания и приводит к максимальному повыщению их температуры. При этом условии имеет место теоретическая (адиабатная) температура горения Ттеор = Та. Наивысшее ее значение достигается при подводе окислителя в строгом соответствии с химической формулой (при сте- хиометрическом соотношении горючего и окислителя). Эту температуру часто называют жаропроизводительно - стыо топлива.
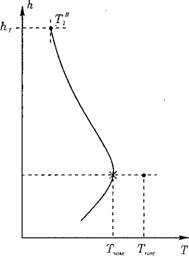
В топочных устройствах всегда имеет место отвод теплоты из зоны реакции к поверхностям нагрева. С повышением температуры в зоне основного горения увеличивается и отвод теплоты, далее по мере выгорания топлива тепловыделение снижается, а вместе с ним происходит спад температуры продуктов сгорания, так как теп - лоотвод сохраняется достаточно высоким (рис. 4.2).
|
H- |
|
Рис. 4.2. Изменение температуры газов по высоте топки h: hrop — высота расположения горелок; /гг — высота топки. |
Температура смеси, начиная с которой система способна к самоускорению реакции до устойчивого горения, называется температурой воспла-
мнения. Эта величина не является постоянной для реагирующих веществ и зависит от условий отвода тепла из зоны реакции. Тепловыделение в ходе реакции горения топлива (при постоянной концентрации реагирующих веществ) определяется скоростью реакции в данных условиях и теплотой
Горения топлива: __
Qp = Ks-Q№r, (4.13)
Где Ks — скорость реакции по сгорающему топливу, кг/(м2-с), согласно (4.8); Qn — теплота горения топлива, кДж/кг.
Из рис. 4.1, а видно, что скорость реакции Ks увеличивается с ростом температуры, а по (4.10) зависит еще от концентрации кислорода на поверхности горения. Последняя, в свою очередь, зависит от значения констант диффузионного массообмена и химической реакции на поверхности топлива. При этом в области низких температур скорость реакции ограничивается значением константы Кр, а при высоких — тормозится условиями массообмена у поверхности топлива, т. е. значением константы Кд. В итоге зависимость Ks = /(Г) имеет перегиб (см. рис. 4.1, а).
Теплоотвод из зоны реакции в окружающую среду (к теплово сприни - мающим поверхностям) выражается формулой
Qo = aFCT(Tp — Тст), (4.14)
Где а — коэффициент теплоотдачи, кВт/(м2-К); FCT — настенная тепло - воспринимающая поверхность, м2; Тр, Тсх — температуры в зоне реакции и у поверхности стен, °К. Из (4.14) следует, что при постоянстве условий отвода тепла из зоны реакции (а = const) теплоотвод изменяется линейно в зависимости от разности температур (Тр - Тст). На рис. 4.3 показан характер изменения значений Qp и Qo от температуры. Точка 1 касания кривой Qp и линии теплоотвода Qo соответствует температуре воспламенения Тв, так как при любом отклонении от нее значение Qp > Qo и происходит саморазогрев горючей смеси и рост тепловыделения за счет реакций окисления. Точка пересечения 3 кривой Qp и линии Qo характеризует наивысшее устойчивое тепловыделение, когда Qp — Qo, а соответствующая температура — температура горения Тгз. Как видно на рис. 4.3, чем интенсивнее теплоотвод из зоны горения (круче наклон линии отвода 2-4, выше Тст2, так как oi2 > осі), тем выше температура воспламенения топлива Тв2, и ниже температура горения Тг4.