Кинетическая и диффузионная области горения
Из рассмотрения механизма горения твердого и жидкого топлива следует, что общая скорость горения определяется не только скоростью собственно химических реакций, но и подводом кислорода к зоне реагирования за счет турбулентной и молекулярной диффузии. Для расчета этого комплексного процесса используют следующую модель горения (рис. 4.7).
Горящая частица считается окруженной пограничной пленкой, в пределах которой происходит догорание окиси углерода, а перекос вещества осуществляется только за счет молекулярной диффузии. В пределах пленки происходит изменение концентраций веществ и температуры. За ее пределами в основном потоке, окружающем частицу, имеет место интенсивный турбулентный массоперенос. В связи с этим основной поток считается однородным, и в нем отсутствуют градиенты температур и концентраций. В результате можно принять, что концентрации кислорода в объеме основного потока С^ и на поверх-
Ности пограничной пленки равны.
Количество кислорода, диффундирующего через пограничную пленку к единице поверхности частицы, определяется законом Фика
Где ад=£)/6— коэффициент массообмена, характеризующий скорость переноса вещества сквозь слой толщиной б, м/с; D — коэффициент молекулярной диффузии, м2/с.
Максимальный подвод кислорода к поверхности через пограничный слой будет наблюдаться, если С™ = 0. Тогда
(*«) =« С??.
4 S' мачс д
Примем для упрощения решения задачи условие, что весь диффундирующий кислород реагирует на поверхности частицы. Тогда скорость химической реакции на единице поверхности, определяемая по расходу кислорода, выражается согласно (4.5)
Kl = kC™. (4.16)
Максимальная скорость реагирования будет иметь место, когда =С°Гf:
Ui Уз
(Кр) =kCg.
V я'макс Us
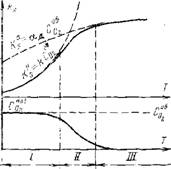
На рис. 4.8 показан характер изменения максимальных значений скорости (К) макс и {Ломаке. Если учесть, что расход кислорода в реакции на поверхности должен быть равен значению подвода кислорода через пограничную пленку, т. е. KRs=K >s=Ks, то, решая совместно уравнения (4.15) и (4.16), получаем:
(4.17)
К _____________ у W)6
Яд + k — "прЬо,-
По своей структуре выражение (4.17) подобно обычному кинетическому уравнению, в котором константа скорости реакции k заменена приведенным коэффициентом кщ,, который учитывает как реакционные свойства горючего, так и условия достазки окислителя к поверхности реагирования.
Если диффузионный массообмен относительно слабо зависит от температуры (ад.— '-'Г0'5), то скорость химической реакции на
|
|
|
Рис, 4.8. Области горения частицы постоянного размера и изменения концентрации кислорода у поверхности. 1—111 — области горения соответственно кинетическая, переходная, диффузионная. |
Поверхности a _
Ся температурой. Характер изме
|
Об |
|
Тогда |
|
(4.18) |
Нения максимальных скоростей диффузионного подвода кислорода к поверхности и скорости его поглощения на ней (рис. 4.8) позволяет выделить две основные области горения коксовых частиц. При относительно невысоких температурах (для коксовых частиц менее 1000°С) реакция на поверхности протекает достаточно медленно, и потребление кислорода во много раз меньше возможности его доставки к поверхности, т. е. k<gaд. В этом слу-
У-ЛОВ
Чае kmp^sJi и C0i
K, = kCnr
И общая скорость реакции ограничена кинетикой химического реагирования на поверхности. Эта температурная область реакций называется кинетической областью горения. Здесь процесс горения не зависит от условий подвода кислорода.
При высоких температурах процесса (выше 1400°С) за счет своего быстрого возрастания константа скорости реакции на поверхности значительно превосходит максимальную скорость поступления кислорода к поверхности, которая слабо изменяется с температурой. Тогда и общая скорость реакции определяется условием подвода кислорода
(4.19)
В этой зоне, несмотря на рост температуры, скорость реакции изменяется медленно. Доставляемый диффузией к поверхности кислород мгновенно вступает в реакцию, в результате чего его концентрация у поверхности становится практически равной нулю. Реакция могла бы идти со значительно большей скоростью, но она сдерживается недостаточным подводом кислорода. Эта температурная область реакции называется диффузионной областью горения. В условиях нехватки кислорода у поверхности получает развитие реакция восстановления СОг до СО на раскаленной поверхности углерода, а диффундирующий кислород полностью перехватывается в пограничной пленке газообразным СО, где и происходит окисление до двуокиси углерода СОг.
В этой области скорость горения увеличивается с ростом скорости обдувания частиц и уменьшением их размера.
В зоне промежуточных температур (3000— 1400°С) скорость химической реакции на поверхности становится соизмеримой со скоростью доставки кислорода и тогда общая скорость реакции определяется обоими процессами. Эта зона называется промежуточной областью горения. Ее расположение по шкале
^омера коксовых ча - размер частицы, тем при высокой температуре начинается переходная область.
Воспламенение любого топлива начинается при относительно низких температурах и в условиях достаточного количества кислорода, т. е. в кинетической области. По мере увеличения температуры быстро растет расход кислорода в зоне реакции и процесс через промежуточную область переходит в диффузионную. Завершение горения обычно находится в глубоко диффузионной области, когда остаточные концентрации окислителя оказываются весьма низкими, что значительно тормозит выгорание оставшегося топлива [72].