Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
СОЕДИНЕНИЯ ФТОРА
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
Свободный фтор F2 представляет собой почти бесцветный (слегка зеленовато-желтый) газ, имеющий при нормальных условиях плотность 1,696 г/л. Температура плавления фтора —219,6°, температура кипения (при 760 мм рт. ст.), —188,1°, критическая температура —129°, критическое давление 55 ат. Давление насыщенного пара жидкого фтора в интервале от —219,6° (1,7 мм рт. ст.) До —183,7° (1220 мм рт. ст.) можно вычислить по формуле: Lg Р = 7,08718 - 357,2587,_| - 1,3155 • 10,3Г-8
Фтор является самым электроотрицательным элементом. Потенциал нормального электрода для фтора равен 2,85 в. Фтор обладает чрезвычайно большой реакционной способностью и соединяется непосредственно со всеми элементами, за исключением инертных газов и азота. Вследствие образования плотной защитной пленки нелетучего фторида некоторые металлы (железо, медь, магний, никель) в отсутствие воды весьма устойчивы против действия фтора
Фтор энергично реагирует с большинством химических соединений других элементов, а также почти со всеми органическими веществами. С окисью и двуокисью углерода фтор не взаимодействует. Воду он разлагает:
F2 + Н20 = 2HF + </202
По этой реакции предложено осуществлять конверсию фтора перегретым выше 260° водяным паром во фтористый водород 2. При действии фтора на воду при обычной температуре вытесняемые атомы кислорода частично окисляют воду до Н202 и фтор до окиси фтора F20; окись фтора — сильно ядовитый бесцветный газ с запахом, похожим на запах озона. Известны и другие фториды кислорода 3>4.
Трифторид хлора CIF3 — при обычных условиях газ, медленно гидролизуется водой с образованием HF, С12, 02, СЮ2, C102F, C1F, CIO3F, количества которых зависят от соотношения C1F3:H205-6.
ТАБЛИЦА 86
|
Свойства насыщенного пара HF
* С учетом 6,15 ккал/моль '. Фактора ассоциации; для иеассоциироваииого |
|
/ |
|||||||||
|
/ |
|||||||||
|
/ |
|||||||||
|
T |
|||||||||
|
/ |
/ |
||||||||
|
|
|||||||||
|
■ГТТ |
> |
|
100 |
|
80 |
|
60 |
|
60 -40 -20 0 Температура, °С |
|
20 |
|
™ в 500 «»■ S 400 * <и Э 1200 I Il 10 |
|
->300 |
|
'О |
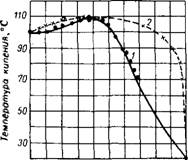
Средний молекулярный вес линия) и давление иасыщеи- (пуиктириая линия) фтористого водорода.
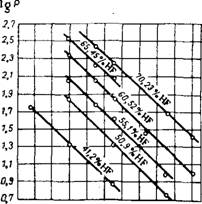
Состоянии, а также в водных растворах молекулы HF ассоциированы8-9 (рис. 313). Для температур от Одо 105° давление насыщенного пара (табл. 86) HF (в мм рт. ст.) Вычисляется10 по формуле:
Lg Р = 8,38 - 1952,6/(355,5 -F T)->
|
Фтористый водород HF бесцветен, кипит (при 760 мм рт. ст.) При 19,9°, плавится при —83,1°; критические точки7: температура 188 ±3°, давление 66,2 ± 3,5 кгс/см2, плотность 0,29 ± 0,03 г)см3. 4 В газообразном, в жидком |
|
Рис. 313. (сплошная иого пара |
|
При температуре кипения. Жидкий энергичным растворителем. В нем хорошо растворяются фториды щелочных металлов, несколько в меньшей мере фториды щелочноземельных и других металлов. Растворенная в нем вода становится сильным электролитом вследствие диссоциации по схеме |
Плотность жидкого фтористого водорода убывает почти прямолинейно от 1,21 г/см3 при температуре плавления до 0,0959 г/см3 фтористый водород является
|
■2hf |
|
Н„0 |
H, o+ + hf:
В основе которой, как и при диссоциации других электролитов в жидком фтористом водороде, лежит реакция п:
2HF Н+ + HFg
Безводный фтористый водород является более сильной кислотой, чем в водных растворах, диссоциация в которых идет по той же схеме (HF^H+ + F~ и F~ + HF ^ HF2)1Z- С фторидами щелочных металлов HF образует кристаллические соединения типа MF-nHF; например, для KF п = 2, 3 и 4 13.
|
30 |
|
Ю 70 30 41 |
|
HF й кислоте. % |
|
Рис. 314. Концентрация HF В газовой фазе над плавиковой кислотой. |
|
2,8 2.9 3,0 3,1 3,2 3,3 3,4 3,5 3.S 3.7 3,8 4--Ю8 |
|
Рис. 315. Давление пара HF (Р, мм рт. ст.) Иад плавиковой кислотой разных концентраций. |
|
F |
|
Ё |
|
I |
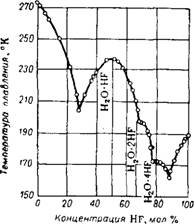
Фтористый водород хорошо растворим в воде; его водные растворы называют фтористоводородной или плавиковой кислотой. Равновесные концентрации HF в газовой фазе над плавиковой кислотой приведены на рис. 314 14 и 315 15.
О давлении пара Н20 в системе HF—Н20 и давлении HF и Н20 в системе HF—H2S04—Н20 см. 15>16.
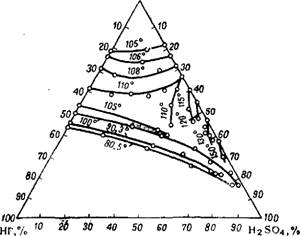
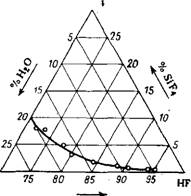
Температуры замерзания плавиковой кислоты приведены на рис. 316 (в присутствии примеси H2S04 и H2SiF6 см.17). Температуры кипения в системе HF—Н20 и равновесные составы пара при атмосферном давлении приведены на рис. 317. Эти данные относятся к растворам плавиковой кислоты, содержащим 0,1—1,8%'
H2SiF6. Как видно из диаграммы, в системе HF—Н20 имеется азеотропная смесь, содержащая 37,5% HF и кипящая при 109° (760 мм рт. ст.)18. По другим данным19, составы азеотропных смесей и точки их кипения: 43,2% HF и 111° или 35,4% HF и 120°; такие расхождения, очевидно, вызваны трудностью очистки плавиковой кислоты от H2SiF6. Более точным, вероятно, является состав азеотропной смеси с концентрацией HF 38,26%, кипящей при 112° под давлением 750,2 мм рт. стЛ20. На рис. 318 и 319 приведены
|
0 20 40 60 80 100 Н20, HF, °/< Рис. 317. Температуры кипения и составы пара в системе HF—Н20 при 760 мм рт. ст.: / — состав жидкости; 2 —состав пара. |
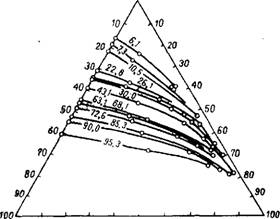
Температуры кипения и составы пара тройных смесей HF— —H2S04—Н20 в области концентраций, имеющих практическое значение для получения безводного фтористого водорода.
Сухой фтористый водород не реагирует с большинством элементов и их окислов, но энергично вступает в реакции в присутствии влаги. Плавиковая кислота разрушает стекло и силикаты, так как легко вступает во взаимодействие с окисью кремния: 4HF + Si02 = SiF4+2H20. Некоторые металлы, например свинец и Медь, относительно устойчивы в плавиковой кислоте вследствие защитного действия пленки продуктов реакции. Более устойчивыми являются резина, эбонит и некоторые пластмассы.
|
Рис. 316. Диаграмма плавкости системы HF—Н20. |
Плавиковая кислота растворяет клетчатку и потому разрушает кожу, вызывая ожоги. Даже ожоги слабой кислотой, вначале не замеченные, могут вызвгть глубокое поражение через несколько часов. Поэтому обращение с плавиковой кислотой и фтористым водородом требует особой осторожности.
|
Рис. 318. Температура кипения в системе HF—H2S04—Н80 при атмосферном давлении. |
|
Рис. 319. Содержание HF (в %) в паре иад кипящими растворами в системе HF—H2S04—Н20 при атмосферном давлении. |
|
Ю го зо 40 во во 70 во ао HP, % HjSc>4 |
Кислые фториды щелочных металлов типа MHF2 являются более слабыми кислотами, чем HF, а соединения других металлов, например A1F3 • 3HF или H3A1F6, сильнее, чем HF. Бифторид натрия NaHF2 имеет плотность 2,08 г/см3-, растворимость в воде при €° 2,28%, при 40° 4,92% « Давление диссоциации NaHF2 (в мм рт. ст.) определяется по формуле22: lg Р = —3830/7 + 9,97 или (в ат для интервала 273—371° К) по формуле23: 1пР =
=—3940/7+6,677. NaF легко поглощает HF из разбавленного газа при 100° и выделяет его в виде концентрированного HF при 250°. Бифторид калия KHF2 имеет плотность 2,35 Г/см3, существует в двух формах с температурой перехода 195—196°. Давление диссоциации KHF2 (в мм рт. ст.) Определяется по формуле: lg Р=—4000/7 + 8,574. Насыщенный водный раствор содержит приО0—18,63%, при 100°— 50,5% KHF2. В системе KF— HF—Н20 21 образуются поли- гидрофториды калия KF • 4HF, KF-3HF, 2KF-5HF, KF-2HF, идентичные двойным соединениям в системе KF—HF
В системе NH4F—HF образуются соединения NH3 • nHF, где п — 2, 3 и 424. О парциальном давлении NH3 и HF в этой системе см.25. На рис. 320 приведены изотермы растворимости в системе NH4F—NH4HF2—Н20 2б. Эвтонический раствор в системе NH4HF2—NH4C1—Н20 при 25° содержит 36,75% NH4HF2, 10,51%' NH4C1 и 52,74% Н2027-28.
При взаимодействии HF с S03 или HS03C1 образуется фторсульфоновая кислота HS03F:
S03 + HF = HS03F HSO3CI + HF = HSO3F + HC1
|
80 |
|
60 |
|
40 |
|
20 |
|
20 40 Концентрация NH4F, Бес. % |
|
60 |
|
Рис. 320. Изотермы растворимости в системе NH4F—NH4HF2—Н20 при 0, 16, 25, 50 и 75°. |
|
Ц. а Я Z § О. Е Г 3- » 5 |
Фторсульфоновая кислота — бесцветная жидкость с плотностью при 18° 1,740 г/см3, замерзает при —87,3°, кипит при 162,6°. Безводная фторсульфоновая кислота диссоциирует на ионы Н+ и S03F_ и лишь в небольшой степени на HSO3 и F-, а также на H2F+ и S206F". Хорошо растворяет большинство фторидов1-29.
Фторид натрия NaF имеет плотность 2,79 г/см3 плавится при 995°, выше температуры плавления имеет значительную летучесть30. Насыщенный водный раствор содержит при 0° 3,95%, при 94° 4,73% NaF. Теплота растворения NaF в воде при 25° 0,213 ккал/моль. При хранении фтористый натрий слеживается (фториды щелочных металлов, в том числе и NaF, гигроскопичны).
Фторид калия KF имеет плотность 2,48 г/см3, плавится при 856°. В отличие от NaF хорошо растворим в воде: насыщенный раствор содержит при 20° 47,75%, при 100° 59,83%, при 140° 60,5%, при 500° 71% KF. Из водных растворов выделяются кристаллогидраты: KF • 4Н20 (от —21,8 до 17,7°), KF • 2Н20 (17,7-45°); выше 45° кристаллизуется безводный KF. О системах NaF—NaOH и KF—К. ОН см.31, а о системах NaF—KF и др.32 (в системе NaF—KF эвтектика находится при 710°, 60% KF).
Фторид аммония NH4F имеет плотность 1,315 г/см3, возгоняется без плавления. Насыщенный водный раствор содержит при 20° 45% NH4F. Ниже —16,8° кристаллизуется NH4F • Н20. Фторид аммония является единственным неорганическим соединением, для которого обнаружены смешанные кристаллы со льдом; они содержат до 10% NH4F 33-35.
Фториды щелочноземельных металлов имеют следующую растворимость в воде при 18° (в г/л) MgF2 —0,0874, SrF2 — 0,1173, BaF2— 1,605. Произведение растворимости CaF2 при 18° 3,4- 10~п; при 18° и рН = 7 растворимость CaF2 равна 0,000205 г-мол/л36. Фторид кальция имеет плотность 3,18 г/см3, плавится при 1418°31. Фторид магния имеет плотность 3,0 г/см3, температуру плавления 1396° (по другим данным 38 1256°). Выше 900° MgF2 интенсивно гидролизуется водяным паром38.
В системе CaF2—Si02 эвтектика находится при 1240° (47% Si02)39. О системе CaF2—СаО—Р205 см.40.
Фторид алюминия A1F3 имеет плотность 3,07 г/см3. Давление пара AIF3 при 1094° 31 мм рт. ст., при 1251° 614 мм рт. ст. и при 1294° 760 мм рт. ст. При 800—1000° (в вакууме при 650—700°) BF3 взаимодействует с алюминием, образуя монофторид (AlF)^ существующий только в газообразном состоянии и разрушающийся при
3
Конденсации;— (A1F)*—>2Al + A1F3. Полученный сухим путем безводный A1F3 в воде практически не растворим; полученный из растворов кристаллогидрат немного растворим — насыщенный раствор при 0° содержит 0,127%, при 20° 0,498%, при 50° 0,805% и при 102° 2 42% A1F3. При 20° в 10%-ном растворе HF растворяется 2,4—2,84% AIFs, а в 15% растворе HF, 2,87—3,1% AIF341. В растворах сильно гидролизован; кристаллизуется обычно в виде AIF3 • ЗН20. Известны и другие кристаллогидраты: AIF3 • 9Н20, AIF3 • 3,5Н20, A1F3 • Н20, A1F3 • 0,5Н20 Чем выше степень обезвоживания A! F3, тем меньше его гигроскопичность42.
Криолит Na3AlF6 или 3NaF • AIF3 является комплексной солью гексафторалюминиевой кислоты H3[A1F6]. Название криолит (в переводе с греческого означает «ледяной камень») дано вследствие внешнего сходства со льдом природного минерала, применяемого в технике наряду с искусственным. Криолит плавится при 1011°. Предполагают, что в расплаве криолита комплексный анион [A1F6]3~ частично диссоциирует на [A1F4]~ и F". Возможно, что этот процесс происходит и ниже точки плавления, что объясняет высокую электропроводность криолита при температурах ниже точки плавления и малую величину скачка электропроводности при его плавлении43. В системе NaF—A1F3 помимо инконгруэнтно плавящегося криолита Na3AlF6 существуют инконгруэнтно плавящийся хиолит Na5Al3Fu {5NaF • 3AIF3) и тетрафторалюминат натрия NaAIF4 (выше 480°)44.
В системе NaF—AIF3—Н20 при 25° могут существовать две твердые фазы — при концентрации NaF меньше 1,4% конгруэнтно растворяющаяся NanAl4F23 или 3Na3AlF6 • 2NaF • A1F3, а при концентрации NaF больше 1,4% инконгруэнтно растворяющийся криолит Na3AlF6 45. По другим данным46, из водных растворов выделяются кристаллогидраты криолита Na3A! F6 • 0,5Н20 и хиолита Na5Al3Fi4 • Н20. Для обезвоживания этих фторалюминатов их нужно нагревать до 300°. Вследствие образования твердых растворов в промышленной практике из водных растворов не удается получить криолит, соответствующий формуле Na3AlF6— наибольшее значение криолитового модуля (т. е. отношения NaF: A1F3) в этом случае равно 2,75—2,8 47-49. Растворимость криолита в воде при 25° равна 0,417 г, а при 16°—0,35 г в 1000 г раствора. О равновесии в системе NH4F—A1F3—Н20 см.50.
Четырехфтористый кремний SiF4 — бесцветный газ (критические температура —14,15°, давление 36,7 ат), при охлаждении переходит непосредственно в твердую фазу. Твердый возгоняется при —94,8° (под давлением 1318 мм рт. ст. плавится при —90,2°, а под давлением 1520 мм рт. ст. — при —70°). Давление сублимации твердого SiF4 (в мм рт. ст.) вычисляется по формуле: lg Р = = —6100/4,577'+ 10,382. Фторид кремния восстанавливается железом, легко реагирует с окислами металлов; хорошо поглощается водой (265 объемов на 1 объем воды), гидролизуясь при этом и образуя кремнефтористоводородную и кремневую кислоты:
3SiF4 + (П + 2)Н20 = 2H2SiF6 + Si02 • NH20
Этот процесс идет столь интенсивно, что ему не препятствует присутствие в растворе других кислот (например до 50% H2S04) 51.
Гидролиз SiF4 водяным паром при температурах до 600—800° протекает в незначительной степени.
Комплексная кремнефтористоводородная кислота H2SiFe образуется также при растворении SiF4 в плавиковой кислоте:
2HF + SiF4 H2SiFe
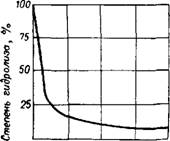
В жидком сухом фтористом водороде SiF4 не растворяется, но чем больше влаги в жидком фтористом водороде, тем больше растворимость в нем SiF4. При концентрации HF больше 96% растворимость SiF4 меньше 0,05% (рис. 321) 52. Высокая концентрация ионов водорода в растворах H2SiFe объясняется смещением вправо равновесия диссоциации HF (2HF^2H+ + 2F_) вследствие связыва -
|
|
|
SiF, |
|
HtO |
|
%HF |
|
Рис. 321. Растворимость SiF4 Во фтористоводородной кислоте при 15° (в вес. %). |
Ния F~ в комплексный ион SiFs"(2F"+ SiF4 (раств.) станта равновесия гидролиза
4Н+ + 6F~ + Si02 • пН20
К = [H+]4[F"f/[SiF6~] при 20°, по разным данным1-53, находится в пределах 4-Ю-28—1-Ю"27. Водные растворы кремнефтористоводородной кислоты содержат смесь гексафторкремневой H2SiF6 и пен - тафторкремневой HSiF5 кислот; последняя образуется вследствие 2- 54
Гидролиза иона SiF6
Кремнефтористоводородная кислота, выделяется из концентрированных водных растворов в виде бесцветных кристаллов H2SiF6- •2Н20, плавящихся при 19°. В парах H2SiF6 сильно диссоциирована на HF и SiF4. Газовая фаза, находящаяся в равновесии с растворами H2SiF5, инконгруэнтна растворам — с повышением концентрации кислоты отношение SiF4: HF в газовой фазе растет.
|
? А 6 8 10 12 14 Концентрация HiStFe,Fec% |
|
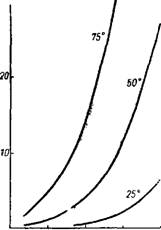
Рис. 322. Равновесные давления SiF4 И HF Над водными растворами H2SiF6 При 60 и 80р. |
|
SiFe"). Кон - |
|
SiFg- + (п + 2) Н„0 |
При температуре кипения в парах над кислотой с концентрацией H2SiF6 больше 13,3% преобладает S1F4, при меньших концентрациях— HF (по сравнению со стехиометрическим в молекуле H2SiF6)55. На рис. 322 приведены парциальные равновесные
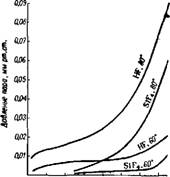
давления SiF4 и HF над растворами H2SiF6 56. По прежним данным57, общее содержание фтора в газовой фазе, находящейся в равновесии с растворами H2SiF6 концентрацией 2,31; 7,52; 9,34 и 12,69%, равно соответственно (в г/ж3): 0,0049, 0,0246, 0,0508 и 0,0914 при 50° и 0,01, 0,0408, 0,0841 и 0,1104 при 70°. О давлении паров над концентрированными растворами H2SiFe (больше 20%) см.58. По более поздним данным59, над кислотой с концентрацией 19,39%, 29,35% и 37,32% H2SiFe парциальное давление SiF4 в газовой фазе соответственно составляет (в мм рт. ст.): при 25° 0,002, 0,013 и 0,093; при 50° 0,035, 0,10 и 1,2; при 75° 0,17, 0,92 и 9,7.
Давление диссоциации Na2SiF6 на NaF и SiF4 при 480° 8 мм рт. ст., При 522° 46 мм рт. ст., при более высоких температурах оно резко возрастает, но точно не установлено (данные разных исследователей сильно расходятся; приводится, например, величина 786 мм рт. ст. при ~580 ). Растворимость Na2SiF6 в воде при 0° 0,53%, при 20° 0,66%, при 60° 1,49%, при 80° 1,95%, при 100° 2,45%. В плавиковой кислоте растворимость немного больше (при 0° в 25,6% растворе HF растворяется 1,0% Na2SiF6, при 20 в 21% растворе HF 1,07—1,22% Na2SiF6, при 50° в 26,5% растворе HF 1,42% Na2SiF6)41'60. В водных растворах Na2SiF6 гидролизуется, особенно значительно в слабых растворах (рис. 323); рН гидроли - зованного раствора составляет 3,5—4,0. Скорость разложения SiF§- в щелочном растворе по реакции
SiFg - + 40Н~ = Si02 + 6F" + 2Н20
Прямо пропорциональна концентрации SiFe" и не зависит от концентрации щелочи; константа скорости разложения (К в сек'1) может быть вычислена по формуле: lg Л' = -4248/7,-|-13,033
Кремнефторид кальция кристаллизуется в виде CaSiF6-2H20, обезвоживается выше 140°, при 365° разлагается на CaF2 и SiF4; растворимость CaSiFe в воде при 22° 105 г/л. При растворении эта соль частично гидролизуется с выделением CaF2 и SiF4; при повышении концентрации раствора гидролиз уменьшается61.
|
0 5 10 15 20 Концентрация раствора, моль/л Рис. 323. Зависимость степени гидролиза SiFg- От концентрации раствора при 11°. |
Растворимости других кремнефторидов: MgSiFe при 0° 20,85%, при 20° 23,53%; ZnSiF6 при 0° 33,76%, при 20° 35,16%. Кремнефторид бария обладает очень малой растворимостью в воде — при 25°
насыщенный водный раствор содержит 0,025% BaSiF6. О растворимости CaSiFf, • 2Н20 в водных растворах H2SiF6 см. б2.
Соединения фтора с серой63 — фториды серы (S2F2, SF2, SF4), S2F10, SFe), а также тиофториды (SOF2, SOC1F) и сульфурилфто - риды (S02F2, S02C1F, S02BrF) в обычных условиях (20° и 760 мм Рт. ст.) представляют собой бесцветные газообразные вещества или легко кипящие жидкости (S2FI0 с /Кип 29° и S02BrF с ^Кип 40°). Фторсульфинаты щелочных металлов (KS02F, NaS02F) устойчивы до 150°84. Из этой группы веществ наибольшее значение имеют гек - сафторид серы SFe и фторсульфоновая кислота HSO3F (/кип 165,5°).
Гексафторид серы имеет плотность 6,6 г/л (0°; 753,5 мм рт. ст.) 65, ^кр=45,5°, Ркр=36,8 ат86 или 37,113 ат67, возгоняется при —63,8°; является одним из наиболее инертных веществ — не разлагается при нагревании до 800°, не реагирует со щелочами, с раскаленными медью, окисью меди и обладает крайне малой растворимостью в воде (при 0,1° 0,0147 объемов, при 14,9° 0,0076 объемов на 1 объем воды) — меньше растворимости любого другого газа.
ПРИМЕНЕНИЕ
Свободный фтор используют для получения некоторых фторидов, например гексафторида урана UFe с целью разделения изотопов U235 и U238, гексафторида серы, используемого в качестве изолирующей среды в высоковольтных кабелях, конденсаторах и других электрических устройствах, фторидов хрома и др. Фтор используют также для получения фторированных невоспламеняющихся углеводородов 68-69 с высокими температурами кипения и большими плотностями, употребляемых в качестве теплоносителей. Фтор, его галогениды и окислы, в частности окись фтора F20, могут служить окислителями ракетных топлив l0<71. Фтор выпускают в баллонах под давлением ~30 ат. Более удобным в обращении и в перевозке как носитель фтора является CIF3в8'72.
Жидкий фтористый водород применяют в качестве растворителя спиртов, альдегидов, эфиров и катализатора73 для процессов полимеризации, изомеризации и алкилирования, в частности при синтезе высокооктановых моторных топлив. Для этих же целей в ряде случаев применяют и фторсульфоновую кислоту и гексафторфос - форную кислоту. Значительные количества безводного газообразного и жидкого HF применяют для получения фторзамещенных органических соединений — фторуглеродов, испольауемых в качестве теплоносителей, диэлектриков, средств огнетушенйя, термоустойчивых смазочных веществ, а также для изготовления термо - и химически стойких пластических масс — фторопластов, — в частности тетрафторэтилена (тефлона) и проч.; хлорсодержащие фторугле - роды, называемые фреонами, получили широкое распространение в качестве рабочих тел в холодильных машинах. Безводный HF используют для обработки хлоридов металлов с целью получения TiF4, ZrF4, NbFs, TaF5, VF4 и др. Высшие фториды кобальта CoF3, марганца MnF3, церия CeF4, свинца PbF4 и серебра AgF2 также служат катализаторами при фторировании углеводородов. При синтезе многих органических соединений, в частности каучуков, фармацевтических препаратов и других, в качестве катализатора используют фтористый бор; в других случаях катализаторами служат фториды сурьмы, ртути, цинка. Фтористый водород используют для извлечения урана из фосфатов и для получения фторидов урана 74—83, а плавиковая кислота может быть применена для селективного извлечения металлов из полиметаллических руд (например, ниобия и тантала из цирконпирохлоровых концентратов84).
Значительное количество солей фтора используется в металлургии. В США около 70% добываемого плавикового шпата (CaF2) расходуют в качестве флюса в мартеновских и электрических печах. В качестве флюса при производстве магниевых сплавов и при термической обработке режущего инструмента используют фторид магния. Криолит, фториды алюминия, натрия, лития применяются в производстве алюминия. Фторид бериллия и его двойная соль с фторидом натрия используются в производстве бериллия. Фториды натрия, калия, аммония входят в состав легкоплавких смесей, используемых при извлечении различных металлов из их соединений 85. Плавиковую кислоту применяют для очистки чугунных отливок от формовочного песка.
В гальванических процессах используют фторборную кислоту (при электролитическом платинировании, при изготовлении алюминиевых рефлекторов), кремнефтористоводородную кислоту (при рафинировании свинца и свинцевании, при хромировании) 85-87.
Кислые фториды, в особенности бифторид калия, используют главным образом для получения элементарного фтора и безводного фтористого водорода. Смесь бифторидов натрия и калия может быть использована в качестве флюса для пайки металлов 88. Флюсы для пайки серебром содержат фторид калия или фторборат калия89. Бифторид аммония и плавиковую кислоту используют в производстве ламп накаливания90.
Минеральные соединения фтора нашли широкое применение в промышленности строительных материалов и в керамической промышленности91. При изготовлении керамики используют фториды натрия, лития, меди, бериллия, бария, стронция, цинка, алюминия и некоторые кремнефториды. Для ускорения варки стекла и для получения опаловых и матовых стекол, непрозрачных эмалей используют плавиковый шпат и кремнефторид натрия. Он же служит минерализатором, ускоряющим клинкерообразование в производстве цемента, так же как MgF2 39 и другие фториды и кремнефториды. Для матирования стекла применяют плавиковую кислоту и фтористый аммоний. Для флюатирования поверхности каменных зданий и сооружений с целью предохранения их от преждевременного разрушения применяют кремнефториды магния и цинка80, а железобетонные сооружения можно флюатировать также 3,5—7% раствором H2SiF6 92. Сухой газообразный фтористый кремний начали применять для обработки бетонных изделий под давлением 4—6 ат. При этом в результате реакции SiF4 с Са(ОН)2 образуются CaF2 и гель кремневой кислоты — увеличиваются объемный вес, механическая прочность (почти в 2,5 раза) и химическая стойкость бетона в агрессивных средах 80. Кремнефторид натрия входит в состав кислотоупорных замазок93,94.
Чистый, бесцветный плавиковый шпат, называемый оптическим шпатом, применяют в оптических приборах. Для этой же цели используют искусственные кристаллы CaF2 и LiF85.
Из плавленого под давлением MgF2 изготовляют окошки, пропускающие ИК-излучение, и окна космических аппаратов95. Осажденный фтористый кальций особо высокой дисперсности и пористой структуры применяют при изготовлении люминофоров и в качестве теплостойкого наполнителя для резины.
В текстильном производстве используют в качестве протрав фториды сурьмы, хрома. При мытье тканей, для удаления остатков щелочи и разрушения непрореагировавших отбеливающих препаратов пользуются кремнефторидом натрия. Кремнефторид натрия используют при флотации пирита в качестве подавителя пустой породы и регулятора среды. Фторид натрия применяют в производстве протеиновых клеев; наряду с кремнефторидом натрия его используют для фторирования питьевой воды 90.
Растворимые фториды и кремнефториды ядовиты 96 — этим обусловлено их использование в качестве инсектофунгицидов и антисептиков. Фторид натрия и кремнефториды натрия и бария используют для борьбы с вредителями сахарной свеклы, льна, овощных и других культур, а также в качестве зооцидов, как и фторацетат бария. Кремнефторид натрия в смеси с цианамидом кальция (1:5 или 2 : 3) 97 используют в качестве дефолианта для предуборочного удаления листьев хлопчатника. Фториды и кремнефториды широко применяются для антисептирования древесины. Для консервирования железнодорожных шпал, телеграфных столбов и деревянных конструкций, помимо давно используемого фторида натрия, рекомендуются фториды калия, аммония, цинка; кремнефториды натрия, магния и цинка лучше проникают в древесину, чем фториды, и не дают осадка с известью и солями кальция, поэтому их можно применять для консервирования древесины, соприкасающейся со штукатуркой 98~101.
Техническую фтористоводородную кислоту, согласно ГОСТ 2567—54, выпускают с содержанием не менее 40% HF и не более 0,1% H2SiF6 и 0,05% H2S04. Тарой для нее служат эбонитовые баки, полиэтиленовые баллоны и гуммированные цистерны.
Безводный фтористый водород, согласно ГОСТ 14022—68, должен содержать (соответственно в сорте 1 и 2): не менее 99,9 и 99,8% HF и не более 0,05 и 0,08% влаги, 0,01 и 0,015% S02, 0,02 и 0,05% H2S04, 0,02 и 0,05% H2SiF6. Его перевозят в стальных цистернах, бочках и баллонах.
Кремнефтористоводородная кислота выпускается в виде водного Раствора, замутненного гелем кремневой кислоты; она содержит 8-10% H2SiFe.
К качеству технического фторида натрия, согласно ГОСТ 2871—67, предъявляются следующие требования:
Сорт I ' Сорт II
(в »/о) (в »/«>
TOC o "1-3" h z NaF, Не менее.................................................. 95,0 80,0
Na2C03, Не более.............................................. 0,5 —
Сульфаты (в пересчете на Na2S04), Не
Более.......................................................... 0,5 3
Не растворимые в воде, не Более... 2,0 —
Влага, не более............................................... 0,5 2,0
К качеству технического кремнефторида натрия, согласно ГОСТ 87—66, предъявляются следующие требования:
Сорт высший Сорт 1-й Сорт 2-й! в °/о> (в ®/о> (в »/о)
Na2SiFe, Не менее....................................... 98 95 93
Свободные кислоты (в пересчете на
НС1), не более....................................... 0,1 0,15 0,15
Влага, не более......................................... 1,0 1,0 1,0
Остаток на сите № 0063, не более 15 15 15
Фторид алюминия, согласно ГОСТ 10017—62, должен содержать (в пересчете на сухое вещество) не менее 64,5% фтора, 31,5% алюминия и не более 0,5% Si02 + Fe203, 1,3% S04; влажность не должна превышать 6,5%. При сушке продукта в печах с внутренним обогревом допускается содержание фтора не менее 61%, а влаги не более 4%. Экспортный продукт по ГОСТ 10.58—71 должен содержать в сухом веществе не менее 65% F и 31% А1 и не более 0,35% Si02 + Fe203, 0,8% S04; влажность его должна быть меньше 3,5%.
Криолит выпускают двух марок: К-1 и К-2; согласно ГОСТ 10561—63, к нему предъявляются следующие требования:
К-1 К-2 K-I К-?
1в %) (в %) (в %) (в %)
Фтор, не Менее.... 54 54 Fe203, Не Более.... 0,1 0,1
Алюминий, не менее . . 13 13 Сульфаты (в пересчете
Натрий, не Более... 30 30 иа S04), Не более . . 1,2 1.2
S102, Не Более .... 0,9 1,5 Влага, не Более.... 0,8 1,0
СЫРЬЕ
Содержание фтора в земной коре да0,08% по весу, т. е. больше, чем хлора 109.
Наиболее распространен фтор в виде содержащих фтор фосфоритов и апатитов (стр. 811). Фтор входит в состав руд некоторых металлов, природных водшз, животных и растительных организмов 13. Повышенное содержание фтора в питьевых водах вызывает заболевание эндемией — «крапчатостью» эмали зубов.
Основными видами сырья для промышленного производства фтора н его соединений являются содержащие SiF4 и HF отходящие газы заводрв, вырабатывающих фосфорные удобрения, и природный фторид кальция — плавиковый шпат или флюорит CaF2, месторождения которого имеются в Приморском крае, в Забайкалье, в Средней Азии, на Урале, в районе Амдермы и др.104.
Крупные запасы плавикового шпата находятся в США, Мексике, Канаде, а также в Испании, Франции, Италии, Англии, ФРГ — в них добывают около 97% от общего количества плавикового шпата, добываемого в капиталистическом мире. Примерные запасы плавиковошпатовых руд (с содержанием более 35% CaF2) во всех капиталистических странах на конец 1961 г. составляли 60 млн. т. В то же время запасы фтора в фосфатах оценивались В' 900—1300 млн. т, что эквивалентно 1700—2500 млн. т CaF2 105-106.
Плавиковый шпат в чистом виде бесцветен, но обычно сопровождается примесями кварца, кальцита, иногда барита, сульфидами свинца, цинка и других тяжелых металлов и окрашен в белый, зеленый, желтый, розовый, синий и фиолетовый цвета107. Особенно нежелательной примесью является кварцит, так как при производстве фторидов он связывает часть фтора в кремнефториды.
Обычно добываемый плавиковый шпат подвергают обогащению 108. Большей частью применяют комбинированные методы. В ФРГ очистку флюорита от барита производят гидромеханическим и флотационным методами, при этом получают концентрат, содержащий до 98% CaF2. В США отделяют флюорит от кальцита осаждением в тяжелых суспензиях и флотацией; вначале в тяжелой суспензии обрабатывают частицы размером 2 мм и получают концентрат с 90% CaF2, затем его размалывают до 0,2—0,3 мм и флотируют, получая продукт с 98% CaF2109.
Изучено обезвоживание пульпы флотационного концентрата в псевдоожиженном слое инертного материала при 600° — концентрат уносится газом и должен улавливаться пылеуловителями (циклонами и др.)110. При обогащении низкосортного плавикового шпата в тяжелых суспензиях (плотность 2,9 г/см3) утяжелителем служит главным образом ферросилиций, расход которого составляет 0,2—0,5 кг на 1 т руды (потери при регенерации суспензии на магнитных сепараторах)80- ш> 112. Некоторые сорта плавикового шпата могут подвергаться термическому обогащению, основанному на том, что при нагревании до 500—800° минерал растрескивается на мелкие кусочки, в то время как пустая порода не подвергается растрескиванию. После прокалки материал рассеивают.
Предложен метод химического обогащения плавикового шпата— очистка его от S102 обработкой плавиковой кислотой. Образующийся раствор H2SiFe отделяют от осадка CaF2 и подвергают гидролизу выпариванием при 600—800°. Продуктами гидролиза являются кремнегель (мельчайший белый порошок с плотностью 0,05^-0,16 г/см3 и удельной поверхностью 200 м2/г) и фтористый водород, который улавливают водой и возвращают в процесс "3-116.
Согласно ГОСТ 7618—70, плавиковый шпат выпускают следующих марок:
ФР-55, ФР-40, ФР-30, ФР-20 ФК-95А, ФК-95Б, ФК-92, ФК-85, ФК-75, ФК-65 ФГ-95А, ФГ-95Б, ФГ-92, ФГ-85, ФГ-75, ФГМ-75, ФГ-65 ФФ-97А, ФФ-97Б, ФФ-95А, ФФ-95Б, ФФ-92 ФО-95А, ФО-95Б, ФО-92, ФО-85
Буквами ФР, ФК, ФГ, ФФ и ФО обозначены, соответственно, флюорит рядовой (руда), кусковой сортированный, гравитационный концентрат, флотационный концентрат и окатыши обожженные; число указывает содержание CaF2 (%); буквами А и Б отмечено, соответственно, допускаемое пониженное и повышенное количество примеси Si02, а буквой М — мелкая разновидность. Помимо Si02 ГОСТ регламентирует содержание карбоната кальция, серы, фосфора и гранулометрический состав.