Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение пушонки (гашение извести)
Окись кальция при взаимодействии с водой гасится, образуя пушонку — гидроокись кальция:
СаО + Н20 = Са(ОН)2 + 15,176 ккал
При этом происходит значительное увеличение объема — в 2—3 раза. Процесс гидратации извести ускоряется в 1,5—2 раза при гашении слабым раствором (1—5%-ным) NaCl, СаСЬ или других электролитов 86.
Скорость гашения извести зависит от ее состава и температуры обжига и может колебаться в пределах от нескольких минут до нескольких часов. Сильно обожженная известь (при 1200° и выше) гидратируется медленно87'88. Дисперсность пушонки также уменьшается, если для получения ее применяется известь, обожженная при слишком высокой температуре.
Обычно при гашении активной, быстро гасящейся извести требуется отводить тепло реакции. При медленном гашении следует проводить процесс без отвода тепла во избежание замедления гидратации. Для получения тонкодисперсной пушонки необходим предварительный подогрев воды, применяемой для гашения.
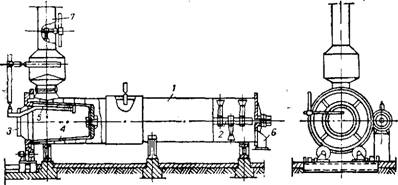
Аппарат для гашения извести представлен на рис. 43581. Иногда аппарат снабжают рубашкой для поддержания требуемой температуры и просушки слоя гашеной извести, приставшей к стенкам аппарата. Внутрь сетчатого барабана подают воду, нагретую до 85—95°. Известь гасится и рассыпается в мелкий порошок, просеи-
|
Рис. 435. Аппарат для гашення извести: 1 —барабан: 2 — вал с лопастями; 3 —загрузочная воронка; 4 — сетчатый барабан; 5 —труба для подвода воды; 5 —выгрузочное отверстие; 7 —труба для отвода водяного Яара. |
Вающийся при вращении сетчатого барабана через его стенки; она попадает в наружный барабан, передвигается к его концу лопастями вращающегося вала и выгружается. Воду дозируют так, чтобы пушонка на выходе из аппарата содержала 0,5—2% влаги. Гашение при недостатке воды протекает при более высокой температуре и приводит к усложнению процесса. Повышенное содержание влаги в пушонке (больше 2%) затрудняет ее транспортировку. Предложено ускорять гашение путем разрыхления пушонки продуванием через нее пара 89.
Для освобождения от кусочков «недопала» и «перепала» пушонку пропускают через вращающееся сито—бурат. Это сито представляет собой сетку с 64 отверстиями на 1 см2, натянутую на деревянную раму. Оно имеет форму восьмигранной усеченной пирамиды, расположенной горизонтально и вращающейся вокруг своей оси. Просеянная пушонка вылеживается в бункерах не менее 3 дней. За этот срок гашение полностью завершается, увеличивается дисперсность частиц, температура и влажность пушонкц уменьшаются, она приобретает однородный состав и может подвергнуться хлорированию.
После вылеживания в бункерах пушонка должна содержать не менее 86% Са(ОН)2, не более 7% СаСОз, 0,6—1% свободной влаги и менее 6% примесей (Si02, R203, MgO и др.) при отсутствии непогашенной окиси кальция. Обычно она содержит 90—92% Са(ОН)2, 2—4% СаСОз, 0,5—0,9% влаги и до 5,5% других примесей90. Ее плотность ~2,08 г/См3, а объемный вес колеблется от 0,4 до 1 г/см3 (обычно 0,55—0,65).
Хлорирование пушонки Теория процесса
Абсолютно сухие гидроокись кальция и хлор не вступают в реакцию; хлор только адсорбируется известью. В производственных условиях хлорированию подвергают пушонку, содержащую менее 1 % свободной влаги; применяющийся для этой цели разбавленный воздухом хлор также содержит небольшое количество влаги. Даже небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора с нейтрализацией образующихся кислот известью. Затем гидролиз продолжается за счет воды, выделяющейся при хлорировании из гидроокиси кальция, и все новые количества извести вступают в процесс; образуется ряд соединений, из которых и состоит хлорная известь (стр. 1431).
В первый период хлорирования пушонки, по-видимому, образуется смесь двуосновного гипохлорита кальция и СаС12 • Са (ОН)2- • Н20 по реакции:
5Са(ОН)2 + 2С12 = Са(СЮ), • 2Са(ОН)2 + СаС12 • Са(ОН)2 • Н20 + Н20
Основной хлорид кальция значительно менее гигроскопичен, чем хлорид кальция. Это обстоятельство облегчает удаление воды с газом и способствует образованию сыпучего, не мажущего материала. Остающаяся гигроскопическая вода присутствует в виде раствора, насыщенного Са(С10)2, СаС12 и Са(ОН)2, находящегося' в равновесии с двумя твердыми фазами — двуосновным гипохло - ритом кальция и основным хлоридом кальция. Растворимость Са(ОН)2 в присутствии Са(СЮ)2 и СаС12 весьма невелика (рис. 436) и, следовательно, содержание свободной извести в растворе, образованном гигроскопической влагой, мало. При дальнейшем хлорировании двуосновной гипохлорит кальция разрушается и переходит в менее основную соль — ЗСа(С10)2* •2Са(0Н)2-2Н20 — дветретиосновной гипохлорит кальция: . 3[Са(СЮ)2 • 2Са(ОН)2] + 2НгО = ЗСа(СЮ)2 • 2Са(ОН)2 • 2Н20 + 4Са(ОН)2
- Освобождающаяся при этом гидроокись кальция переходит в жидкую фазу и расходуется на взаимодействие с хлором: 2Са(ОН)г + 2С1г = Ca(C10)2 + СаС12 + 2H20
Но так как эта реакция протекает в растворе, насыщенном известью, гипохлоритом и хлоридом, то вновь образующиеся Са(С10)2 и СаС12 выделяются в твердую фазу в виде основных солей— СаС12-Са(0Н)2-Н20 и ЗСа(СЮ)2-2Са(0Н)2-2Н20.
|
, ю |
Переход двуосновного гипохлорита в дветретносновной сопровождается уменьшением количества жидкой фазы, так как вода входит в состав твердого кристаллогидрата. На этой стадии хлорирования получается весьма сухой, рассыпчатый продукт.
|
Ч£а(С1( |
Э),знр |
||||
|
^а(С10)2 |
2Са(ОН),-2 |
Нр |
|||
|
, Са(СЮ)22< Са(ОН)2 |
СаС1,-6а(0 |
CaClj2HjO |
|||
|
TTT^'J |
•Са(он)2-* |
|
20 |
|
10 20 30 40 Г СаС12 6 100 г PaemSopa |
|
50 |
|
60 |
Рис. 436. Изотерма растворимости в системе Са(СЮ)2—Са( ОН)2—СаС12—Н20 при 50°.
Дальнейшее хлорирование связано с разрушением дветрети - основной соли и переходом ее в нейтральный гипохлорит кальция Са(С10)2-ЗН20. После исчезновения дветретносновной соли продукт представляет собой, по-видимому, смесь нейтрального гипохлорита и основного хлорида кальция. Наличие небольшого количества гигроскопической влаги приводит при продолжении хлорирования к частичному разрушению основного хлорида с образованием тетрагидрата хлорида кальция, что увеличивает гигроскопичность продукта. Однако после исчезновения жидкой фазы поглощение хлора практически прекращается.