Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Безводный сульфит натрия
Безводный сульфит натрия весьма устойчив против окисления. При хранении в течение нескольких месяцев содержание Na2S03 в продукте практически не изменяется. Кроме того, егоперевозка дешевле, чем Na2S03 • 7Н20, так как он содержит больше S02 И Имеет больший насыпной вес (1,2—1,3, вместо 0,8—0,9 г/ж3 для Na2S03 • 7Н20).
Безводный сульфит натрия можно получить кристаллизацией из концентрированного раствора при 95—100° или плавлением Na2S04 • 7Н20. В последнем случае получается минимальное количество маточных растворов. При плавлении Na2S03 • 7Н20 получаемую кристаллическую пульпу выдерживают в обогреваемом паром реакторе в течение 30 мин для образования более крупных кристаллов, затем повышают температуру до 75—80° (так как при повышении температуры растворимость Na2S03 уменьшается) и выпускают пульпу на центрифугу. Отфугованный продукт высушивают при 75—80°. Этот метод 44, однако, не используется в промышленности вследствие его громоздкости (двойная кристаллизация, малая производительность реактора, периодичность процесса). Поэтому безводный Na2S03 получают преимущественно кристаллизацией из насыщенного раствора, приготовленного при температуре ~35°, соответствующей наибольшей растворимости соли. Раствор очищают от железа, нейтрализуя его кислотность содой и подщелачивая едким натром до содержания 25—28 г/л NaOH и отделяя шлам после отстаивания. Затем раствор нагревают при перемешивании в течение 1 ч до 95—100°, причем из него кристаллизуется около У5 части содержащегося в нем Na2S03. Кристаллическую пульпу разделяют на нутч-фильтре, который служит и сушилкой. Маточный раствор возвращают в цикл (на растворение соды), а кристаллы, после промывки на фильтре спиртом, сушат воздухом, нагретым в паровом калорифере до 80—90°. При сушке 300 кг сульфита в течение 1,5 ч выгружаемая соль содержит 0,5— 1 % влаги. Ее подвергают дополнительному досушиванию в сушилке полочного типа. Спирт применяют для ускорения сушки с целью уменьшения окисления продукта, но при добавке к нему антиокислителей (стр. 518) от промывки спиртом можно отказаться. На производство 1 т безводного сульфита натрия этим способом расходуется: 3,76 г[18] бисульфита натрия (36,6%), 0,133 т кальцинированной соды (100%), 0,185 г[19] каустической соды (100%), 76 л этилового спирта (96%), 190 кет - ч электроэнергии, 2 мгкал Пара, 300 м3 воды86.
Запатентован93 способ сушки безводного сульфита натрия воздухом в псевдоожиженном слое при температуре ниже 120°. В связи с быстрым высыханием продукта значительного образования Na2S04 не происходит.
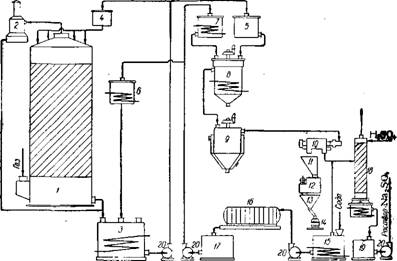
Гипрохимом разработана типовая схема производства сульфита натрия из отработанных газов контактных сернокислотных систем (рис. 162). S02 из газов извлекается в башне циркулирующим
|
Рис. 162. Схема производства безводного сульфита натрия: I — сульфитная башня; 2 — циклон-брызгоуловитель; 3 — сборник длц. сульфит-биеуль - фитного раствора; 4 — распределительный бачок для сульфит-бисульфнтйЬго створа; 5 —расходный бак для сульфит-бисульфитного раствора» 6 — питательный бак для сульфит-содового раствора; 7 — расходный бак для сульфит-содового раствора; 8 — нейтрализатор; 9 — обезвоживатель; 10 — центрифуга; }}, 13 — бункеры; 12 — автоматические весы; 14 — тара; 15 — растворитель соды; 16 — фильтрпресс; 17 — сборник фильтрованного сульфйт-содового раствора; 18 — колонна разложения; 19 — сборник раствора сульфата натрия; 20 — насос. |
Сульфит-бисульфитным раствором, избыток которого выводится из цикла и нейтрализуется сульфитно-содовым раствором при 33° в аппарате с мешалкой и паровым змеевиком. Нейтрализованный сульфитный раствор нагревается в обезвоживателе — резервуаре с мешалкой, снабженном паровой рубашкой, до 90—95°. Образующаяся сульфитная пульпа передается на центрифугу, с которой отжатые кристаллы с влажностью 3—6% выгружаются в бункер, затем поступают на автоматические весы и тарируются. Маточный раствор направляют на растворение соды. В связи с накоплением в нем сульфата натрия, часть его выводится из цикла и заменяется соответствующим количеством воды. Выводимый раствор обрабатывают в колонне разложения серной кислотой; выделяющийся при этом SO2 отводят в контактную систему, а образующийся раствор, содержащий ~25% Na2SCXj — в кремнефтористое отделение суперфосфатного цеха, где он используется взамен NaCl (стр. 1142). Степень улавливания S02 — 90%; доля S02, удаляемая в виде отводимого маточного раствора, достигает 20—23%. Переработку получаемого при абсорбции S02 раствора, т. е. нейтрализацию, обезвоживание и отжим кристаллов, можно осуществлять в аппаратах периодического действия и небольшой емкости при малой мощности установок (2—4 г/Сутки). При производительности более 10 т/сутки сульфита целесообразно осуществление процесса по непрерывной схеме.
Раствор сульфита натрия для производства безводной (и семи - водной) соли можно получать нейтрализацией бисульфита известковым молоком 94:
2NaHS03+ Са(ОН)2 = Na2S03 + CaS03 ■ 2Н20
После отделения осадка CaS03'2H20 отстаиванием или фильтрацией получается раствор, содержащий до 23% Na2S03. Во избежание потерь Na2S03 со шламом температура раствора до его отделения должна быть в пределах 25—70°, в которых растворимость Na2S03 относительно высока.
Безводный Na2S03 выделяется при смешении растворов каустической соды с концентрацией больше 35% NaOH и бисульфита с концентрацией больше 35% NaHS03 в молярном соотношении NaOH : NaHS03>2 : 1 при температуре выше 70°. Выход продукта в расчете на бисульфит натрия превышает 80%. Если содержание железа в растворах не больше 25 мг/л, то в образующемся осадке сульфита содержится 2—3 мг Fe на 100 г соли. Такое содержание железа не вызывает окрашивания продукта и не препятствует его использованию в фототехнике95.
Безводный сульфит натрия можно получать «сухим» способом, насыщая твердую соду сернистым газом. Реакция Na2C03 + S02 = Na2C03 + С02
Идет лишь в присутствии влаги, поэтому газ должен быть увлажнен (~8% Н20). Наилучшим образом процесс осуществляется в Аппарате с кипящим слоем при 120—170°. При более низких температурах образуется пиросульфит натрия (стр. 537), а выше 200° — главным образом сульфат натрия и сера (в результате разложения пиросульфита)
2Na2S205 = 2Na2S04 + S02 + S
В интервале 120—170° пиросульфит разлагается по реакции Na2S205 = Na2S03 + S02
Ч.
И получаемый продукт содержит больше 90% Na2S03 и незначиТельное количество Na2S04 (до 3%) и Na2C03 (до 8%) 96-97,
Получение бисульфита и сульфита натрия взаимодействием S02 С раствором Na2S04 Или NaCl
Делались попытки замены содовых продуктов в производстве бисульфита натрия сульфатом натрия или хлористым натрием. Взаимодействие S02 с Na2S04 идет в присутствии извести. При этом вначале образуется суспензия мелкокристаллического осадка сульфита кальция
Са(ОН)2 + S02 = CaS03 + Н20
Который при дальнейшем поглощении S02 переходит в растворимый бисульфит кальция, вступающий в реакцию с Na2SC>4 с выделением в осадок гипса. Общее уравнение процесса:
Na2S04 + Са(ОН)2 + 2S02 + 2Н20 = 2NaHS03 + CaS04 . 2Н20
'Его осуществление возможно лишь для разбавленных растворов, содержащих меньше 17% Na2S04, с получением раствора бисульфита натрия, содержащего до 15% S02. Получение же стандартного раствора бисульфита (22,5% S02) требует, чтобы в исходном растворе было не меньше 25% Na2S04, а при такой концентрации происходит загустевание реакционной массы, за* трудняющее дальнейшее ее взаимодействие с S02 и отделение осадка от раствора. Эти трудности устраняются при двухступенчатом осуществлении процесса 98. В первой стадии известково-сульфатная суспензия, содержащая в жидкой фазе 17% Na2S04, насыщается сернистым газом с отводом реакционного тепла для поддержания 30—35°. В течение 2—3 ч достигается 95—100%-ное превращение сульфата по реакциям:
Са(ОН)2 + 2S02 = Ca(HS03)2 Ca(HS03)2 + Na2S04 + 2H20 = 2NaHS03 + CaS04 • 2H20
- • Реакционная пульпа, содержащая крупнокристаллический осадок гипса, остается подвижной. Во второй стадии в пульпу, кристаллы гипса в которой являются хорошей основой для дальнейшей кристаллизации, вводят вторую порцию сульфата в количестве, рассчитанном на закрепление раствора бисульфита до концентрации 22—23% S02. Затем продолжают насыщение пульпы сернистым газом при непрерывной подаче в реактор сухой извести или пушопки (1 моль СаО на 1 моль введенного во второй порции Na2S04). Загрузка извести производится со скоростью, обеспечивающей слабокислую реакцию массы, т. е. присутствие свободной H2S03, что препятствует появлению CaS03 и ведет к образованию Ca(HS03)2 (рис. 159). Процесс завершается без загустевания пульпы. Осадок гипса может быть отделен от раствора бисульфита натрия отстаиванием и фильтрацией на вакуум-фильтрах. Впервой ступени известь может быть заменена эквимолекулярным количе
Ством сульфита кальция, являющегося отходом некоторых производств.
Способ получения сульфита натрия из поваренной соли, сернистого газа и аммиака" используется в Канаде100. В основе этого способа лежит реакция
2NaCl + (NH4)2S03 = Na2S03 + 2NH4C1
Равновесие в этой системе при 60—85° сдвинуто таким образом, что наибольшую площадь занимает поле кристаллизации Na2S03 (рис. 163). Поэтому мелкокристаллический хлористый натрий при внесении в горячий раствор сульфита аммония будет легко и в значительных количествах растворяться, а в осадок перейдет
|
|
|
2NaCl |
|
Na2S03 |
|
(NHjeSO, |
|
Рис. 163. Изотерма растворимости водной системы 2NaCl+- +(NH4)2S03 Na2S03+ + 2NH4C1 при 60°. |
|
NaCl |
|
NH.HSO Рис. 164. Изотерма раствори» мости водной системы NaCl 4- +NH4HS03 NaHS03 + +NH4C1 при 25°. |
|
?NH*C1 |
|
NH.CI |
NaHS О,
Безводный сульфит натрия. После отделения этого осадка в растворе останется хлористый аммоний. Кристаллизация NH4C1 до-, стигается насыщением раствора сернистым газом с целью перевода оставшегося сульфита в бисульфит и охлаждением раствора до25°» Как видно из рис. 164, поле кристаллизации NH4C1 при этом значительно увеличивается. Это позволяет подобрать такие концентрации раствора, при которых удается произвести кристаллизацию NH4CI. Оставшийся раствор, содержащий некоторое количество NJr14Cl и бисульфита натрия, насыщается аммиаком, причем бисульфит вновь превращается в сульфит, раствор нагревается и Вновь обрабатывается NaCl и т. д. Таким образом, можно осуществить замкнутый цикл с периодической кристаллизацией Na2S03 И
Nh4ci. ■
Конечный щелок, получаемый после кристаллизации хлористого ®Ммония, содержит приблизительно 1% NHJ, 12-13% СГ, 19% HSO^
Он насыщается аммиаком до содержания 0,5% свободного NH3, — получается так называемый исходный раствор. При оптимальных концентрациях растворов, позволяющих вести замкнутый j процесс, в исходном растворе должно содержаться 10,5% NH| (при этом в нем содержится 17—18% S03~, 4 — 5% Na+). Этот раствор обрабатывается стехиометрическим количеством NaCl. Выход Na2S03 в одном цикле составляет около 55% по отношению к S03~, содержащемуся в исходном растворе; выход NH4C1 — около 38% по отношению к связанному аммиаку.
При изучении растворимости в четверной системе NaCl— (NH4)2S03—Н20 при 20 и 60° помимо исходных компонентов были обнаружены и другие твердые фазы, вероятно твердые растворы присутствовавшего в качестве примеси Na2S04 в Na2S03101. При осуществлении циклической схемы конечный щелок (раствор после кристаллизации NH4C1) должен периодически очищаться от накапливающегося в нем сульфата (например, осаждением - S04~ хлористым кальцием).