ВЗАИМОДЕЙСТВИЕ АНТИГЕН — АНТИТЕЛО
Иммунологическая защита организма позвоночного животного от чужеродных белков и других биополимеров, именуемых в этом случае антигенами, в конечном счете сводится к взаимодействию специфических белков — антител — с антигенами. Иммунный ответ, т. е. появление антител в организме, есть результат узнавания антигенов определенными популяциями клеток. Этот процесс развивается на организменном уровне, в нем участвуют различные клеточные узнающие системы, являющиеся обучающимися в том смысле, что они приобретают память об однажды введенном антигене и отвечают на его вторичное введение усиленной выработкой антител. Эти важные процессы, имеющие непосредственное отношение к общей проблеме клеточной дифференциации, рассмотрены в § 9.11. Здесь мы остановимся на структуре антител и антигенов и их взаимодействиях, определяющих молекулярное узнавание.
Антитела (AT) представляют собой белки, относящиеся к группе иммуноглобулинов. У человека имеется пять основных классов иммуноглобулинов, обозначаемых IgG, IgM, IgA, IgD, IgE, в свою очередь разделяемых на подклассы [15]. Важнейшими являются IgG. Их молекулярный вес равен примерно 150 000, константа седиментации 75. IgM имеют молекулярный вес (9—10) - 10s, константу седиментации около 195. IgM, по - видимому, представляют собой пенгамеры IgG.
С помощью ряда химических и физико-химических методов установлена схема строения макромолекулы IgG [16, 17]. На рис. 1.1 показана схема строения IgG кролика по Портеру [15, 18]. Молекула состоит из двух тяжелых цепей, обозначаемых у,
У
B {tttLI I r"s"s~l l"s"s~1 с Y
X
"T=S+3 I—S~S—І в X, A
Рис. 1.1. Схема строения антитела IgG по Портеру.
И двух легких, обозначаемых в зависимости от типа AT к или К. Их молекулярные веса равны соответственно 53 500 ±4000 и 23800 ± 100С (кролик), а числа аминокислотных остатков 446 и 214 (последние числа относятся к миеломному белку человека IgG, первичная структура которого была полностью расшифрована [19]).
Белковые цепи в молекуле IgG связаны дисульфидными мостиками, показанными на рис. 1.1.
Структура молекулы IgG была установлена, в частности, в результате ее расщепления на отдельные полипептидные цепи иод действием различных химических агентов и протеолитиче - ской фрагментации. Схема фрагментации IgG папаином, установленная Эдельманом, показана на рис. 1.2 [15].
AT к самым различным антигенам (АГ) характеризуются принципиальным единством строения — схема, приведенная на рис. 1.1, универсальна. Исследование первичной структуры полипептидных цепей IgG показало закономерное расположение внутрицепочных S—S-связей, изображенных на рис. 1.1. Примерно на каждые 100 остатков приходится один дисульфидный
![]()
Fab ^ - - ) Fnb
J-ao ^ - / D )
(EX>
Х, Л
Рис. 1.3. Схема доменной структуры IgG по Эдельману.
Рнс. 1.2. Схема фрагментации IgG папанном по Эдельману.
Мостик, формирующий петлю, содержащую примерно 60 остатков. Такой участок с петлей, согласно предположению Эдель - мана, представляет собой компактную глобулу, названную доменом [19]. Схема доменной структуры IgG приведена на рис. 1.3.
AT к различным АГ характеризуются различиями первичной структуры. Эти различия локализованы в совершенно определенной области макромолекулы IgG — в вариабельной, или У-области. Вариабельная область занимает
Примерно половину Fab фрагментов папаинового протеолиза (см. рис. 1.2), т. е. в нее входит около половины легкой цепи и половины прилежащего участка тяжелой цепи у их N-концов. Соответствующие домены на рис. 1.3 отмечены буквой V. Первичные структуры остальных областей тяжелых и легких цепей постоянны в пределах данной группы IgG. У человека длина V-областей и-цепей варьирует от 107 до 112 остатков, длина постоянной С-области равна 107 остаткам [15].
Из сказанного следует, что именно ^-области ответственны за взаимодействие AT — АГ, поскольку специфичность AT определяется особенностями первичной структуры. Активный центр AT, в котором локализовано взаимодействие AT — АГ, должен
содержать V-область и действительно, как показано прямыми опытами, он расположен в Fab фрагментах [20]. Симметричная структура IgG, т. е. наличие двух тождественных /^-фрагментов, указывает на то, что IgG имеет два активных центра, т. е. «валентность» AT равна двум (см. стр. 23).
Антигенами являются биополимеры, прежде всего белки и полисахариды. В 1919 г. Ландштейнер открыл прекрасный способ получения искусственных синтетических АГ [21]. Метод основан на соединении диазотированных ароматических аминосоедине - ний с тирозилом белка в слабощелочном растворе. Схема реакции Ландштейнера следующая:
NH R—/ \ N=NX"
НО—/ ^—СН2—СН *
Іо
Щелочь
I
I
NH
НО—^ ^—СН2—СН - N=V СО
Таким способом можно ввести в белок в принципе любой радикал R. R-фенилазобелок можно использовать в качестве АГ и стимулировать выработку соответствующих AT.
Сопоставление иммунологических свойств радикалов R, присоединенных к белкам, и самих белков показало, что фактором, определяющим антигенную специфичность, является радикал R, а белок играет второстепенную роль. Это было доказано перекрестными реакциями. AT, полученное в результате воздействия антигена R — Б (Б — белок), реагирует с другим антигеном R — Б' (Б' — другой белок), но не реагирует с антигеном R'—Б (R' — радикал, отличный от R). Антиген R — Б дает с соответствующим AT труднорастворимый осадок. Если добавлять к системе R-антиген — R-антитело малые молекулы, содержащие ту же детерминантную группу R, например,
То реакция тормозится, а при дальнейшем повышении концентрации низкомолекулярного соединения прекращается вовсе. Такого рода малые молекулы не создают антител в организме подопытного животного и, следовательно, не являются антигенами. Однако они взаимодействуют с ранее возникшими антителами, образуя растворимые соединения. Это — гак называемое гаптеновое действие, а указанные малые молекулы называются гаптенами. Гаптены конкурируют с АГ, взаимодействуя с теми же активными областями AT. Взаимодействие подобно обычной химической реакции и подчиняется закону действия масс. АГ содержит детерминантную группу и высокомолекулярный носитель, а гаптен — только детерминантную группу. Исследование иммунохимической реакции показывает, что природные АГ содержат ряд детерминантных групп и в этом смысле поливалентны.
В дальнейшем было показано, что AT не только поливалентны в смысле наличия нескольких тождественных групп, узнающих АГ, но могут быть и полифункциональными. Установлено, что некоторые AT взаимодействуют с несколькими АГ, структурно сильно различающимися. Это имеет существенное биологическое значение [117].
(П) (III)
Спрашивается, какие свойства детерминантных групп определяют их взаимодействие с антителами? Выясняется, что существенно пространственное строение детерминантной группы. Искусственный АГ типа
Гли—СО
Вызывает образование двух типов антител к антигенам (II) и (III) Гли—СО
( і—N=N—Белок,
![]()
N=N—Белок,
Лей—СО
Но не к антигену (I), как целому. Это показывает, что размеры детерминантных групп и адекватных им реактивных участков антител относительно невелики [22].
Наличие реактивных групп (активных центров) в AT непосредственно доказывается красивыми опытами Прессмана и Штернбергера [23]. Кролик иммунизировался искусственными АГ, содержащими в качестве детерминантных групп остаток п-азобензойной
![]()
W
Ноос
•N=N—Белок
И и-азофениларсиновой кислот
![]()
H203AS—
~N=N—Белок.
Полученные AT подвергались йодированию, чем полностью подавлялась их иммунологическая активность. Однако, если йодирование проводилось в присутствии гаптенов, то активность сохранялась. Отсюда следует, что введение йода в активную область AT уничтожает ее активность, а гаптен защищает эту область от йода. Сказанное изображено схематически на
Гаптен
Рис, 1.4. Схема йодирования антител.
Активно
Рис. 1.4. По-видимому, между активной областью, с одной стороны, и гаптеном или детерминантной группой АГ — с другой, имеется структурное соответствие. Гаптен конкурирует с детерминантной группой за место в активной области антитела. Сродство AT к гаптену, структурно сходному с детерминантной группой, определяется либо методом равновесного диализа, либо по торможению реакции преципитации антигена антителом при различных концентрациях гаптена.
Была изучена методом электронной микроскопии [24]. На рис. 1.5, а показана электронная микрофотография комплекса
![]()
''ШММИ^ШЯ^ЯШ Ш'ШШШЯАі
Рис. 1.5. Электронные микрофотографии комплекса АГ с AT (а) и комплекса АГ с AT, обработанным пепсином (б).
АГ с AT, а на рис. 1.6 — схема, основанная на ее интерпретации [17]. Двухвалентные AT, взаимодействуя с двухвалентными же ДНФ, образуют циклы. Молекулы ДНФ не видны на микрофотографии, выступы у вершин треугольника, по - видимому, являются фрагментами Fc.
Предварительная обработка AT пепсином приводит к отщеплению Fc, но остаются фрагменты Fab, по - прежнему дающие циклические комплексы с ДНФ, но уже без выступов (рис. 1.5,6).
Взаимодействие AT с гаптеном (Г), как уже сказано, подобно взаимодействию с соответствующими АГ. Константа равновесия реакции
АТ + Г ^ AT • Г
Выражается как
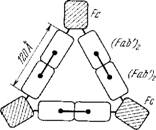
Рис. 1.6. Комплекс антиген —
Антитело. Схема, основанная на электронных микрофотографиях; «гантель» — молекула ДНФ.
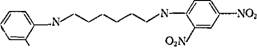
Структура комплекса AT с соответствующим двухвалентным (бифункциональным) динитрофенильным гаптеном (ДНФ)
4no2
0,n -
[AT-Г] ... Т AS — ДЯ
Для определения К пользуются гаптенами, окрашенными или меченными радиоактивными атомами. Величину К можно найти и по торможению реакции AT с АГ (преципитации). По температурной зависимости К определяют значения АН, примерно равные нескольким ккал/моль; значения AS, как правило, положительны. Последнее можно объяснить освобождением гидра - тирующих молекул воды при образовании комплексов.
Анти Анти АнпМ
О-йЗйбензоларсоная) м-аЗоВензтрша/rf п-азобензоларфяап?
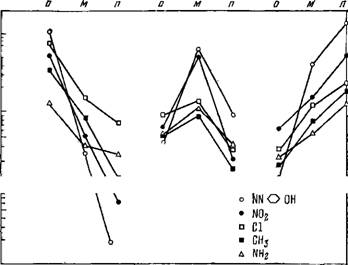
Рис. 1.7. Влияние положения заместителя на значение К' для гаптена
(по Прессману).
К' 10,0
Го
V!
Ц05
Детальные исследования зависимости констант связывания от структуры Г или соответствующей детерминантной группы АГ были проведены Полингом, Прессманом и их сотрудниками [25—27]. В частности, были получены AT к ионам орто-, мета-, пара-азобензоларсоната. Антитела к каждой из этих групп действуют так, как если бы они вступали в структурное соответствие с ван-дер-ваальсовой поверхностью детерминантной группы. Взаимодействие таких AT с другими замещенными азобен - зольной группы определяется исходным АГ. На рис. 1.7 приведены результаты, полученные для таких трех систем — даны значения относительной константы связывания К', равной отношению константы связывания замещенного бензоларсоната к константе связывания незамещенного бензоларсоната в этих системах [27].
Антитело к орго-азобензоларсонату связывает орго-замещен- ные, слабее лгега-замещенные и хуже всего пара-замещенные.
В табл. 1.3 приведены результаты исследования ряда пара- систем [27]. Были получены AT к различным гаптеновым группам. Звездочка указывает гомологичную заряженную группу, числа — относительные константы связывания гомологичного гаптена с антителом (для производных бензола принято значение этой константы, равное 1,0).
Для AT к орго-азобензоату
![]()
—N=
Относительные константы связывания иара-гаптенов R—С6Н4— — С02~ равны для ряда R = Н, F, CI, Br, I соответственно 1,00, 0,6, 0,5, 0,4, 0,5.
Эти данные показывают, что для образования связи AT—АГ или AT—Г необходимо достаточно точное соответствие активного участка AT с поверхностью гаптеновой группы. Чрезвычайно существенно относительное расположение компонентов гаптеновой группы. Для AT к пара-NN—С6Н4—As03H относительные константы связывания 0As03H, H3CAs03H, H5C6As03H" и H5C6CH2As03H соответственно равны 0, 0, 1, 0. Удаление бензольного кольца (необходимого для связывания) от арсоната на одну метальную группу СН2 уничтожает связывание [27].
Связывание сильно зависит от природы заряженной группы. Так, те же AT к пара-NN — СбН4 — As03H~ одинаково сильно связывают СбН5Аз03Н~ и СбН5Р03Н~, но не связывают C6H5SO^, C6H5COJ" и СбН55Ь05Н4~. Существенное значение имеет радиус иона.
Описанные результаты и другие данные, им подобные, свидетельствуют о комплементарное™, о структурном соответствии активного участка AT и детерминантной (гаптеновой) группы АГ. Очевидно, что размеры активного участка AT должны быть соизмеримы с размером гаптена. Методом торможения реакции AT с АГ были исследованы взаимодействия AT к поли-Ь-аланину с олигопептидами аланина. Оптимальным гаптеном, сильнее всего тормозящим реакцию, оказался пентапептид. На этом основании размеры активного участка были оценены в 25 X X 11 X 2 А3 [28]. Считается, что вообще в активных участках фигурируют 10—20 аминокислотных остатков, т. е. около 1% всех остатков молекулы AT. Следует отметить, что число остатков в активном центре фермента того же порядка, но мономерные
Таблица 1.3
|
Гаптены |
|||||||
|
Система |
* |
! |
* 0 Ch3 |
* |
Cr |
* CO |
* |
|
-nn-Q |
N(CH3)2 |
1,0 |
1,45 |
0,86 |
1,05 |
2,0 |
|
|
—NN—^ У—NN—^ |
As03H" |
1,0 |
2,7 |
1,1 |
1,1 |
2,9 |
3,9 |
|
-nn-Q |
As03H- |
1,0 |
1,9 |
0,78 |
0,21 |
0,52 |
6,0 |
|
COO" |
1,0 |
1,8 |
0,21 |
0,03 |
0,03 |
1,98 |
|
|
-nn-Q |
COO" |
1,0 |
3,0 |
0.66 |
0,08 |
0,18 |
10 |
Связывание в различных пара-системах
Молекулы ферментов, как правило, значительно меньше молекул антител.
При денатурации антител их способность к специфическому связыванию АГ или Г исчезает. Однако удается в некоторых случаях осуществить и ренатурацию антител с восстановлением их активности. Присутствие гаптена способствует ренатурации.
Значения свободных энергий связывания, стерическое структурное соответствие активного центра AT и гаптеновой группы, оценки размеров активных центров показывают, что взаимодействие AT с гаптеном весьма сходно по характеру с взаимодействием фермента с субстратом, приводящим к образованию ми - хаэлисова комплекса ([1], гл. 6). Естественно возникает вопрос о конформационных свойствах антител, о информационных превращениях в акте взаимодействия.
Было показано, что папаиновые фрагменты IgG характеризуются большей компактностью, чем молекула в целом [29]. Это указывает на конформационное превращение. Различные про - теазы разрывают тяжелую цепь в одном и том же участке. Можно думать, что этот участок неупорядочен и служит своего рода шарниром. Электронные микрофотографии комплексов AT — Г, подобные приведенным на рис. 1.5, показывают, что углы между Fab-фрагментами могут изменяться. Все эти данные свидетельствуют об известной гибкости молекул IgG. Прямые доказательства конформационной лабильности молекул IgG и IgM были получены путем изучения поляризованной люминесценции (см. [1], § 5.8). Время вращательной релаксации х комплексов IgG с 1-диметиламинонафталин-5-сульфонилом (ДНС, дансил) было оценено в 170—220 не [30, 31]. Близкое значение т дал расчет, основанный на моделировании IgG жестким эллипсоидом вращения. Однако в более точных исследованиях было получено х = 60 не [32]. Это значение соответствует броуновскому движению не всей молекулы белка, но ее относительно малых участков, т. е. указывает на гибкость молекулы. Значения т для отдельных Fab - и /-с-фрагментов равны соответственно 64 и 33 не. При их свободной связи среднее т должно составлять 56 не, что хорошо согласуется с найденными Для целой молекулы значениями. По-видимому, субъединицы IgG, сходные с папаиновыми фрагментами, обладают свободой вращения [33—35]. Взаимодействие гаптена с AT приводит к заметному увеличению т, что свидетельствует об изменении кон - формации AT [36]. С другой стороны, методом кругового дихроизма установлено, что при образовании комплекса А Г — АГ изменяется и конформация АГ [37]. Результаты оптических измерений подтверждаются и исследованиями спектров ЭПР антител, содержащих парамагнитные метки ([38]; детальный обзор и дальнейшие подробности см. в [15, 39]).
Таким образом, конформационные перестройки действительно реализуются при взаимодействиях AT — АГ. Есть основания думать, что они сводятся к изменению взаимных ориен - таций доменов. В этом отношении также имеется сходство с фермент-субстратными комплексами. Принципиальное отличие взаимодействия AT — АГ от взаимодействия фермент — субстрат состоит в том, что в первом случае практически отсутствуют электронные перестройки. Соответственно речь идет о чисто конформационных эффектах, но не об ЭКВ. В этом смысле первый случай значительно проще второго.
Узнавание антигена антителом определяется слабыми взаимодействиями, реализуемыми при структурном соответствии. Узнается сигнатура АГ — его детерминантная, гаптеновая группа. Результатом узнавания является связывание АГ, но не химическое превращение (как в случае фермента).
В свое время Полинг выдвинул идею, согласно которой узнающая система антитела способна к обучению [40]. Полинг считал, что все молекулы AT имеют одну и ту же первичную структуру. Специфические AT образуются в результате конфор - мационного свертывания полипептидных цепей, индуцируемого молекулами АГ, и достижения таким образом структурного соответствия. Однако в дальнейшем было показано, что первичные структуры различных AT разнятся. Подобно ферменту, иммуноглобулин— необучаемая узнающая система.