Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Способы производства нитрата иатрия
Нитрат натрия добывают из природных залежей и производят заводскими способами. В СССР имеются природные месторождения нитрата натрия в Средней Азии, на Кавказе, в Крыму, однако они не имеют промышленного значения 222-223.
Промышленное месторождение натриевой селитры имеется в Чили (Южная Америка), где и производится ее добыча.
Содержание NaN03 в селитроносной земле чилийского месторождения сильно колеблется. Самый богатый селитроносный слой, называемый калише, имеющий толщину 0,25—1,5 м, залегающий на глубине 0,5—2,5 м от поверхности земли, содержит обычно от 15 до 65%, а иногда и до 95% NaN03. Типичной является порода, содержащая около 18% NaN03. Помимо NaN03 в породе содержатся различные количества NaCl, KN03, Na2S04, MgS04, CaS04 и др.
Извлечение селитры из калише осуществляется противоточным горячим выщелачиванием и последующей кристаллизацией при охлаждении почти насыщенного раствора. Получаемый продукт содержит 94—96% NaNOs и примеси других солей. Более чистую (рафинированную) селитру, содержащую 99—99,5% NaN03, получают перекристаллизацией.
Заводские способы получения нитрата натрия основаны на абсорбции окислов азота раствором соды, или на обменном разложении других нитратов с соединениями натрия, или на катионном обмене.
Запатентован 224 способ получения NaN03 из NaCl и азотной кислоты (аналогичный рассмотренному ниже способу получения KNOs —см. стр. 1229).
Наиболее простой способ получения нитрата натрия — нейтрализация азотной кислоты содой или едким натром в промышленности не используется из-за неэкономичности. Наиболее распространенный промышленный способ основан на абсорбции щелочами окислов азота из выхлопных нитрозных газов производства азотной кислоты.
Получение нитрата натрия абсорбцией окислов азота щелочами 225-230
При абсорбции окислов азота щелочами протекают следующие реакции:
2NaOH + NO + N02 = 2NaN02 + H20 2NaOH + 2N02 = NaN03 + NaN02 + H20
ИЛИ
Na2C03 + NO + N02 = 2NaN02 + C02 Na2C03 + 2N02 -= NaN03 + NaN02 + C02
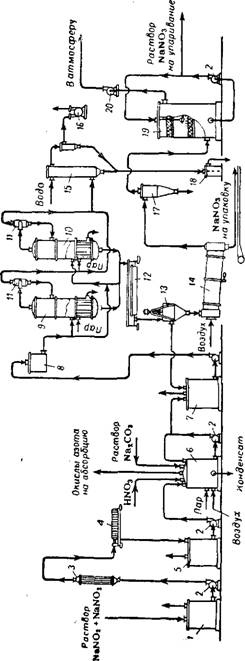
Получаемые в результате щелочной абсорбции нитрозных газов растворы (нитрит-нитратные щелоки) перерабатывают в нитрат натрия (рис. 355). Соотношение между нитратом и нитритом натрия в получаемых щелоках зависит от температуры и степени окис - ленности нитрозных газов 228. Примерный состав «сырых» нитрит - нитратных растворов (после щелочного поглощения): 250—400 г/л NaNCV, 50—80 г/л NaN03; 3—5 г/л NaHC03 и Na2C03; 2—4 г/л NaCl; 850—820 г/л Н20.
Отфильтрованный на фильтрпрессе раствор поступает в аппарат-инвертор периодического или непрерывного действия, в котором происходит превращение (инверсия) нитрита в нитрат натрия под действием азотной кислоты:
3NaN02 + 2HN03 = 3NaN03 + 2NO + Н20
Образующиеся в результате инверсии окислы азота удаляются из раствора нагнетаемым в инвертор воздухом и направляются на переработку в абсорбционное отделение цеха слабой азотной кислоты. По окончании процесса инверсии раствор нейтрализуют содовым раствором. Вновь полученный раствор, содержащий 40—50% NaN03 и имеющий температуру 40—60°, направляют на выпаривание.
|
|
Предложено инверсию нитритных щелоков проводить в пенном аппарате — процесс протекает с большой скоростью и степень инверсии достигает 99,9% 231.
Для выпаривания растворов натриевой селитры обычно применяют двухкорпусную вакуум-выпарную установку. Здесь получают суспензию, в которой содержание NaN03 составляет ~75%, при этом в растворе содержится 62% NaN03, остальное количество соли находится во взвешенном состоянии в виде кристаллов. Эта суспензия из выпарного аппарата поступает в шнековый кристаллизатор с водяной рубашкой, в котором при охлаждении от 90—93° до 40—45° происходит дальнейшая кристаллизация' соли. Кристаллы NaN03 отделяют от раствора в центрифуге и высушивают в сушильном барабане 232. Маточный раствор из центрифуги присоединяют к инвертированному раствору, направляемому на выпаривание.
Для получения 1 г натриевой селитры (100% NaN03) расходуют: 0,455 т азотной кислоты (100%), 0,03 т соды, 2,5 т пара (8 ат), 65 м3 воды, 120 квт-ч электроэнергии. В качестве отхода производства получают (на 1 т NaN03) 0,38 т окислов азота (в пересчете на HN03), направляемых на абсорбцию.
Конверсионный способ получения нитрата натрия
Нитрат натрия может быть получен методами обменного разложения по следующим реакциям:
Ca(N03)2 + Na2S04 = 2NaN03 + CaS04 Ca(N03)2 + 2NaCl = 2NaN03 + CaCl2 NH4N03 + NaCl = NaN03 + NH4C1 2NH4N03+Na2C03 = 2NaN03 + (NH4)2C03 и др.
Каждая из этих реакций имеет свои специфические особенности. Так, при проведении обменного разложения между нитратом кальция и сульфатом натрия необходимо вводить в процесс избыток нитрата кальция, который частично попадает в продукт и делает его гигроскопичным. Выделение в осадок гипса приводит к сильному загустеванию реакционной массы; для того чтобы она оставалась достаточно подвижной, необходимо разбавлять ее раствором нитрата натрия после отделения от него гипса, т. е. возвращать часть раствора в реактор. Скорость обменного разложения зависит от температуры. Так, в данном случае реакция идет при 50° значительно быстрее, чем при 70°; в течение 1 ч при 50° конверсия достигает 96%, а при 70° только 11%- Для получения крупнокристаллического, легко отфильтровываемого осадка гипса необходимо вводить затравку, добавляя в реактор кристаллический гипс и т. д.
Производство нитра та натрия методом Катионного обмена
Представляет интерес разработка новых способов производства нитратов калия и натрия, не требующих затраты щелочей. К таким способам относится получение нитрата натрия из NaCl и окислов азота, аналогичное получению калиевой селитры (стр. 1229), а также метод катионного обмена 233>234.
Процесс получения натриевой (или калиевой) селитры методом катионного обмена состоит из трех основных стадий:
получение раствора Ca(N03)2;
катионный обмен и регенерация катеонита (обмен ионов Саг+ на ионы Na+);
выпаривание раствора NaN03, кристаллизация соли, центрифугирование, сушка и упаковка.
. Реакции, протекающие в первых двух стадиях процесса, могут £?ыть схематически выражены следующими уравнениями: Ca(N03)2 + (катионит)№2 <—* 2NaN03 + (катионит)Са (катнонит)Са + 2NaCl < (катнонит)№2 + СаС12
При этом происходит непрерывное чередование процессов конверсии кальциевой селитры и регенерации катеонита кальция растворами хлорида натрия (или хлорида калия).
Промежуточными стадиями этого процесса являются: промывка водой катеонита, выпарка и кристаллизация конвертированных растворов.
Описываемый метод нашел промышленное применение в Норвегии. Растворы кальциевой селитры пропускают через ряд катионо - обменников, в которые загружен цеолит (природный минерал типа полевого шпата). Для регенерации цеолита используют морскую воду. Образующийся раствор натриевой селитры концентрируют выпариванием и далее кристаллизуют соль с последующей перекристаллизацией (для получения более чистого продукта). Готовый продукт используют как удобрение.
Получение нитрита натрия
Одним из способов получения нитрита натрия является его выделение из нитрит-нитратного щелока до инверсии. В этом случае процесс абсорбции окислов азота ведут таким образом, чтобы получить щелок по возможности с большим содержанием нитрита и С меньшим содержанием нитрата. Этого можно достигнуть уменьшением содержания кислорода в газе, поступающем на абсорбцию, чтобы к моменту подхода газа к щелочным башням степень окисления содержащихся в нем окислов азота соответствовала эквимолекулярной смеси NO + N02.
Нитрит натрия можно получить также из нитрит-нитратных растворов, образующихся при поглощении окислов азота раствором соды по обычному режиму, но при небольшом изменении схемы процесса переработки растворов. В этом случае «сырой» нитрит-нитратный щелок нагревают до 80—90° .для перевода растворимых примесей — бикарбонатов магния и кальция — в нерастворимые карбонаты. Затем щелок профильтровывают или осветляют и направляют в выпарную установку, подобную используемой для выпаривания инвертированного раствора. Выпаривание ведут при 118—125° 235. В выпарной установке содержание NaN02 в растворе доводится до ~63%.
Далее при охлаждении раствора до 40—45° в кристаллизаторе часть нитрита натрия кристаллизуется. Полное выделение нитрита натрия в одном цикле кристаллизации невозможно, что видно из диаграммы растворимости в системе NaN03—NaN02—Н20 (стр. 1216). Эвтонические растворы при всех температурах содержат значительные количества NaN02. Кристаллический осадок NaN02 отделяют на центрифугах от раствора и промывают паровым конденсатом для отмывки ионов хлора, которые содержатся в воде. Затем нитрит натрия высушивают в сушильном барабане нагретым до 100° воздухом. Готовый продукт содержит менее 1,5% влаги
Маточный раствор, содержащий после отделения кристаллов нитрита натрия, приблизительно 500 г/л NaN02 и 200 г/л NaN03. вместе с промывными водами направляется в инвертор, где нитрит натрия окисляется в нитрат. Дальнейшая переработка инвертированного раствора проводится по описанной выше схеме (см. рис. 355).
Выход нитрита натрия и его качество зависят главным образом от отношения нитрита к нитрату в «сыром» щелоке. Качество продукта улучшается, если в процессе получения «сырого» нитрит-нитратного щелока используют не техническую воду, а паровой конденсат (для растворения соды и др.).