Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Скорость разложения фосфатов при сернокислотной экстракции из них фосфорной кислоты
Исследования системы СаО—Р205—SO3—Н20 показали, что фосфаты кальция и серная кислота не могут сосуществовать в растворе при обычных для производства температурах, т. е реакция (1) необратима и нацело протекает слева направо 4б>47.
Гетерогенная реакция разложения апатита серной кислотой в присутствии фосфорной сводится к взаимодействию ионов Н+ и
Р043~ фосфата с образованием малодиссоциированной Н3Р04. Сульфат-ионы связывают ионы кальция, и преобладающее их количество выделяется в относительно большом объеме раствора (Т : Ж ~ 2 - т - 3 : 1) в виде малорастворимого сульфата кальция. В этих условиях, при правильном режиме процесса, сульфат кальция не осаждается на зернах растворяющегося фосфата; исключено и выделение из раствора фосфатов кальция, которые могли бы образовать на поверхности зерен экранирующую корку.
Экспериментальное исследование скорости процесса в условиях растворения фосфата в серной кислоте в смеси с фосфорной кислотой весьма затруднительно из-за сложности образующейся системы.
|
1,8303 |
Растворение апатита в кислотах48 лимитируется скоростью диффузии ионов водорода из объема раствора к поверхности частиц фосфата или ионов кальция из пограничного слоя в объем раствора. В области высоких концентраций вязкость растворов фосфорной кислоты значительно 1,7782
Увеличивается, что замедляет диффузию ионов и дополнительно уменьшает скорость растворения апатита. Таким образом, концентрация ионов водорода и вязкость раствора являются основными факторами, определяющими скорость растворения апатита в смеси серной и фосфорной кислот.
|
H2S04 + Н3Р04 |
Свойства тройной системы H2S04—Н3Р04—Н20, компоненты которой неограниченно растворимы во всей области концентраций и в широком диапазоне температур, изучены недостаточно. Допускают 49~50, что кислотные компоненты е этой системе образуют ацидиевый комплекс эквимолярного состава:
[H4P04]+ + HS07
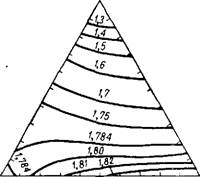
Плотность тройных растворов сильно зависит от содержания воды и в меньшей мере от соотношения в них кислот51-52. На рис. 235 показана плотность растворов тройной системы при 75°. При концентрации от 100 до 20 мол. % воды растворы с большим содержанием H2S04 имеют несколько большую плотность; при
|
|
|
0,3749 HjO |
|
H2S04 |
|
Н3Р04 |
|
Рис. 235. Плотность (в г/см3) растворов системы H2S04—Н3Р04—Н20 (в мол. %) при 75°. |
4 М. Е. Позия
Содержании Н20 менее 20 мол.% — наоборот, — более плотными являются растворы с меньшим содержанием H2SO4. При содержании воды около 20 мол.% плотность изогидратных растворов практически не зависит от соотношения кислот.
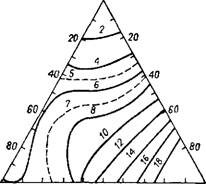
На изотермах вязкости при постоянном содержании воды имеется минимум, глубина и положение которого зависят от температуры. Кривые зависимости вязкости от концентрации (рис. 236) указывают, что в системе H2S04—Н3РО4— —Н20 ассоциированные ком - H2so4 20 40 ео So Н3РО4 плексы, имеющиеся в двой-
Рис. 236. Вязкость (в сп) растворов си - ных системах, диссоциируют стемы H2S04—HSP04—Н20 (в мол. %) при смешении51. Имеющий - при 75°. ся в двойной системе
H2SO4—Н20 максимум вязкости, соответствующий составу H2SO4 • Н20, обнаруживается и в тройной системе. Добавление Н3РО4 вызывает разрушение гидрата и в концентрированных растворах с преобладанием фосфорной над серной кислотой он отсутствует полностью. Изотермическая поверхность вязкости имеет сложный рельеф. Область, богатая серной кислотой, характеризуется синклиналью и антиклиналью: последняя проходит в направлении от H2S04—Н20 к H2SO4 • • Н3РО4. С повышением температуры и синклиналь и антиклиналь исчезают и при 95° поверхность вязкости Hzso, 20 40 ео So НзРо4
Уже почти моноклинна. При рис 237. Удельная электропроводность небольших концентрациях (в олг1 • слг1) растворов системы
H2S04 кривые вязкости H2S04—Н3Р04—Н20 (в мол. %) при 75°. имеют монотонный характер.
|
|
|
НгО
|
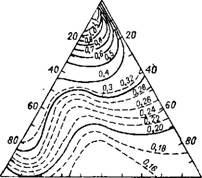
На рис. 237 показаны значения удельной электропроводности растворов тройной системы разных концентраций при 75°. Изо
термическая поверхность удельной электропроводности имеет две антиклинали и одну синклиналь. Антиклиналь в области разбавленных растворов, по-видимому, связана с максимальной миграцией ионов, а в области прилегающей к углу серной кислоты — с оптимальными условиями передачи протона.
Давление паров воды над некоторыми растворами тройной системы определено при 60° для смесей, содержащих ~45% Р2О5 (~62,5% Н3РО4) и от ~ 1 до 16% H2S04, а для смесей, содержащих -53% Р205 и от 0,3 до 10% H2SO4, при 60 и 75° (табл. 69).
|
ТАБЛИЦА 69 Давление водяного пара над некоторыми растворами системы Н3РО4— H2S04— Н20
|
При 60° давление пара над смесью 62,5—64%-ной фосфорной и серной кислот с повышением концентрацйи серной кислоты от 0 до 16,85% H2SO4 уменьшается от 76,5 до 23 мм рт. ст. Увеличение концентрации серной кислоты в смесях, содержащих 74—76%
Н3Р04, от 0 до 10,5% H2S04, приводит к понижению давления пара от 47 до 17 мм рт. ст. При 75° увеличение содержания серной кислоты в растворах с концентрацией 74—76% Н3Р04 понижает давление пара от 95 до 34,2 мм рт. ст.
Тепловые эффекты смешения и теплоемкости смесей, содержащих 61,8—58% Н3РО4 и 1,03—6,5% H2SO4, характеризуются максимумом, равным 0,634 ккал/(ч •град) и соответствующим концентрации 4% H2SO4. Показано53, что тепловой эффект смешения
|
Рис. 238. Зависимость степени разложения фосфорита от времени и концентрации исходной серной Кислоты при отношении Т : Ж = 1: 4: / -30% H2SO4; 2-40% H2SO4; 3-50% H2SO4; 4-60Я H2S04; 5 — 70% H2SO4. 30 €0 90 120 НО 160 211 Время, мим |
|
-о "О -Л |
62%-ной фосфорной кислоты и 94%-ной серной с образованием смесей, содержащих 58—62% Н3Р04 и 1—6,5% H2S04, соответствует (в ккал/г смеси) численному значению концентрации (в %) серной кислоты в смеси. Например, для смеси с концентрацией 1,03, 1,99% H2SO4 тепловой эффект смешения равен 1,08, 2,0 ккйл/г Смеси.
Скорость разложения фосфата серной кислотой в присутствии раствора разбавления — фосфорной кислоты, как и при производстве суперфосфата, зависит не только от активности ионов водорода, но и от степени пересыщения жидкой фазы продуктом реакции— сульфатом кальция. Общий вид зависимости степени разложения фосфата за определенное время (изохрона) от концентрации серной кислоты в смеси так же как и на рис.217 изображается кривой, имеющей два максимума и один минимум между ними. Так как скорость взаимодействия между фосфатом и серной кислотой велика, то можно предположить, что начальная действую
щая концентрация серной кислоты будет определяться длительностью ее подачи и объемом раствора разбавления. Например, при подаче 100 вес. ч. моногидрата серной кислоты для разложения 100 вес. ч. апатита в объем раствора фосфорной кислоты, занимаемый 400 вес. ч. (начальное отношение Ж : Т = 2,5 : 1 в расчете на сухой фосфогипс) в течение 1 ч ее начальная концентрация в смеси при продолжительности полного смешения, равной ~ 1 мин, будет ■— 0,3 % и всего ~ 3 %, если принять (без учета взаимодействия серной кислоты) продолжительность полного смешения, равную 10 мин. В действительности за 10 мин много кислоты прореагирует и, следовательно, начальная
Таким образом, разложение фосфата протекает при взаимодействии с серной кислотой небольшой концентрации, и скорость процесса максимальна при некоторой оптимальной концентрации серной кислоты в смеси с фосфорной, лежащей в левой части рис. 217. . По-видимому, в области концентраций серной кислоты в смеси меньше оптимальной разложение фосфата замедляется вследствие недостаточной активности ионов водорода, а при больших концентрациях вследствие торможения реакции при экранировании поверхности зерен фосфата коркой выделяющегося сульфата кальция.
|
Концентрация серной кисло - ^.ЮО ты будет во много раз | меньше. |
|
1«7 |
|
1 ВО |
|
I 20 |
|
60 |
|
I2D № 240 Время, мин |
|
300 360 |
|
Рис. 239. Изменение степени разложения фосфорита серной кислотой во времени при разных температурах (крупность фосфорита — 150+105 мк). |
|
40 |
|
01 |
Непосредственных данных о скорости разложения фосфатов смесями фосфорной кислоты, содержащими небольшие количества (0,1—0,3%) серной кислоты, почти не имеется. Приближенно можно судить о скорости процесса по данным взаимодействия фосфатов с серной кислотой большей концентрации (30—50% H2S04) как в отсутствие, так и в присутствии в начальной смеси фосфорной кислоты. При весовом отношении фосфата и кислоты (Т:Ж), равном 1 :4, разложение подольского фосфорита, содержащего 32,8% Р2О5, с крупностью частиц меньше 53 мк при 70° раствором серной кислоты концентрации 30% H2S04 завершается полностью за ~ 15 мин (рис. 238). С увеличением концентрации кислоты до 40% H2S04 скорость процесса уменьшается и для полного
разложения фосфата требуется 60—90 мин. Скорость реакции значительно увеличивается с повышением температуры даже при использовании фосфата грубого помола (с размерами частиц меньше 150 и больше 105 мк) и 50%-ной серной кислоты (рис. 239).
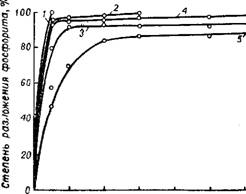
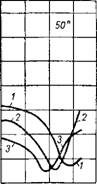
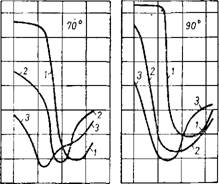
Однако в присутствии фосфорной кислоты скорость растворения фосфата серной кислотой несколько уменьшается, по-видимому, вследствие уменьшения активности ионов водорода. Как видно на рис. 240 54, изохроны растворения апатита при 70° большим из-
|
|
|
|
|
~ 700 600 8 В 500 6 400 О Е 300 M О "S 200 Оо ■о |
30 40 50 ео 70 30 40 50 S0 70 30 40 50 £0
H2S04,%
Рис. 240. Изохроны растворения апатита в смесях серной и фосфорной кислот при 50, 70 и 90°:
1-0% Н3РО4; 2-10% Н3РО4; 3-25% Н3РО4.
Бытком смеси кислот (Т : Ж 1 : 30) при отсутствии перемешивания твердой фазы располагаются тем ниже, чем больше в смеси содержится фосфорной кислоты. Хотя эти данные получены в условиях, отличающихся от применяемых на практике, но они в некоторой мере отражают кинетические особенности процесса. Очевидно, что минимальная скорость разложения апатита обусловлена образованием плохо проницаемых корок сульфата кальция при некоторых средних концентрациях H2SO4 в смеси, превышающих концентрации, при которых обычно осуществляется процесс экстракции. В действительности вследствие значительно меньших концентраций серной кислоты в жидкой фазе экстракционной пульпы разложение фосфата протекает с большей скоростью. По мере расходования сильно диссоциированной серной кислоты и накопления в растворе солей и малодиссоциированной фосфорной кислоты активность раствора и скорость процесса уменьшаются.
Большое влияние на скорость разложения имеет природа фосфата (общая удельная поверхность элементарных зерен) 55~57.
Скорость разложения апатита кислотами прямо пропорциональна внешней поверхности зерен минерала55. При разложении крупнозернистого апатита наблюдается практически линейная зависимость количества разложенного вещества от времени, потому что в этом случае суммарная величина поверхности зерен изменяется медленно. При разложении полидисперсной фосфатной муки линейная зависимость отсутствует. Мелкие зерна обладают большой общей поверхностью, которая быстро уменьшается в ходе реакции. Реакция протекает вначале с высокой скоростью, и мелкие зерна оказываются разложенными до окончания процесса. Крупные зерна имеют относительно малую суммарную поверхность, они реагируют медленно, что приводит к постепенному уменьшению скорости растворения апатита к концу реакции. В производстве фосфорной кислоты применяется фосфатная мука стандартного помола, т. е. с остатком на сите 0,15 мм до 14%. Апатитовый концентрат обладает очень малой общей удельной поверхностью, поэтому он разлагается кислотами относительно медленно. Осадочные фосфориты, содержащие фторапатит в виде мельчайших зерен (меньше 1 мк), разлагается с большей скоростью58.
При разложении фосфата в две ступени по уравнениям (2) и (3) в первой ступени процесса диссоциация фосфорной кислоты постепенно подавляется вследствие роста концентрации монокальцийфосфата в растворе.
|
10 20 30 40 50 60 P*Os, % |
|
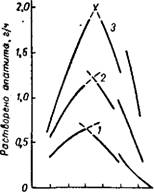
Рис. 241. Изохроны-изотер - мы скорости растворения апатита в водных растворах фосфорной кислоты при температурах: 1 - 50°; 2 - 70°; 3 - 90°. |
При весьма малой степени нейтрализации фосфорной кислоты в этих условиях для оценки скорости процесса можно с известным приближением воспользоваться данными, полученными при изучении растворения апатита в большом объеме фосфорной кисло- ты 55,59,60 (рис. 241), При разложении апатита фосфорной кислотой (в отсутствие серной), с увеличением концентрации Р2О5 до 30—35%, степень диссоциации Н3Р04 уменьшается, но количество ионов водорода в единице объема раствора возрастает. Поэтому на данном участке изохрон-изотерм (рис. 241) скорость растворения апатита увеличивается. При дальнейшем повышении концентрации значительное падение степени диссоциации фосфорной кислоты приводит к уменьшению числа ионов водорода в единице объема раствора и, следовательно, к уменьшению скорости растворения апатита. С увеличением степени нейтрализации растворение
апатита замедляется. Изотермы растворения апатита в частично нейтрализованной фосфорной кислоте аналогичны изотермам, приведенным на рис. 241, но средние скорости растворения уменьшаются с увеличением степени нейтрализации кислоты 48>6,-63 (см. также рис. 273 на стр. 980).
Скорость реакции апатита с фосфорной кислотой зависит также от температуры. Температурный коэффициент скорости растворения апатита в растворах фосфорной кислоты48'63 находится в пределах от 1,31 до 1,48.
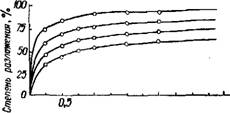
Степень разложения апатита фосфорной кислотой за одно и то же время тем выше, чем больше температура (рйс. 242). Реакция
Разложения фосфатов про - _ово' текает с выделением тепла ^uf (см' гл' XXIV); тепло вы - Является также при разбавлении серной кислоты. Поэтому в условиях производства пульпа разогревается до 75—80° и выше. ^ я», ^ ^ Скорость взаимодействия
°>хм<4 с растворами кислот мине-
Рис. 242. Изменение степени разложения Ралов-примесей (глаукони -
Фосфорной кислотой апатитового концен - та> лимонита) уменылает -
Трата во времени при разных температурах. СЯ ПО мере разложения, ТЭК
Концентрация фосфорной кислоты 20% Р205; как перехОДЯЩИе В раСТВОр
Ж' =20-L катионы постепенно подав
Ляют диссоциацию кислоты. Прокаленный при 400—800° глауконит разлагается медленнее, чем непрокаленный. Примесь серной кислоты в фосфорной (2—6% S03) практически мало влияет на скорость разложения глауконита и лимонита, но способствует удержанию в растворе окислов железа.
Разложение фосфоритов сопровождается выделением С02, образующей пену. При недостаточно интенсивном перемешивании частицы фосфата, попадая в малоподвижную пепу, образуют комочки, которые в результате взаимодействия с серной кислотой покрываются коркой кристаллов сульфата кальция. Это нарушает нормальный процесс разложения фосфата. Перемешивание должно обеспечить интенсивное движение верхнего слоя пены и ее поглощение (засасывание) пульпой в воронку, образующуюся при вращении лопастных мешалок с окружной скоростью 4—6 м/сек. Применяются также подавители пены. Для создания турбулентного движения жидкости при перемешивании имеет значение отношение Ж : 'Г в пульпе. Практикой установлено отношение Ж : Т в пределах от 2,5 до 3,5, которое поддерживается циркуляцией оборотной фосфорной кислоты.
В производственных условиях высокая степень разложения природных фосфатов (в том числе и наиболее медленно реагирующего апатитового концентрата) достигается уже в первые 1 —1,5 ч. Однако скорость разложения фосфата не является единственным фактором, определяющим длительность процесса. Она определяется условиями образования крупнокристаллического сульфата кальция, обладающего хорошими фильтрующими свойствами, из которого можно отмыть фосфорную кислоту небольшим количеством воды. Это необходимо для получения кислоты максимальной концентрации (так как промывная вода возвращается в цикл). Практически продолжительность экстракции для разных видов сырья и режимов колеблется в пределах 4—8 ч.