Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
ПРОИЗВОДСТВО СЛОЖНЫХ УДОБРЕНИЙ НА БАЗЕ ФОСФОРНОЙ КИСЛОТЫ
На базе фосфорной кислоты существует несколько схем производства сложных удобрений типа нитроаммофоски и диаммонитро - фоски 188. Эти удобрения характеризуются высоким содержанием питательных веществ (50% и выше) и хорошими физическими свойствами. Р2О5 в них находится полностью в водорастворимой форме. Производственные схемы отличаются между собой методом нейтрализации фосфорной кислоты и конструктивным оформлением основных аппаратов.
Некоторые свойства водных систем, содержащих Фосфаты, нитраты аммония, карбамид и др.9
В процессе производства сложных удобрений фосфорная кислота нейтрализуется до моноаммонийфосфата и диаммонийфосфата:
|
Н3РО4 + NH3 = Н3РО4 + 2NH3 = |
|
. nh4h2po4 (nh4)2hp04 |
Для этих целей может применяться как термическая, так и Экстракционная фосфорная кислота. Обычно применяется более дешевая экстракционная кислота. В сложных удобрениях могут быть любые соотношения между моно - и ди - аммонийфосфатом.
Из диаграммы совместной растворимости NH4H2P04 и (NHO2HPO4 в воде (рис. 399) видно, что растворимость моноаммонийфосфата увеличивается с повышением концентрации диаммонийфосфата. Максимальная растворимость моноаммонийфосфата будет при молярном отношении Н3Р04 : NH3 = 1,5. Во избежание потерь аммиака на практике нейтрализацию ведут до отношения Н3Р04:МН3 = = 1,3—1,35 9.
|
70 |
|
|
О |
SO |
|
I |
|
|
» |
ЬО |
|
R |
40 |
|
Л. |
|
|
30 |
|
|
О |
|
|
А. |
70 |
|
S |
|
|
» X |
Ю |
|
Z |
|
|
0 |
|
С |
? |
|||||||
|
А X |
||||||||
|
? |
||||||||
|
Z | |
|
10 20 30 40 So Во 70 So (NH4)2 НРО4 , г/IOOeНгО Рис. 399. Диаграмма растворимости в системе NH4H2P04—(NH4)2 HP04—HSO При 25°. |
Отношение N : Р2О5 в фосфатах аммония составляет: для моноаммонийфосфата 1:5 и для диаммонийфосфата 1 :2,5. Для выравнивания соотношения N : Р205 необходимо вводить в удобрения азот. Обычно недостаток азота покрывают за счет добавки нитрата аммония, карбамида или сульфата аммония.
|
Из диаграмм растворимости 189 при 25° для систем NH4H2P04— -(NH4)2S04—Н20 (рис. 400) и (NH4)2HP04— (NH4)2S04—Н20 |
(рис. 401) видно, что при увеличении содержания (NH4)2S04 в растворе, растворимость фосфатов аммония уменьшается. При увеличении
|
80 |
|
О 40 О. 5 30 Ж 20 Z |
|
Ю 20 30 40 50 SO W 80 (NH4)2S04, Г/100г НгО |
Рис. 400. Диаграмма растворимости Рис. 401. Диаграмма раствори - в системе NH4H2P04— (NH4)2S04—Н20 мости в системе
При 25°. (NH4)2HP04—{NH4)2S04—Н2Опри 25°.
Концентрации фосфатов аммония растворимость (NH4)2S04 изменяется незначительно. Нитрат аммония оказывает сильное высаливающее действие на моноаммо - нийфосфат 190"194.
В последнее время для выравнивания соотношения N : Р205 в удобрениях стали широко применять добавку карбамида. Система NH4H2P04— ^—СО (NH2) 2—Н20 изучена в интервале температур от 15,3 до 50° 195-198. Изотерма этой системы при 50° представлена на рис. 402.
В присутствии моноаммонийфосфата карбамид гидролизуется:
CO(NH2)2 + Н20 = 2NH3 + С02
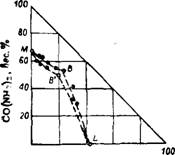
|
20 40 ео во КН4НгР04,й«-.% |
|
Рис. 402. Диаграмма растворимости в системе CO(NH2)2—NH4H2P04— Н20 при 50° (кривая MBL — по данным после 3-суточного перемешивания раствора; кривая MB'L — по данным после 8- суточного перемешивания раствора). Аммонийфосфата с выделяющимся при разложении карбамида аммиаком. В присутствии диаммонийфосфата разложение карбамида не происходит 199. |
С течением времени содержание карбамида в растворе уменьшается, но уменьшается и скорость его разложения, что объясняется появлением в растворе диаммонийфосфата, который образуется при взаимодействии моно-
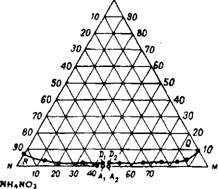
Система CO(NH2)2—(NH4)2HP04—Н20 изучена в интервале температур от —16 до + 30°198'20°, На рис. 403 представлена изотерма растворимости в четырехкомпонентной системе CO(NH2)2— ^-NH4N03—(NH4)2HP04—
—Н20 при 50°; разложе - (Пн4)1нро4
Ния карбамида не наблю - р
|
90 30 |
|
I I ' |
О> |
||||||||
|
4 |
> . |
CO (NHj)J |
|||||||
|
N' |
|||||||||
|
/ |
(NH |
Ч)хЬ |
№04 |
||||||
|
Я |
4J |
||||||||
|
Ч |
М' |
||||||||
|
Г |
|||||||||
|
Ч |
Ч |
||||||||
|
Ч, |
|
О Н Ж |
|
Рис. 403. Изотерма растворимости в система CO(NH2)2—NH4NOa—(nh4)2HP04—Н20 при 50°. |
|
3 * Ь |
|
1?0 |
Дается ни в одной обла
201
Сти
При производстве удобрений, содержащих три основных питательных элемента (NPK), в систему вводят калий чаще всего в виде хлористого калия. Реакция nh4no3 + kci
. Kno3 + nh4ci
Обычно не проходит до конца и степень конверсии КС1 зависит от режима обработки материала. Повышение температуры и продолжительности взаимодействия компонентов при хорошем перемещивании увеличивают степень конверсии
J^Ql 202, 203
Процессы получения сложных удобрений из фосфорной кислоты можно разделить на три типа.
1) Процессы с двухступенчатой аммониза -
|
C0(NHX), |
|
О Ю 20 30 40 О 50 Ё0 |
Цией, в которых вначале аммонизируется фосфорная кислота до моноаммонийфосфата. Затем полученный раствор для выравнивания отношения N : Р2О5 смешивается с плавом нитрата аммония или карбамида 72>87- 204 и аммонизируется газообразным аммиаком до Диаммонийфосфата. Доаммонизация осуществляется в аммониза - торе-грануляторе, в который одновременно подаются хлористый калий и ретур. Доаммонизация проходит на поверхности гранул. Процесс требует большого количества ретура (3,6—10-кратного и даже
Более). Благодаря этому доаммонизация осуществляется в тонком слое на поверхности гранул. Кроме того, большое количество ретура позволяет поддерживать влажность материала на входе в сушильный барабан около 4%, что способствует получению прочных гранул сферической формы 205-21з.
Малоретурные процессы, в которых получение пульпы необходимого состава осуществляется в реакторах, а грануляция и сушка совмещаются в одном аппарате типа сферодайзера или в сушилке типа РКСГ (с распылением и кипящим слоем материала сушилка — гранулятор). В этих аппаратах пульпа распыляется форсунками на завесу падающих гранул или просто в объем, в котором происходит высушивание капель и формирование гранул. Отношение количества ретура к количеству продукта для этой схемы составляет от 0,3 до 1.
Расплавные процессы — в которых нейтрализуется смесь кислот с использованием теплоты нейтрализации. Затем полученный раствор выпаривается до состояния плава под вакуумом в выпарных аппаратах, смешивается с хлористым калием и гранулируется в башне или в барабанных грануляторах (в этом случае в гранулятор поступают ретур и хлористый калий). По такой схеме получаются очень прочные стекловидные гранулы.