Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение хлората калия известковым методом
Физико-химические основы
Обычно хлорированию подвергают известковое молоко с концентрацией 130—140 г/л СаО. Реакция идет до полного исчезновеНия свободной извести по уравнению:
2Са(ОН)2 + 2С12 = Са(С10)2 + СаС12 + 2Н20 + 52,6 ккал
При дальнейшем хлорировании образующаяся при гидролизе Хлора хлорноватистая кислота окисляет гипохлорит кальция в хлорат:
Са(С10)8 + 4НСЮ = Са(С103)2 + 4НС1
Образующаяся соляная кислота также реагирует с гипохлори - том, превращая его в хлорид кальция и выделяя малодиссоцииро - ванные молекулы НСЮ:
2Са(С10)2 + 4НС1 - 2СаС12 + 4НС10
Хлорноватистая кислота окисляет новое количество Са(СЮ)2 и т. д. до тех пор, пока весь гипохлорит не перейдет в хлорат. Таким образом, хлорноватистая кислота является лишь катализатором — переносчиком кислорода.
Суммарная реакция второй стадии процесса выражается уравнением:
ЗСа(С10)2 = Са(С103)2 +2СаС12 +36,7 ккал
Общим уравнением процесса образования хлората при хлорировании известкового молока является:
6Са(ОН)2 + 6С12 = Са(С103)2 + 5СаС12 + 6Н20 + 194,5 ккал
Из этого уравнения видно, что при хлорировании лишь 7в часть щелочи превращается в хлорат, а 5/б. переходят в хлорид. Этим объясняется невыгодность прямого получения хлората калия хлорированием едкого кали по реакции
6КОН + ЗС12 = КС103 + 5КС1 + ЗН20
Так как при этом ~83% ценной щелочи КОН, получаемой электролизом КС1 с большой затратой энергии, вновь превращаются в КС1. При хлорировании же известкового молока с последующим обменным разложением Са(С10з)2 и КС1 расходуется значительно менее ценная щелочь — Са(ОН)2.
Основным фактором, обусловливающим образование хлората из гипохлорита с наибольшей скоростью, является нейтральность среды. В отличие от прежних взглядов, согласно которым стремились создать кислую среду, последующими исследованиями установлено 20)>202, что максимальная скорость образования хлората наблюдается при рН раствора 7—7,4. Окислителем в этом процессе может быть как НСЮ, так и СЮ", и образование хлората можно выразить следующими реакциями:
2НС10 + СЮ" = ClOg + 2Н+ + 2СГ - 2С1СГ + НСЮ = CIO3 + Н+ + 2СГ
Чем выше температура, тем быстрее идет окисление гипохлорита хлорноватистой кислотой. Однако повышение температуры приводит не только к ускорению образования хлората, но вызывает частичное разложение гипохлорита с потерей кислорода. Оптимальной температурой хлорирования считается 75—80 , при которой потеря кислорода невелика. Для хлорирования может применяться хлор любой концентрации.
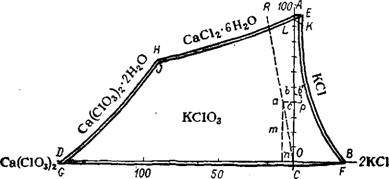
На рис. 442 изображена клинографическая проекция на горизонтальную плоскость диаграммы растворимости в системе 2°з Са(СЮ8)2 + 2КС1 = 2КСЮ3 + СаС12 при 0°. Поле кристаллизации хлората калия занимает почти всю диаграмму, и его окаймляют узкие поля остальных солей. Стабильной является пара КСЮ3 + + СаСЬ, так как линия соприкосновения их полей пересекает срединную линию АОС. Поля Са(С103)2-2Н20 и КС1 не соприкасаются, и эти соли не могут находиться совместно в твердой фазе.
|
СаСЬ
Рис. 442. Система Са(С103)2 + 2КС1 =« 2КС103 + СаС12 при 0°. Концентрации солей выражены в молях на 1000 моль воды. |
Вертикальная плоскость АОС делит диаграмму на две части. В левой — растворы состоят из КСЮз, СаСЬ и Са(СЮз)2, в правой— из КСЮз, СаС12 и КС1. По линии АОС растворы состоят только из СаСЬ и КСЮз. Получаемые при хлорировании известко - <вого молока растворы содержат на 1 моль Са(СЮ3)2 Ъмоль СаСЬ, и их фигуративные точки располагаются на прямой OR в системе СаСЬ—Са(СЮз)2—Н20. Для любой точки этой прямой, например а, соотношение
Са(СЮз)2: СаС12 ■= ~ = —
При растворении КС1 состав раствора перемещается параллельно оси ОВ и достигает линии АОС в точке с, когда количество КС1 эквивалентно хлорату кальция. На практике обычно вводят избыток КС1, и состав раствора перемещается в правую часть диаграммы, например в точку р. После выделения КСЮ3 фигуративная точка маточного раствора несколько поднимется по оси СаСЬ ввиду добавочно образующегося по реакции обменного разложения хлорида кальция. Таким образом, состав конечного раствора изображается точкой Ь находящейся в правой части диаграммы.
Способы и режимы производства
Для абсорбции хлора известковым молоком применяют аппараты различных конструкций. Используют, например, стальные цилиндрические аппараты, диаметром 2—2,5 ж и высотой 4,5—Ъм, футерованные диабазовой плиткой или кислотоупорным кирпичом, в которые заливают известковое молоко и подводят хлор через бар - ботажную трубу 204. По внешнему сходству их называют башнями. Внутри башни имеется стальной змеевик, по которому циркулирует холодная вода для отвода тепла реакции. Сухой хлор подают в башню по железной гуммированной трубе.
В хлорированном щелоке должно быть 76—80 г/л Са(С103)г, 230—240 г/л СаС12 и не более 3—4 г/л Са(С10)2. Выход хлората, по поглощенному хлору составляет около 95%. Прохлорированный щелок продувают воздухом (для удаления растворенного хлора). Затем его подвергают «обезвреживанию», т. е. разрушают содержащийся в нем гипохлорит восстановлением С10~. Для этого к горячему щелоку добавляют раствор аммиака, гипосульфита или органические вещества — мелассу, муку, древесные опилки и т. п. Обезвреживание производят в больших резервуарах (емкостью 15—20 м3), футерованных кислотоупорным материалом, снабженных мешалками и паровыми змеевиками для поддержания температуры щелока на уровне 60—70°. Хорошо прохлорированный щелок до обезвреживания имеет ярко-розовый цвет, обусловленный содержанием в нем примеси железа в виде феррата кальция CaFe04. При обезвреживании феррат кальция разрушается, образуя нерастворимый Fe(OH)3, и щелок приобретает грязно-желтый цвет.
После обезвреживания щелок отделяют от шлама — нерастворимых примесей, перешедших из извести [CaC03, Si02, Fe(OH)3 и др.], — отстаиванием или фильтрацией (при работе с концентрированным щелоком, полученным из известкового молока высокой концентрации). Шлам промывают для уменьшения потерь хлората, и промывные воды используют при приготовлении известкового молока. Очищенный от шлама щелок выпаривают. В тех случаях, когда для хлорирования используют известковое молоко высокой концентрации, хлорированный щелок получается достаточно концентрированным и не требует выпарки. В этом случае для обменного разложения применяют твердый КС1, чтобы не разбавлять раствор перед кристаллизацией. Однако при этом в связи с повышенной вязкостью суспензии затрудняется отделение шлама от прохлорированного щелока, а потери Са(С103)2 увеличиваются.
Когда процесс осуществляют по схеме с выпаркой щелоков (после обменного разложения), то обычно для обменного разложения применяют раствор КС1, так как при этом облегчается его
Дозировка и ускоряется реакция. Обменную реакцию ведут при повышенной температуре; затем щелок выпаривают. Выпаренный щелок, содержащий 160—170 г/л КСЮ3 450—460 г/л СаС12 на-;; правляют на кристаллизацию.
На разных заводах применяются различные схемы кристаллизации. Например, щелок после обменного разложения охлаждают в непрерывно действующих кристаллизаторах барабанного типа с водяным или воздушным охлаждением до 15—20°; после отделения основной массы кристаллов КСЮз производят дополнительное вымораживание КСЮ3 при охлаждении маточного раствора до — ГО, —20°. Кристаллы бертолетовой соли отфуговывают и сушат. Для получения более чистой соли часть отфугованной соли подвергают перекристаллизации.
Из прохлорированного щелока перед реакцией обменного разложения можно выделить значительную часть СаС12. При охлаждении щелока до 10° из него выделяются кристаллы СаС12-6Н20, так как Са(С10з)г обладает большой растворимостью. Другим вариантом является осаждение СаСЬ (в частности, после его предварительной кристаллизации) добавлением к горячему раствору из-' веста. При охлаждении выделяется оксихлорид примерного состава ЗСа0-СаС12-15Н20. Этими способами можно перед обменным разложением получить из щелока до 95% СаС12.
По другой схеме обменное разложение между КС1 и Са(С103)2 производят до выпарки и из выпаренного щелока охлаждением до 30—35° выделяют до 80% КСЮ3. Пульпу разделяют на центрифуге. Бертолетова соль с содержанием 75—80% КСЮ3 и 5—6% СаС12 идет на перекристаллизацию, а маточный раствор (~40 г/л КСЮз и 460—470 г/л СаС12)—на дополнительное охлаждение. При охлаждении маточного раствора от 30 до —2, —3° в нем остается около 5% КСЮ3 (от первойачального его количества). Выделившийся КС103 после отделения от раствора также нодвер - га'ют перекристаллизации. Оставшийся после вымораживания щелок, содержащий 470—480 г/л СаС12 и не более 14 г/л КС103, является отходом производства, используемым для получения хлористого бария или для выделения товарного хлористого кальция (стр. 745).
Производство бертолетовой соли описанным способом является периодическим, громоздким и многостадийным. По более совершенной схеме 205 хлорирование известкового молока и обменную реакцию хлората кальция с хлоридом к&лия осуществляют в одном аппарате. Хлорид калия подают в бак с известковым молоком с 15—20%-ным избытком по отношению к СаО для обеспечения более полного выделения хлората калия. Первая стадия процесса— образование гипохлорита — не изменяется от присутствия хлорида калия. Однако вторая ста1ья—переход гипохлорита в хлорат и хлорид в присутствии КС — характеризуется более
Устойчивым пенообразованием. Разрушение пены производят путем разбрызгивания на ее поверхности избыточного маточного раствора второй кристаллизации. Образовавшийся хлорированный щелок направляют на выпарку и последующее охлаждение для кристаллизации хлората калия и его переработки, аналогичной описанной выше.
После отжима на центрифуге хлорат калия содержит 4—8% влаги. Так как нагревание его до высоких температур может привести к разложению и взрыву, сушку соли производят при низких температурах в вакуум-сушилках. После высушивания хлорат калия просеивают или сепарируют на фракции воздушным сепаратором. Часть более крупной соли иногда подвергается размолу. Перед размолом соль пропускают через магнитный сепаратор для извлечения случайно попавших частиц железа, которые могут вызвать взрыв соли при размоле. Размол производят в дезинтеграторе или в бегунах. Ввиду взрывоопасности операции сушки и размола организуются в отдельном здании, удаленном от других цехов завода.
На производство 1 т хлората калия по известковому методу расходуют: 2,15—2,17 г извести (100% СаО), 2,2—2,3 г хлора (100%), 0,9—0,98 т хлористого калия (100% КС1), 32—34 кг мелассы (концентрации 4,6%), 400 кьт-ч электроэнергии, 600—610 м3 Воды и 7—7,1 мгкал пара (4 атм) в качестве отхода получается ~3 г СаС12 в виде раствора указанной выше концентрации.
Хлорат калия может быть получен и многими другими химическими способами, в основе которых лежат хлорирование суспензий Mg(OH)2 206, СаС03, ZnO и других соединений и обменное разложение полученных хлоратов с КС1 или другими солями калия (K2S04, К2С03).