Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение хл ори стого аммония из фильтровой жидкости содового производства
При получении соды аммиачным способом по реакции NaCl + NH3 + С02 + Н20 = NaHC03 + NH4C1
После отделения бикарбоната натрия остается так называемая фильтровая жидкость, в 1 л которой содержится 170—180 г NH4CI, 70—80 г NaCl и небольшие количества карбонатов — NH4HC03, (МН^гСОз — и других примесей.
Из фильтровой жидкости регенерируют аммиак, возвращаемый в содовый процесс. Часть ее на некоторых заводах используют для получения хлористого аммония 207-210. Хлористый аммоний выделяют выпариванием фильтровой жидкости в вакуум-выпарных аппаратах211-213. Предварительно жидкость нагревают с целью регенерации из нее аммиака и двуокиси углерода, содержащихся в форме карбоната и бикарбоната аммония. Разделение оставшихся солей — NaCl и NH4C1 — осуществляется в процессе выпаривания раствора и основано на различной растворимости этих солей. Растворимость NaCl меняется с температурой мало, растворимость NH4CI меняется значительно.
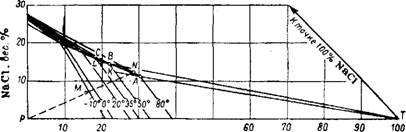
На рис. 369 приведена политермическая диаграмма растворимости в системе NH4C1—NaCl—Н2О. Если, например, исходная фильтровая жидкость содержит 175,0 г/л (15,5%) NH4C1 и
|
30 S 40 50 NH4CI, вес. % Рис. 369. Пути кристаллизации NH4C1 На диаграмме растворимости в системе NH4CI—NaCl—Н20. |
76,6Г/л (6,8%) NaCl, то состав ее изобразится на диаграмме точкой М. В процессе выпаривания она передвигается по лучу испарения PN по направлению к точке N. До сравнительно высоких концентраций и температур этот луч проходит в поле кристаллизации NH4CI. Если выпаривание произвести до точки N, лежащей на изотерме 80°, то раствор станет насыщенным NaCl. При дальнейшем выпаривании воды при 80° из раствора будет кристаллизоваться NaCl, пока раствор не станет эвтоническим (точка А). После отделения NaCl состав системы (оставшегося раствора) изображается точкой А. При охлаждении этого раствора, например до 50°, из него будет кристаллизоваться NH4C1, так как точка А лежит в поле кристаллизации NH4CI, ограниченном при 50° изотермой BS, осью абсцисс ST и лучом ВТ, проведенным из эвтонической точки В к точке Т твердого NH4CI. В процессе кристаллизации NH4C1 точка состава раствора перемещается по отрезку луча кристаллизации АК, и когда раствор охладится до 50°, его состав изобразится точкой К.
Охлаждение лучше осуществлять в многоступенчатых вакуум - кристаллизаторах, в которых происходит дополнительное испарение воды, и за счет этого выход твердого NH4C1 увеличивается. Так, если охлаждение до 50° производится в вакуум-кристаллизаторе, то
NH4CI дополнительно выделяется в процессе испарения воды при этой температуре, причем точка состава раствора перемещается по отрезку изотермы КВ. В точке В раствор снова становится эвтони - ческим, и дальнейшее испарение из него воды при 50° недопустимо. Однако в следующей ступени вакуум-кристаллизатора раствор состава В может быть охлажден, например, до 35°. При этом вновь будет кристаллизоваться NH4C1, так как точка В находится внутри поля кристаллизации этой соли при 35° (для того чтобы ограничить это поле следует провести луч из точки Т в точку С). В результате кристаллизации, обусловленной охлаждением, точка раствора переместится из В в L, а испарением — в эвтоническую точку С. Так как самоиспарение воды и вызванное им охлаждение происходит в корпусах вакуум-кристаллизатора одновременно, то изменение состава раствора на самом деле идет не по ломаным линиям АКВ или BLC, а по некоторым кривым (на диаграмме не показаны) .
Для упрощения производства фильтровую жидкость можно охладить, не отделяя хлористый натрий, выкристаллизовавшийся в конце ее выпаривания. Так как точка N лежит з поле кристаллизации NH4CI при 50°, то при охлаждении системы до этой температуры. кристаллы NaCl растворятся, a NH4CI выкристаллизуется. Однако количество его (выход) будет меньше, чем в случае предварительного отделения части NaCl.
Кристаллы NH4CI отделяют от маточной жидкости на центрифуге. Отжатый хлористый аммоний содержит ~3% NaCl и до 5% влаги.
Аппаратуру для переработки растворов, содержащих хлористый аммоний, изготовляют из кислотоупорных материалов. Из металлов (и сплавов) наиболее стойким в кипящих растворах является титан214. Сушку хлористого аммония ведут при температурах не выше 70° во избежание его диссоциации.
Хлористый аммоний можно выделить из фильтровой жидкости вымораживанием, охлаждая жидкость, предварительно насыщенную аммиаком, двуокисью углерода и поваренной солью. Этот способ не требует расхода пара на выпарку, а главное его преимущество — значительное уменьшение коррозии аппаратуры при пониженных температурах215-217.
Хлористый аммоний может быть получен одновременно с содой (бикарбонатом натрия) и легко выделен из раствора и без применения выпаривания или вымораживания. Для этого в содовый процесс вводят третью соль, например NaN03218, (NH4)2S04 219~221, высаливающую хлористый аммоний.
При насыщении раствора NaN03 аммиаком и двуокисью углерода образуются бикарбонат натрия и нитрат аммония:
NaN03 + NH3 + С02 + Н20 = NaHC03 + NH4NOj
После отделения осадка бикарбоната натрия в оставшийся раствор вводят поваренную соль:
NH4N03 + NaCl = NH4C1 + NaN03
Образующийся по этой реакции NH4C1 выделяется в осадок и после его отделения регенерированный раствор NaNOs снова возвращают на насыщение аммиаком и двуокисью углерода. Отжатый на центрифуге NH4C1 содержит до 5% влаги, до 1% ЫаНСОз и ничтожные количества NaCl.
Вообще, наиболее экономичным является метод производства хлористого аммония высаливанием его из фильтровой жидкости твердым хлористым натрием. Этот процесс может быть организован, когда содовый завод использует в качестве сырья не рассол, а твердую каменную соль.
При получении хлористого аммония, пригодного для производства сухих элементов, предложено производить предварительную очистку раствора, содержащего NH4CI, с помощью смол 222 или дру гими способами 223.
Получение хлористого аммония обменным разложением хлоридов с солями аммония219'220'
Конверсия аммонийных солей хлоридами базируется на реакциях обменного разложения, например 225>226:
(NH4)2 S04 + 2NaCl (2КС1) = 2NH4C1 + Na2S04 (K2S04) NH4N03 + KCl = NH4C1 + KN03 (NH4)_, S04 + CaCl2 = 2NH4C1 + CaS04
Оптимальные условия проведения реакций (температуры и кон, центрации) определяются по соответствующим диаграммам раство римости. Во всех приведенных реакциях из образующейся пары солей хлористый аммоний остается в растворе, а вторая соль выделяется в осадок. После ее отделения хлористый аммоний можно извлечь из раствора кристаллизацией при охлаждении или выпариванием. Аппаратуру для переработки растворов, содержащих хлористый аммоний, изготовляют из углеродистой стали и футеруют кислотоупорными плитками. Сушку хлористого аммония ведут не выше 60—70° во избежание его диссоциации.
Хлористый аммоний, получаемый конверсией хлористого калия с аммиачной селитрой, имеет следующий состав (в %): NH4C1 — 88,9, KNO3 —5,2, NH4NO3 —3,2, NaNOs —0,7, Н20 — 2,0. На 1 т Хлористого аммония, получаемого этим методом, расходуется: 1,6 т Хлористого калия (2-го сорта), 1,7 т аммиачной селитры (100% NH4NO3), 0,2 г. аммиака (100% NH3), 5,4 г пара (6 ат), 76,6 м3 Воды и 183,5 квт-ч электроэнергии.
В качестве дополнительных продуктов на 1 т NH4CI получается 1,75 т азотнокислого калия и 0,52 т сложного удобрения, содержащего. азот и калий; возврат аммиака составляет 0,18 т.
Описанный метод не получил пока промышленного распространения вследствие недостаточной экономичности — он требует значительной затраты дорогостоящего сырья.