Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение буры из борной кислоты
Процесс основан на реакции
Na2C03 + 4Н3ВО3 = Na2B407 - f С02 + 6Н20
В реакторе, снабженном мешалкой, приготовляют раствор соды, нагревают его до 95—100° и загружают борную кислоту. Во избежание выброса раствора из-за сильного вспенивания, обусловленного выделением углекислого газа, борную кислоту добавляют небольшими порциями. Соотношение между загружаемыми компонентами должно быть таким, чтобы полученный раствор содержал 14—20% Na2B407 и 0,5—1,0% Na2C03. Избыток соды затрудняет в дальнейшем отмывку буры и увеличивает количество промывных вод; недостаток соды уменьшает выход В203 в буру (часть В203 переходит в более растворимые соли) и затрудняет ее кристаллизацию. На 1 т буры расходуют 0,65 г технической борной кислоты и 0,307 т кальцинированной соды.
После 30-минутного нагревания при 100° раствор отделяют от шлама — нерастворимых загрязнений, попавших из сырья, и направляют для охлаждения от 90° до 15—20° в кристаллизаторы, где из него кристаллизуется бура Na2B407 • ЮН20. Кристаллы буры отделяют от маточного раствора на центрифуге. Здесь же их промывают водой. Маточный раствор и промывные воды возвращают в реактор на растворение соды. Вследствие этого в растворе накапливается сульфат натрия, образующийся из содержащегося в сырой борной кислоте сульфата магния:
MgS04 + Na2C03 = Na2S04 + MgC03
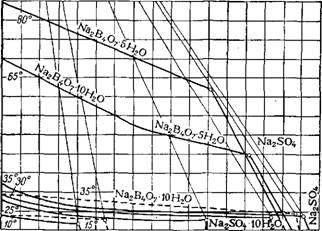
На рис. 104 приведены некоторые изотермы системы Na2B407— Na2S04—Н20 (сплошные линии) 157 и изотермы 15 и 35° той же
Системы в присутствии 1,5% Na2C03 (пунктирные линии). Влияние такого количества соды не существенно. Накопление же сульфата натрия может привести к загрязнению буры мирабилитом. При 25° в эвтоническом растворе содержится 21,9% Na2S04. В присутствии примеси Na2C03 и NaCl эта концентрация несколько понижается. Если раствор буры при кристаллизации охлаждается до 25°, то практически недопустимо содержание в исходном растворе больше 12% Na2S04; при этом в маточном растворе не должно быть больше 20% Na2S04. Чем больше в растворе Na2S04, тем выше должна
|
4 8 12 16 го 24 гв 32 Na2So4,% Рнс. 104 Система Na2B407—Na2S04—Н20. |
|
Го |
|
В |
|
4 |
24
Быть конечная температура кристаллизации буры. Следовательно, часть маточного раствора должна выводиться из цикла. Кроме того, в присутствии в растворе более 2,5% Na2S04 образующиеся кристаллы буры уменьшаются в размере,57>,5Э. Удовлетворительные по размерам кристаллы буры получаются, если в исходном растворе, содержащем 1,5% Na2C03 и 0,5 % NaCl, не больше 5% Na2S04; маточный раствор при этом не насыщен сульфатом натрия— он содержит ~8% Na2S04. В выводимом из цикла маточном растворе содержится 1,3—1,7% Na2B407. А. А. Соколовским разработан способ, позволяющий возвратить этот раствор в цикл после извлечения большей части Na2S04. Этот способ заключается в переводе содержащегося в растворе тетрабората в более растворимый пентаборат натрия, в выпарке раствора и кристаллизации из него сульфата натрия; обедненный сульфатом раствор, содержащий В203 в форме пентабората, может быть возвращен в цикл.
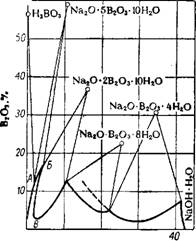
На рис. 105 показана изотерма 30° системы Na20—В203—Н20. Линия АБ — растворимость пентабората натрия Na2B10Oi6 • ЮН20 или Na20 • 5В20з-ЮН20; растворимость тетрабората имеет минимум в точке В. С более щелочными растворами в равновесии находятся метабораты натрия Na20 • В203 • 8Н20 и Na20 • В203 • 4Н20. Перевод тетрабората в пентаборат добавкой к раствору борной кислоты неприемлем, так как состав полученного раствора неблагоприятен для кристаллизации из него сульфата натрия. Этот перевод можно осуществить добавкой к раствору такого количества серной
|
20 30 Na20.% |
|
Рис. 105. Изотерма 30° системы Na20-B203-H20. |
|
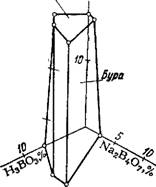
Na2S04,% Мирабилит Щ Пентаборат натрия' Борная кислота
Рис. 105. Изотермическая проек* ция (20,5°) пространственной диаграммы для системы Na2S04—Н3ВО3—Na2B407—Н20. |
Кислоты, которое требуется для нейтрализации Na2C03 и перевода буры в пентаборат натрия; при этом содержание Na2S04 в растворе увеличивается. После выпарки раствора до достижения концентрации Na2S04 23—24%, при охлаждении до 20° выкристаллизовывается мирабилит Na2S04-10H20 (рис. 106) 160. Выход сульфата натрия (50—60%) зависит от начального состава маточного раствора и может быть увеличен до 80% и более путем повторения операций с добавкой к вторичному маточному раствору после выделения мирабилита новых порций исходного маточного раствора.
Недостатком описанного выше процесса получения буры из борной кислоты является его периодичность. Наибольшие трудности при переходе на непрерывный процесс вызывает кристаллизация буры. Применяемые на заводах периодически действующие кри
сталлизаторы представляют собой резервуары с мешалками, охлаждаемые водой через металлические стенки или с помощью змее - виков. Они требуют частой чистки от налипающих кристаллов - и малопроизводительны. Попытка применения вакуум-кристаллизаторов оказалась неудачной вследствие обильного вспенивания в - них растворов буры и переброса пены в коммуникации. Образование пены объясняется выделением С02 при взаимодействии буры, с остатками соды:
Na2B407 + Na2C03 = 4NaB02 + С02
Метаборат натрия образуется медленно, и для полного завершения этого процесса с образованием непенящегося раствора буры требуется длительное время. Кроме того, работа с раствором, содержащим вместо небольшого избытка соды эквивалентное - ему количество метабората, нецелесообразна из-за ухудшения, условий кристаллизации буры и увеличения содержания В20з в маточном растворе. Поэтому важной задачей является разработка конструкции непрерывно действующего кристаллизатора с водяным охлаждением или вакуумного типа, пригодного для пенящегося раствора. •
При производстве буры из датолитового сырья для реакции с содовым раствором можно использовать не кристаллическую - борную кислоту, а получаемый при кислотном разложении датоли - тов раствор борной кислоты, так как он не содержит сульфата магния. (Таким образом исключаются стадии кристаллизации Н3В03 и ее медленного растворения в содовом растворе). Оба раствора можно одновременно подавать в реактор непрерывного действия; после 30—60-минутного перемешивания в реакторе при 95—100° и контрольной фильтрации раствор буры должен в этом случае подвергнуться выпарке для удаления избытка воды, после чего может быть направлен на политермическую кристаллизацию.