Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Получение бихромата натрия с углекислотной травкой хромата-
При травке раствора хромата натрия угольной кислотой степень перехода хромата в бихромат по реакции
2Na2Cr04 + 2С02 + Н20 Na2Cr207 + 2NaHC03
Зависит от температуры, концентрации раствора хромата натрия ч давления двуокиси углерода. С понижением температуры увеличивается растворимость СО? и уменьшается растворимость NaHC03, что способствует протеканию реакции слева направо. В то же - время с понижением температуры уменьшается растворимость хромата натрия, что может повлиять неблагоприятно на степень перехода,7Э. Степень превращения ч бихромят насыщенного раствора хромата, содержащего 16,98% Сг, при 23° под давлением С02 4 ат Достигает 66% за 5 ч. В ненасыщенном растворе (14,3% Сг) степень превращения под давлением 8 ат достигает 65% за 2 ч.
Повышение давления С02 до 40 ат приводит к сравнительно- небольшому увеличению выхода бихромата. При содержании в - ЮО мл раствора 16,6 г Сг и 10° степень превращения за 8—12 ч составляет под давлением 10 ат ~68%, а при 40 ат ~83% .
С повышением температуры до 30° степень превращения уменьшается до 50% при 10 ат и до ~72% при 40 ат. С увеличением концентрации хрома в растворе степень превращения возрастает в большей мере при небольших давлениях и в меньшей мере при повышенных давлениях 180.
Остающийся в растворе при однократной травке угольной кислотой непрореагировавший хромат натрия (25—35% от общего количества хрома) может быть переведен в бихромат при дотравке
Во,------------------------------------------------- ^—-------------- г-—
|
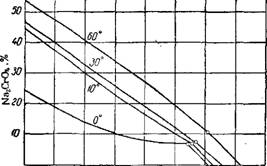
О ю го зо 40 So До да оо Na2Cr207,% Рис. 177. Растворимость в системе Na2Cr04 - Na2Cr207 - Н20. |
Раствора серной кислотой (после отделения бикарбоната). Для сокращения расхода серной кислоты предложено травленый раствор выпарить и выкристаллизовать из него при охлаждении часть хромата. При этом доля бихроматного хрома в растворе может повыситься до 91%, а расход серной кислоты сократиться в 2,5—3,5 раза181. Это объясняется тем, что при кристаллизации хромата из •насыщенных растворов, содержание бихромата в которых мало, происходит обогащение их бихроматом (рис. 177). Так, при 10° ■эвтонический раствор содержит 6,73% Na2Cr04 и 55,7% Na2Cr207, т. е. относительное содержание в растворе хрома в виде Na2Cr04 равно 8,89%, а в виде Na2Cr207— 91,11%. При выпаривании раствора до концентрации 82% Na2Cr207, соотвётствующей температуре кипения его ~ 145° практически весь хромат удаляется из раствора, а остающийся насыщенный раствор бихромата при охлаждении застывает в твердый продукт 182.
Преимущества комбинированной травки угольной и серной кислотами по сравнению с сернокислотной' травкой заключаются в уменьшении расхода серной кислоты почти в 5 раз, соответственном сокращении количества образующегося сульфата натрия и по
терь с ним хромпика, в двукратном уменьшении расхода соды вследствие возврата бикарбоната в процесс.
Возможна и полная замена серной кислоты угольной при двух - стадийном осуществлении процесса травки с промежуточным отделением бикарбоната натрия. По такой схеме травка хромата угольной кислотой в крупных заводских масштабах осуществлена
|
ЛГ-л |
|
1Руда |
|
Известняк ' 38% CO,T |
|
Осадок__ | |
|
9о%с______________________ __ I 50% с рг_ ~______ Шъ. {рихромап^ЛК/жстситзациА |
|
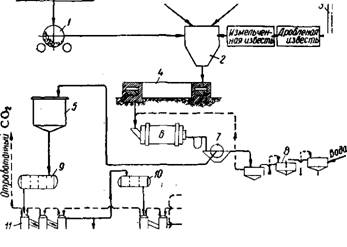
Рис. 178. Схема производства бихромата натрия с углекислотной травкой Монохроматного щелока: i —мельница для размола руды; 2 — шихтосмешеиие; 3 —печь для обжига извести; 4 — кольцевая печь для обжига шихты; 5 —приемный бак; 6 — мельница мокрого помола; 7 —фильтр; В — сгуститель; 9 — трехстадийная выпарка; 10 — двухстадийная выпарка; 11 — травочиые автоклавы; 12 — компрессор. |
|
1-я стадия L^Kfr'H 2-я ста - )рикар5Опат насыщения |
В Германии в 30-х годах. На рис. 178 показана схема производства бихромата натрия с углекислотной травкой 132> 133>183. Прокалку шихты с известковым наполнителем осуществляют в кольцевых печах. В этих печах с горизонтальным вращающимся подом исключается налипание спека на стенки печи. Благодаря быстрому прогреву шихты и отсутствию непрерывных перевалок сохраняется пористая, структура спека. Это обусловливает возможность применения извести вместо доломита и, следовательно, снижение расхода наполнителя. В этом случае расход наполнителя составляет 0,755 т на 1 т бихромата натрия вместо 1 т/г при трехстадийной прокалке (стр. 588) и вместо 2 т/т при одностадийной прокалке Шихты.
Травку раствора хромата натрия производят под давлением 15—16 ат в две стадии смешанным газом (из известково-обжига - тельных печей и из печей кальцинации бикарбоната), содержащим 50% С02. В автоклавы первой стадии карбонизации поступает раствор при 70° с содержанием 820 г/л хромата натрия. В процессе карбонизации раствор охлаждается до 20° и хромат переходит в бихромат на 86—87%. Затем раствор отделяют от выделившегося бикарбоната на центрифуге и выпаривают до концентрации 1300 г/л в пересчете на хромат натрия; выделившийся частично в осадок хромат натрия отделяют отстаиванием. Щелок подвергают второй карбонизации, причем температура его снижается от 70 до 30°, а степень перехода хромата в бихромат достигает 94—96%. Вторая стадия карбонизации завершается в течение 6 ч, причем повышение давления С02 сверх 6 ат на выходе бихромата практически не отражается. Выделившийся бикарбонат также отделяют на центрифуге, а раствор поступает на дальнейшую переработку. Бикарбонат натрия прОмывают водой, кальцинируют и полученную «желтую» соду (содержащую ~1% Na2Cr04) возвращают на шихтовку с хромитом. Расход соды при этом методе производства составляет 500 кг на 1 т хромпика вместо 920 кг при травке серной кислотой.
БИХРОМАТ КАЛИЯ
Калиевый хромпик может быть получен путем поташного вскрытия хромитов, т. е. аналогично натриевому хромпику, но с применением поташа взамен соды. Этот способ в настоящее время не применяется, так как рациональнее пользоваться более дешевыми источниками калия, чем поташ, а именно хлоридом или сульфатом калия, получая калиевый хромпик обменным разложением этих калиевых солей с бихроматом натрия по реакциям: Na2Cr207 + 2КС1 = К2Сг207 + 2NaCl Na2Cr207 + K2S04 = K2Cr207 + Na2SO,
Поташный способ вскрытия хромитов может, однако, найти применение в сочетании с травкой хромата угольной кислотой с возвратом поташа в шихту, по схеме:
4К2СОз + 2(FeO • Сг203) + 3,502 = 4K2Cr04 + Fe203 + 4COj 4K2Cr04 + 4С02 + 2НаО = 4КНС03 + 2К2Сг2От 4КНСОа = 2К2С03 + 2Н20 + 2С02
При содержании в шихте 17,55% Сг203, стехиометрического количества поташа, 5%-ного избытка СаО (в виде доломита) степень окисления хромита за 60 мин составила в лабораторных условиях ~95% ш. Увеличение продолжительности прокаливания до 2 ч повышает степень окисления на 1—2%. Уменьшение содержания К2СО3 в шихте до 50% от стехиометрического количества, не,- обходимого для образования хромата, обусловливает понижение степени окисления лишь на ~4%.
Описано 132>133'135'178'185 получение бихромата калия на заводе в Биттерфельде по щелочному способу спеканием хромита с едким кали:
2Сг203 + 8КОН + 302 = 4К2Сг04 + 4Н20
Тонкоизмельченный хромит (7—10% остатка на сите с отверстиями 0,044 мм) смешивают с 50% раствором КОН, не содержащим больших количеств КС1. Полученную пульпу подвергают мокрому спеканию в течение 9—10 ч при 400—500° в печи, обогреваемой водородным пламенем. Обогрев печи водородным пламенем исключает образование К2СО3, который налипает на стенки печи. Плав выщелачивают раствором бикарбоната калия. Получаемый раствор, содержащий 150—220 г/л К2СГО4 и 120—185 г/л К2СО3, выпаривают до концентрации 670 г/л К2СО3. Выделившийся при этом в осадок хромат калия растворяют в воде и подвергают травке двуокисью углерода под избыточным давлением 4 ат: 2K2Cr04 + 2С02 + Н20 К2Сг207 + 2КНС03
Осадок бихромата калия отделяют, промывают и высушивают, а раствор бикарбоната калия направляют на выщелачивание плава. Раствор поташа, полученный после отделения хромата калия, очищают от остатков хромата, выпаривают и выпускают в виде товарного продукта. Степень использования хрома по этому методу составляет 92—96%, т. е. выше, чем по другим методам, и мало зависит от качества руды. На 1 т бихромата калия (67,1% СгОз) расходуется около 2000 м3 водорода и получается 1,2—2 т поташа.
В СССР бихромат калия производят обменным разложением бихромата натрия с хлоридом калия, более дешевым, чем сульфат калия. Помимо этого, сульфаты натрия и калия образуют глазе - ритовые твердые растворы в широком интервале концентраций, что осложняет осуществление процесса 132>186. Процесс может быть также осуществлен с применением сильвинита, т. е. смеси КС1 и • NaCl. Однако в этом случае несколько уменьшается выход КгОггО/ и возрастает количество воды, которое необходимо выпарить 187.
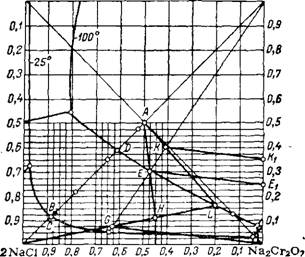
На рис. 179 изображена диаграмма растворимости в системе Na2Cr207 + 2КС1 = К2Сг207 + 2NaCl при 25 и 100°188-191. При этих температурах стабильной парой солей являются К2Сг207 и NaCl; эти соли обладают и наибольшими полями кристаллизации. Поле кристаллизации К2Сг207при низких температурах сильно увеличено, поэтому обменное разложение Na2Cra07 и КС! можно было бы проводить при обычной температуре (20—25°), причем в твердую фазу выделялся бы КгСг207. Однако при этом значительные количества КаСг207 оставались бы в маточном растворе, содержащем NaCl. С целью более полного разделения этих солей обменное разложение лучше проводить при повышенной температуре, когда при соответствующем соотношении компонентов в твердую фазу будет удаляться NaCl. После отделения осадка NaCl путем охлаждения щелока из него можно выкристаллизовать К2СГ2О7.
В качестве примера рассчитаем выход К2СГ2О7 при 25° из эквимолекулярной смеси, содержащей (в г-ионах): 0,5 — К, 0,5 — Na, 0,5 — С1 и 0,5 — Сгг07 (точка А на рис. 179). Этому составу соответствует содержание воды в насыщенном растворе 26 М на 1 г-мол
|
2КС10,1 0,2 0,3 Off 0,5 0,Б 0,7 0,8 0,9 К2Сг20,
Рис. 179. Изображение циклических методов получеНия бихромата калия на диаграмме системы Na2Cr207 + 2КС1 ^rt К2Сг207 + 2NaCl. |
Солей. Весовой состав раствора (в г): 29,25 — NaCl, 73,55 — K2Cr20? и 468 — Н20. Он может быть получен растворением 37,28 г КС1 и 65,5 Na2Cr207 в 468 г Н20 и будет содержать 11,5% Na2Cr207. (Аналогично, в насыщенном растворе точки А — при 100° 29,9% Na2Cr207.)
При смешении указанных количеств солей с меньшим количеством воды, например с 8,5 моль или 153 г Н20, из системы будет выкристаллизовываться бихромат калия, а состав жидкой фазы будет изменяться по лучу кристаллизации К2СГ2О7 — А до точки В, которая соответствует насыщенному раствору, содержащему 8,5 моль воды, 0,876 моль NaCl и 0,124 моль К2Сг207. Если обозначим количество этого раствора у, ах — количество выкристаллизоВавшегося на участке А — В К2СГ2О7, то уравнение материального баланса будет:
0,5К2Сг207 + 0,5NaCl = XK2Cr207 + у (0,876NaCl + 0,124К2Сг207)
Учитывая, что количество NaCl в растворе не изменяется, т. е. 0,5 NaCl = у ■ 0,876 NaCl, находим у - 0,571 и х = 0,429. Следова -
0 429
Тельно, выход К2Сг207 в твердую фазу составит• 100 = 85,8%.
Это максимальный выход КаСг207, достигаемый при 25° из оптимальной (стехиометрической) смеси исходных солей при исключении опасности загрязнения продукта вследствие кристаллизации NaCl, начинающейся в точке С.
Дополнительное извлечение К2Сг2107 из маточного раствора можно осуществить путем его концентрирования, например, при 100°. Раствор состава В при 100° находится в-поле кристаллизации NaCl. Поэтому при выпаривании из раствора будет кристаллизоваться NaCl, а состав раствора будет меняться по линии NaCl — В По направлению к точке D, по достижении которой выпаривание следует прекратить, во избежание выделения наряду с NaCl также КгСг207. Состав раствора в точке D (в молях): 0,609 — NaCl, 0,391 — K2Cr207 и 5,67—Н20. По уравнениям материальных балансов для точки D легко найти что будет испарено 6,7 моль воды (из 8,5 моль) и выделится 0,683 моль NaCl, или 78% от содержащегося в исходном растворе (0,876 моль). При охлаждении маточного раствора (после отделения NaCl) до 25° возможно дополнительно выделить 0,305 моль К2Сг207, или 78% от содержащегося в растворе. Общий выход КгСг207 в результате двухступенчатой
Кристаллизации будет 85,8 += 96,9% .
Циклическое получение бихромата калия обменным разложением бихромата натрия и хлорида калия может быть осуществлено разными путями. Например, по циклу К—G — L — К исходный раствор, соответствующий по составу точке К при 100°, охлаждают До 25°. Во избежание выделения NaCl маточный раствор должен иметь состав точки G; при этом из первоначального раствора выделяется 0,346 г-же бихромата калия на 1 г-же суммы солей. Маточный раствор нагревают и выпаривают при 100° до получения раствора состава L. При этом выделяется в осадок 0,346 г-же NaCl на 1 г-же суммы солей. К отделенному от NaCl раствору добавляют 0,692 г-же смеси состава А. В результате снова получается 1 г-же исходного раствора К и цикл возобновляется.
Возможно также получение бихромата калия по циклу Е —
—Н—Е. Однако в этом случае выход бихромата меньше и требуется удалять при выпарке раствора большее количество воды, но аппаратурное оформление процесса проще.
20 М. Е. Позин
Выход бихромата по обоим циклам легко определить графически, Прямые отрезки ЕЕХ и ККь параллельные прямой G — — Na2Cr207, образующиеся при пересечении со стороной квадрата K2Cr207—Na2Cr207 в точках и Кь соответствуют (в масштабе) количеству бихромата калия, кристаллизующегося при охлаждении растворов Е и К до точки G.
Практически реакция между Na2Cr2'07 и КС1 проводится в реакторе, куда предварительно заливают промывные воды и маточный раствор и выпаривают их до плотности 1,37—1,38 г/см3. Затем В реактор добавляют раствор бихромата натрия, содержащий не менее 925 г/л СгОз, и в горячий раствор (— 105°), содержащий 260—280 г/л Сг03, вводят эквивалентное количество КС1. Раствор слегка подкисляют серной кислотой для перевода примеси хромата В бихромат и окисляют хроми-хроматы хлорной известью. После отстаивания горячего раствора от выделившегося NaCl осветленный раствор направляют в кристаллизаторы, где при охлаждении до 30—35° из него выделяется К2СГ2О7. В процессе кристаллизации раствор несколько раз разбавляют водой от промывки кристаллов К2СГ2О7, чтобы избежать выпадения NaCl вместе с К2СГ2О7. Выход бихромата калия по хрому достигает 96% 188'189-
На получение 1 т бихромата калия (98% КгСг207) расходуется: 1,004 т бихромата натрия (100%), 0,55 т хлорида калия (95%), 0,017 т серной кислоты (100%), до 0,001 т хлорной извести, 5,2 г пара, 300 кет • ч электроэнергии.
Другой путь разделения солей заключается в выпаривании щелока после обменного разложения, причем NaCl выделяется в осадок; его отфильтровывают и промывают. Промывные воды возвращают в производство. Отфильтрованный раствор К2Сг207 концентрируют (до 500—525 г/л КгСг2O7) и после отстаивания направляют на кристаллизацию в стационарные или вращающиеся кристаллизаторы. Кристаллы КгСг207 подсушивают при 40—50°.
Кристаллизация бихромата калия (так же как и бихромата натрия) сопровождается инкрустацией охлаждающих поверхностей выделяющимися кристаллами. Для устранения или уменьшения инкрустации требуется осуществлять интенсивное перемешивание раствора, перемещающее процесс образования и роста кристаллов с охлаждающих поверхностей в массу раствора, и обеспечить малую разность температур между раствором и охлаждающей водой. Наиболее легко это достигается в кристаллизаторах непрерывного действия192. Использование вакуум-кристаллизаторов приводит к получению мелких кристаллов, как и при чрезмерно интенсивном перемешивании раствора в механических кристаллизаторах. Кристаллизация бихромата в аппаратах с охлаждением и перемешиванием раствора барботирующим воздухом исключает инкрустацию, дает возможность использовать для сооружения кристаллизатора или его облицовки нетеплопроводные, но химически стойкие
Хромовый ангидрид
Материалы —пластмассы, резину и др. Однако расход энергии в барботажных кристаллизаторах в несколько раз больше, чем в вакуум-кристаллизаторах193.