Технология минеральных солей (удоБрений, пестицидов, промышленных солей, окислов и кислот)
Наполнители в с одо в о-хромитной шихте
Составные части шихты и кислород газовой фазы образуют гетерогенную систему. Скорость реакции в такой системе зависит от развития межфазной поверхности. Поэтому большое значение; имеет тонкость помола хромита. То обстоятельство, что сода нахо дится в жидкой фазе, значительно ускоряет процесс, — в этих ус ловиях частицы хромита смачиваются расплавом, содержащи соду, и реакционная поверхность увеличивается во много раз. Правда, при наличии жидкой фазы, обволакивающей твердую частицу, газообразный компонент должен диффундировать через пленку жидкости. Тем не менее наличие ограниченного количества жидкой фазы сильно ускоряет процесс. При большом же количестве жидкой фазы происходит спекание шихты, налипание ее на стенки печи, что мешает ее продвижению, затрудняет доступ кислорода к реагирующим частицам руды из-за слипания их в крупные комья. В результате этого процесс сильно замедляется, и выход хромата понижается89. При относительно низких температурах, когда количество расплава в шихте невелико, происходит, по-видимому, непосредственное окисление окиси хрома газообразным кислородом; выше же 900° окисление идет с участием расплава, в котором возрастает содержание реакционно-способных частиц—ионов кислорода, образующихся в результате диссоциации карбоната и хромата натрия и при посредстве промежуточных веществ — ферра - та(1У) и, вероятно, перекиси натрия. При большем содержании ■окиси железа в шихте ее положительное влияние, как передатчика кислорода через феррат(1У) натрия уменьшается и не компенсирует ухудшение процесса вследствие уменьшения концентрации основных реагентов — Сгг03 и ЫагС03; при этом затрудняется и образование феррата натрия90.
Твердые составные части шихты хорошо смачиваются образующейся в процессе прокалки жидкой фазой89. Помимо поверхностного смачивания, под влиянием капиллярных сил происходит почти полное заполнение пор между отдельными частицами материалов. В разных стадиях обжига твердые фазы удерживают 0.1 f»— 0,35 г расплава на 1 г твердого вещества. Во избежание спекания реакционной массы в шихту необходимо добавлять какие-либо тонкоизмельченные вещества (их обычно называют наполнителями, хотя они и не являются инертными компонентами) в таком количестве, чтобы слой жидкой фазы на поверхности твердых частиц был очень тонким 91~93. В реальных соотношениях компонентов в хромитовой шихте толщина жидкой пленки на поверхности твердых частиц не превышает 1 мк. В этих условиях шихта остается практически сухой, рассыпчатой, легко подвижной, не спекается и обладает большой газопроницаемостью. Однако при этом поверхность добавки удерживает часть жидкой фазы и использование последней может быть обеспечено только при условии хорошего перемешивания шихты, что и осуществляется в реакционных прокалочных печах.
Таким образом, добавка наполнителя к шихте приводит, с одной стороны, к положительному эффекту, уменьшая толщину жидкой пленки на поверхности частиц, а с другой — к отрицательному, устраняя часть жидкой фазы с реакционной поверхности хромита. Очевидно, что существует оптимальное соотношение между количеством хромитовой руды и наполнителем, при котором полезный эффект от введения наполнителя оказывается максимальным. Максимальное окисление наблюдается при содержании в шихте 16,2— 16,5% СггОз. С повышением температуры диапазон концентраций Сгг03 в шихте, при которых достигается максимальное окисление, расширяется. При 1200° степень окисления практически одинакова для шихт, содержащих от 12 до 19,5% окиси хрома94'95.
Среди доступных реальных наполнителей отсутствуют такие твердые вещества, которые в условиях высокотемпературного прокаливания хромитовой шихты были бы инертными ко всем компонентам шихты. Это обусловливает протекание побочных реакций, сопровождающих основную реакцию образования монохромата натрия. Из ряда возможных наполнителей — СаО, CaC03, MgO, MgC03, РегОз, AI2O3, Si02 — наилучшим из простых является известковый (жженая известь, мел или известняк), а из комбинированных, как показал производственный опыт, доломит (MgC03 • CaCOs) и его смесь с известняком 95~97. Положительная роль извести заключается в том, что окись кальция вытесняет окись натрия из феррита, алюмината и силиката натрия, образовавшихся из компонентов шихты; освобождающаяся же окись натрия образует хромат натрия, выход которого поэтому увеличивается. Но вместе с тем работа с доломитовым и известковым на^ полните'лями предопределяет и появление в прокаливаемой шихте хромата кальция. Хромат магния практически не образуется, так как это соединение разлагается выше 500°, и около 90% MgO, содержащейся в прокаленной шцхте, находится в свободном состоянии. Давление диссоциации MgCr04, равное 1 ат, достигается уже при -535°; [lg/> (в мм рт. ст) = 23,271 — 16488/7]. Термическое разложение MgCr04 сопровождается образованием вначале неустойчивого 2MgO-Cr2C>3, постепенно разлагающегося на MgO и MgO-СггОз98. Вследствие высокого давления диссоциации при сравнительно низких температурах MgCr04 не может находиться в прокаленной шихте. Для полного же разложения СаСг04 требуется очень высокая температура. Чистый хромат кальция при нагревании на воздухе начинает заметно разлагаться при температуре около 1000° с выделением кислорода. В присутствии 0,1 моль СаО разложение ускоряется уже при 800°. Однако даже при нагревании в течение 4 ч при 1300° хромат кальция полностью не разлагается99. В заводских условиях максимальная температура Прокалки шихты обычно не превышает 1200° и содержание СаСг04 в прокаленной шихте составляет 5—8% от получаемого хромата натрия.
Хроматы кальция образуются из окиси хрома и окиси кальция при нагревании их на воздухе при 600—1000°. При молярном отношении СаО: Сг203 от 2 до 3 вся окись хрома практически окисляется уже при 600—700° за 2 ч и переходит в СаСг04 и оксихро - миты кальция. Оксихромиты также интенсивно окисляются. При 600—700° за 2 ч монохромит СаО • Сг20з окисляется на 2/3, давая смесь 2СаСг04 + Сг203, двухкальциевый оксихромит 2Са0-Сг205 окисляется полностью с образованием СаСг04, а трехкальциевый оксихромит ЗСа0-Сг205 окисляется на 75% с образованием ЗСаО-2СгО310°-105.
Хромат кальция выше 1000° диссоциирует с образованием хро - мито-хроматов95-104>106, например, по реакции
12СаСг04 = 3(СаО • Сг203) + 9СаО • 4CrOs • Crs03 + 602
В присутствии свободной извести хромито-хромат ©бразуется по реакциям:
3MgCr204 + 9СаО + 302 = 9СаО • 4Сг03 • Сг203 + 3MgO 3PeCr204 + 9СаО + 3,7502 = 9СаО • 4Сг03 • Сг203 + I,5Fe203
Из других хромито-хроматов кальция в прокаленной шихте вероятно присутствие ЗСаО • 2Сг03 • 2Сг203.
При не очень высоких температурах хромито-хроматы окисляются кислородом с образованием СаСг04, например 9СаО • 4Сг03 • Сг203 + 1,502 = 6СаСг04 + ЗСаО
Окись кальция расходуется также на образование клинкерных минералов — алюмоферритов (браунмиллерита 4СаО • А1203 • Fe203 и др.), алюминатов кальция—12Са0-7А1203 (которому раньше приписывали формулу 5Са0-ЗА1203) и других, дикальциевого силиката 0-2CaO-SiO2, феррита кальция 2Ca0-Fe203. Количество ее должно быть достаточным для связывания Al203, Fe203, Si02.
При прокаливании шихты, содержащей соду, она реагирует с хромит-хроматами даже при 600°. Это послужило основанием для предложения способа переработки хромита, заключающегося в предварительном получении Хромит-хромата кальция при 1000° с последующей обработкой полупродукта содой при 600—700°. В этом способе исключается необходимость в наполнителе (окиси магния, доломите), а следовательно, уменьшается количество отбросов, которое при возврате окиси кальция в процесс становится незначительным 107.
При применении в качестве наполнителя доломита количество остающегося в прокаленной шихте хромата кальция значительно меньше, чем при известковой шихте. Кроме того, доломитовая шихта меньше спекается. Оплавление шихты при замене доломита карбонатом кальция связано с образованием карбонатной эвтектики86. Преимуществом доломита, который содержит 52—54% СаСОз и 30—40% MgC03, является то, что диссоциация карбонатов здесь происходит по всей реакционной зоне печи, в температурном интервале от 650 до 1100°108'109. При нагревании доломита в пределах 650—750° происходит выделение С02 из MgC03, а в пределах 800—1100° — из СаСОз. Это обеспечивает сравнительно равномерное выделение С02 из шихты по всей длине печи. Скорость разложения известняка и магнезита определяется диффузионной кинетикой и зависит от скорости прохождения газа через слой карбоната. При увеличении скорости газа до 7—8 м/сек скорость разложения карбонатов возрастает, затем процесс контролируется химической кинетикой и дальнейшее увеличение скорости газа не вызывает интенсификации разложения. Скорость же разложения доломита практически не зависит от скорости газа, так как процесс контролируется не диффузионной, а химической кинетикой уже при малых скоростях газа в конвективном потоке110. Выделяющийся углекислый газ, пронизывая шихту снизу вверх, производит ее перемешивание и обеспечивает ее рыхлость, что облегчает доступ кислорода к нижним слоям реагирующей массы.
Лабораторными опытами установлено, что еще лучшим напол - ' Нителем, чем карбонат кальция и доломит, является карбонат бария 111.
Как уже указывалось выше, максимальный полезный эффект от введения в шихту наполнителя, дающий наибольший выход водорастворимых хроматов, соответствует определенному оптимальному содержанию наполнителя в шихте95. На рис. 172 показана кривая зависимости выхода водорастворимых хроматов от соотношения йежду Na2C03 и СаО, при содержании в шихте 15% Сг20з (в виде 34,9%-ной руды), при прокаливании в течение 30 мин При 1000°. Максимальный выход соответствует соотношению Na2C03:Ca0, равному 60:40. Увеличение общего содержания ^гг03 в шихте с 16 до 20% нли частичная замена доломита окисью
Или карбонатом магния не влияет на окисление, если имеется достаточно СаО для связывания кислотных окислов. При недостатке СаО степень окисления хромита снижается. То же относится и к влиянию нерудных компонентов хромита, содержащих, кроме MgO, главным образом окислы алюминия, железа и кремния,— изменение их количества не влияет на предельную степень окисления хромита, если содержание СаО достаточно для связывания кислотных окислов
112
А продолжительность прокалки велика. В промышленных условиях влияние их заметно. Следует отметить, что в шихтах, содержащих мало соды и много извести, обнаруживается повышенный против теоретического выход водорастворимых хроматов. Пунктирная прямая AN (рис. 172) показывает стехиометрическое количество соды, необходимое для перевода окиси хрома в хромат натрия. Точка В соответствует количеству соды, равному 100% от стехиометрического. Кривая выхода в правой части диаграммы лежит выше стехиометрической прямой AN. Как видно из расположения кривой, степень использования соды в присутствии СаО (или СаСОз) может достичь — 140%. Это связано с переходом хромат-иона в раствор не только в виде хромата натрия, но и в виде некоторого количества хромата кальция. Растворимость безводного хромата кальция в воде равна 4,3% при 0°, 1,11% при 50° и 0,42% при 100°.
При выщелачивании прокаленной шихты большим количеством воды в раствор переходит заметное количество СаСг04, что и дает повышенную цифру выхода. При применении неизвестковых наполнителей кривая выхода растворимого хромата лежит всегда ниже стехиометрической линии AN.
|
ЮО |
|
- |
|
|
\ |
|
|
\ |
|
|
\ |
|
|
\ |
|
|
Д |
|
|
\ |
|
|
1 |
В |
|
80 |
|
Na2C03 |
|
50 Вес.% |
|
СаО |
|
Рис. 172. Кривая выхода водорастворимых хроматов в присутствии СаО. |
|
О Н |
Выход хроматов зависит не только от состава нерудной части шихты, но, естественно, и от состава руды95. Различные руды окисляются с разной скоростью. Быстрее окисляются руды с малым содержанием А1 и Fe2+. Бедные руды, содержащие меньше 30% СггОз, дают наибольший выход хроматов при прокаливании в смеси с одной содой. Частичная замена ее в шихте карбонатами кальция и магния снижает выход. Степень окисления хрома г> шихте, содержащей повышенные количества S1O2, меньше, чем для
железистой руды или руды, не содержащей каких-либо примесей. Помимо химического состава на реакционную способность разных хромитовых руд влияют и их физико-химические свойства89'93> чз-п5_
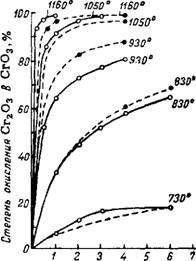
Процесс образования хромата из хромита является эндотермическим и требует затраты значительных количеств тепла П6. Чем более высок температурный уровень прокаливания шихты, тем быстрее идет окисление. На рис. 173 показана зависимость степени окисления СггОз в СгОз от продолжительности прокаливания при разных температурах при известковой (пунктирные линии) и Доломитовой шихте (сплошные линии)117.
Применявшийся для опытов хромит содержал: 44,61% Cr2Os, 24,28% FeO, 9,86% А1203, 4,04% Si02; обожженная известь содержала: 90% СаО, 6,43% MgO И 2,04% Al203 + Fe203. Исходные вещества смешивали в соотношении хромит : известь : сода, равном 1:1:0,64. При составлении доломитовой шихты применялся обожженный доломит, содержавший 65,04% СаО, 29,7% MgO И 4,2% Si02.
Из диаграммы видно, что равная степень окисления при высоких температурах достигается на доломитовой шихте быстрее, чем на известковой. Работа на доломитовой шихте дает более благоприятные результаты и в отношении степени перехода CrOj в раствор при последующем выщелачивании прокаленной шихты.
Скорость и степень окисления хромитовой шихты зависят от интенсивности поглощения кислорода из газовой фазы, в частности от концентрации кислорода в газе. При обжиге хромита в смеси с содой и доломитом содержание кислорода в выходящем Из печи газе должно быть не ниже 7,5—10% 118.
|
Продолжительность прокаливания, ч Рис. 173. Зависимость степени окисления хромита в хромат от продолжительности прокаливания шихты. |
Скорость процесса зависит также от активности образующейся йри диссоциации карбонатов окиси кальция. Наличие примесей в карбонатных наполнителях приводит к образованию неактивной извести. Если в карбонатном сырье содержится меньше 3% примесей, то заметное количество неактивной окиси кальция образуется лишь при температурах выше 1350°119. О кинетике окисления хромитовых шихт см. также99' 1го-1М.