Кинетика гомогенных процессов
КИНЕТИКА ХИМИЧЕСКИХ И ДИФФУЗИОННЫХ ПРОЦЕССОВ
Сварка металлов плавлением представляет собой высокотемпературный быстропротекающий процесс, сопровождающийся химическими реакциями между металлом и средой (атмосфера дугового промежутка, шлаки, полученные плавлением флюсов или электродных покрытий), а также диффузионными процессами, особенно интенсивно развивающимися при высоких температурах (например, диффузионное соединение металлов в вакууме, предложенное Н. Ф. Казаковым).
Скорости химических реакций и диффузионных процессов характеризуются изменением концентрации вещества во времени, т. е. изменением числа частиц в единице объема в единицу времени.
При химических реакциях атомы нли молекулы веществ, вступающих в реакцию, должны войти в тесное соприкосновение — столкновение, перестроить свои атомные или молекулярные орбитали, с тем чтобы они могли образовать новые химические связи н построить новые молекулы продуктов реакции. В результате этого взаимодействия концентрация начальных продуктов будет уменьшаться, а конечных — увеличиваться. Химические реакции могут быть необратимыми, т. е. идущими только в одном направлении, но могут быть и обратимыми, направление которых будет зависеть от внешних условий — р, Т, С. Обратимые реакции не доходят до конца, а только до состояния равновесия (см. п. 8.3, 8.4).
Условия для столкновения реагирующих частиц между собой будут меняться в зависимости от фазового строения реагирующей системы, т. е. от ее гомо - или гетерогенности.
|
Скорость химической реакции определяется изменением концентрации в единицу времени, т. е. числом появившихся в единице объема новых или исчезнувших старых молекул в единицу времени. |
По типу развития химических реакций их можно разделить согласно предлагаемой схеме:
|
Химические реакции
|
Число частиц в единице объема определяет при данной температуре число столкновений и, следовательно, будет связано со скоростью химической реакции уравнением
д=КЬС/Ы, (8.94)
где v — средняя скорость реакции; К — константа скорости; С — концентрация реагирующих молекул; t — время.
Так как концентрация молекул, вступающих в реакцию, уменьшается, а скорость реакции тоже переменна, то истинная скорость реакции будет представлять собой первую производную от концентрации по времени:
v = KdC/dt. (8.95)
При диффузионных процессах также происходит изменение концентрации одного вещества — диффузанта вследствие проникновения его в среду, заполненную другим веществом. Движущей силой изотермической диффузии будет градиент концентраций, и диффузия всегда направлена от большей концентрации к меньшей.
Задача о диффузии в газовой среде решается методами кинетической теории газов, так как в этом случае не требуется особой энергии активации для проникновения одного газа в другой. Если диффузия происходит в конденсированных фазах (жидкая, твердая), то в этом случае для перемещения частиц диффузанта требуется энергия активации, так как в жидкости и в кристалле частицы между собой связаны значительной энергией межатомного или межмолекулярного взаимодействия, находясь на малых расстояниях друг от друга. Скорость диффузии в этом случае будет значительно меньше.
При переходе диффундирующих атомов границы раздела двух фаз (например, из жидкой в твердую нли наоборот) необходимо учитывать коэффициент распределения, так как равновесные концентрации в данном случае не будут равны между собой. Такой процесс называют гетеродиффузией.
ЭНЕРГИЯ АКТИВАЦИИ И ЗАВИСИМОСТЬ
ПРОЦЕССОВ ОТ ТЕМПЕРАТУРЫ
Энергией активации называется энергия, необходимая для приведения одного моля реагирующих веществ в реакционноспособное состояние.
Эта энергетическая функция обобщает все вопросы строения и состава реагирующих веществ и способов их возбуждения (термическое, радиационное, электронный удар). Таким образом, далеко не все столкновения молекул реагирующих веществ будут активными, а только те, которые будут обладать энергией, равной или большей энергии активации.
Для гомогенных реакций в газовой фазе можно использовать уравнение Максвелла — Больцмана для распределения энергий в объеме газа при данной температуре:
п/п 0=вн—« (8.96)
где п — число молекул, обладающих энергией є, превышающей наиболее вероятное значение энергии ео; «о — число молекул, обладающих наиболее вероятным запасом энергии ео; k — постоянная Больцмана; Т — температура.
Из уравнения видно, что чем больше разность значений е — 60, тем меньше будет отношение п/по н тем меньше будет число активных молекул п. Прн повышении температуры отношение п/по будет расти и число активных молекул будет увеличиваться, т. е. будет расти константа скорости химической реакции К [уравнение (8.94)].
С. Аррениус и Я. Вант-Гофф независимо друг от друга пришли к уравнению, связывающему константу скорости, температуру и энергию активации, причем это уравнение построено по типу уравнения Максвелла — Больцмана:
Кт=Кое~А/т, (8.97)
где Кт — константа скорости химической реакции; Ко — постоянный коэффициент; А — энергия активации; R — газовая постоянная; Т — температура.
Если А —оо, т. е. энергия активации очень велика, то Кт—►О, или реакции, требующие высоких значений энергии активации, идут с малой скоростью, так как активные столкновения маловероятны. Наоборот, если А—>0, то Кт-~Ко, пропорциональному общему числу столкновений, т. е. скорость химической реакции будет очень большой, так как почти каждое столкновение будет активным.
Как правило, энергия активации определяется экспериментально, путем определения констант скорости при нескольких температурах-
1п Кті= ІП Ко — A/(RTi) In Кт2= In Ko-A/(RT2); вычитая эти уравнения друг из друга, получим
1п(Кл//Ст2)=(А/Я) (—і/Гі + 1/Г2)=А(7'1 - Г2)/(/гГ, ГЙ(Я.98)
Влияние температуры на скорость химических реакций. Если Т->■ оо, то Кт->-Ка, т. е. константа Кт сильно растет (экспоненциально) и при температурах процессов сварки металлов плавлением (103...104 К) скорости взаимодействия будут очень велики и будут приближать состояние к равновесному, которое рассчитывается методами химической термодинамики.
Катализ и катализаторы. Катализом называется процесс изменения энергии активации с целью изменения скорости химических реакций при той же температуре путем введения в реакционную среду катализаторов.
Катализаторами называются вещества, которые ускоряют химическую реакцию (положительные) или снижают ее скорость (отрицательные), но сами й результате химической реакции остаются неизменными.
Если катализатор находится в той же фазе, что и участвующие в химической реакции вещества, то катализ называют гомогенным, а если катализатор находится в другой фазе и свое каталитическое действие оказывает своим поверхностным слоем (твердое тело), то гетерогенным.
Гомогенный катализ по существу сводится к замене одной реакции, идущей с большой энергией активации, двумя или тремя (с участием катализатора, в результате выделяющегося в прежнем состоянии), но требующих меньшей энергии активации:
1. А + В — АВ А,.
2. А + К^АК А2<А,
3. АК. + В—AB-fK Аз<Аь
где К — катализатор.
Энергии активации реакций 2 и 3 меньше, чем реакции 1, поэтому скорость превращения веществ А и В в АВ будет значительно выше. Каталитирующее действие в данном случае будет зависеть от концентрации катализатора, так как он по существу служит реагентом.
Гетерогенный катализ происходит на границах раздела твердое тело — газ или твердое тело — жидкая фаза (раствор). Механизм каталитического воздействия поверхности твердого тела заключается в адсорбции на поверхности катализатора реагирующих между собой молекул, в результате чего их концентрация в поверхностном слое возрастает на несколько порядков, а под действием энергии адсорбции ослабляются связи между частицами, составляющими молекулы, и, следовательно, снижается энергия активации. Не исключено и химическое взаимодействие между молекулами реагирующих веществ и адсорбента, т. е. катализатора (топохимнческие соединения). Высокоактивные катализаторы этого типа — тонко раздробленные металлы, нанесенные на какую-либо подложку, например, платинированный асбест, серебро или палладий, нанесенные на цеолиты, тонко раздробленный никель и т. д.
Каталитическая активность находится в прямой связи с площадью поверхности катализатора.
Некоторые данные о снижении энергии активации химических реакций в присутствии катализатора приведены в табл. 8.8.
Энергии активации диффузионных процессов, как видно, ниже энергии активации химических реакций ввиду того, что молекулы или атомы при диффузии не изменяют своего строения. В данном случае энергия активации будет определяться диффузионной средой и ее строением. Особенно высоки значения энергии активации прн диффузии в твердых металлах и других кристаллических веществах. В твердом теле диффузия может происходить
|
Реакция |
Катализатор |
Энергия активации, кДж - моль-1 |
|
|
в газовой фазе |
каталитический процесс |
||
|
N2O —- N2 - р V2O2 |
Аи |
244,9 |
121,0 |
|
С2Н4 + Н2 С2Н6 |
Си |
182,0 |
-50,0 |
|
Pt; Pd; Ni |
182,0 |
42,0 |
по объему кристаллического зерна путем замены одного атома в кристаллической решетке другим, но этот путь требует очень высоких энергий активаций, соизмеримых с энергией кристаллической решетки. Например, торий диффундирует в вольфраме объемно, требуя энергии активации 502 кДж/моль. Если диффузия идет по границам зерен, где имеется много нарушений кристаллической структуры — вакансий и дислокаций, то энергия активации составляет 393,5 кДж/моль. При поверхностной диффузии тория по вольфраму энергия активации составляет всего 278 кДж/моль (торирование вольфрама). Соответственно резко изменяются коэффициенты диффузии, так как уравнение для коэффициента диффузии аналогично уравнению константы скорости химической реакции в зависимости от температуры:
Dr=D0e-WRT (8.99)
где DT—коэффициент диффузии при данной температуре 7; Do — постоянный коэффициент; Q — энергия активации диффузии.
Диффузия — необратимый процесс, связанный с большим ростом энтропии, и ее возникновение и развитие, особенно в области высоких температур при сварке, неизбежно.
УРАВНЕНИЯ СКОРОСТЕЙ ХИМИЧЕСКИХ РЕАКЦИЙ
В зависимости от количества реагирующих между собой веществ дифференциальные уравнения скоростей химических реакций будут различаться между собой.
Реакции первого порядка (мономолекулярные)
АВ->-А+ В;
•а х х vi=dx/dt=Ki(a — x), (8.100)
где Ki — константа скорости мономолекулярной реакции, представляющая собой функцию температуры и природы реагирующих веществ; t — время; а — начальная концентрация вещества АВ.
Реакции второго порядка (бимолекулярные)
А + В-^АВ;
а Ь х
V2=dx/dt—Ki(a — x)(b—x), (8.101)
где Кг — константа скорости бимолекулярной реакции, зависящая кроме температуры и природы реагирующих веществ от способа выражения концентраций; а н b — начальные концентрации веществ А и В.
Таким образом, порядок реакции соответствует показателю степени, в который входит значение концентрации в уравнение скорости химических реакций.
Реакции высоких порядков (3 и более) встречаются редко, так как в этом случае вероятность одновременного избирательного столкновения трех н более молекул становится малой величиной. Фактически сложные реакции идут через промежуточные стадии, а общую скорость процесса определяет наиболее медленно развивающаяся стадия, так как пока она не завершится, остальные стаднн развиваться не могут. Этн элементарные акты химического взаимодействия обычно идут по первому или второму порядку. Решение уравнений любого порядка всегда возможно, так как при t—0, х=0 и постоянные интегрирования легко определить.
Решение кинетического уравнения для реакций первого порядка
dx/dt= Кі(а — х); разделяем переменные и интегрируем:
dx/(a — x)=KidT; -n(a-—x)—Kit-{-C;
при *=0 х—0 и постоянная интегрирования С=— 1па.
Подставляем'значение постоянной интегрирования и получаем
In [a/(a-x)] = Kit, (8.102)
где К — константа скорости первого порядка.
Исследуем полученное выражение:
при х—»а /—► оо, т. е. реакции заканчиваются через бесконечно большое время, фактически тогда, когда современными аналитическими методами уже нельзя уловить изменений в составе системы;
при х—а/2
<о,5=(1/Аі)1п2 =0,693/Аь (8.103)
где to,5 — время, необходимое для превращения половины реагирующего вещества, называемое «периодом полураспада» (или половинным временем).
Для реакций первого порядка оно зависит только от температуры и природы реагирующих веществ. Это уравнение точно описывает ход радиоактивного распада;
решаем уравнение (8.102) относительно концентрации распадающегося вещества х;
|
(8.104) |
а[{а — х)=ек' х=а{
Это уравнение позволяет получать информацию о концентрации распадающегося вещества по времени:
а) /=0 *=0, т. е. реакция не начиналась;
б) t=оо х=а—реакция дошла до конца;
в) х=0,5 a <o,5=(l//(i)ln2.
Реакции первого порядка особенно характерны для высоких температур — это диссоциация молекул или ионизация атомов: Н2—2Н; Н2—-Н2М-Є; Н-*Н+ + е, и т. д.
Кривые изменения х во времени при различных значениях Кі приведены на рис. 8.17. На графике указаны также значення периодов полураспада (половинных времен).
Решение кинетического уравнения для реакций второго порядка
dx/dt=K2(a — x)(b — x).
Решаем это дифференциальное уравнение с помощью произвольных коэффициентов и после подстановки постоянной интегрирования, полученной при условии *=0; *=0, окончательно имеем
|
-[6] с-1) |
Исследуем полученное выражение: константа скорости реакции второго порядка зависит от концентрации (Г
|
0,3 0,8 0,7 0,0 0,5 0Л 0,5 01 01 |
|
-АВ; х |
К2 =
Ка
прн а= b уравнение превращается в неопределенность и для случая равных концентраций реагирующих веществ требуется иное уравнение:
А + В - а а
|
H=J у. |
ҐК=0,5 |
|||||
|
Х=0,5а |
||||||
|
7/ / Т2 |
|
5 t, c |
|
Рис. 8.17. Изменение количества полученного вещества х во времени для различных значений константы скорости |
Окончательное решение этого уравнения K2t=—
а— х а а выражение константы скорости.
*2=4- —, (8.108)
/ а а—х ' '
причем размерность скорости сохраняется (t~l, с-1);
для условия равных концентраций для реакции п-го порядка уравнения скорости
dx/dt = KJa — xf. (8.109).
Уравнение (8.109) применяется, в частности, при экспериментальном определении порядка той или иной реакции.
Следует указать, что под влиянием катализаторов порядок реакции может измениться. Так, диссоциация аммиака идет в газовой фазе по уравнению второго порядка, а при каталитическом действии твердого ванадия реакция идет по нулевому порядку, т. е. без влияния концентрации реагента, она остается как бы постоянной величиной. Решение уравнений для расчета обратимых гомогенных реакций не рассматриваем ввиду их большой сложности и сравнительно узкого применения таких расчетов.
УРАВНЕНИЕ КОНЦЕНТРАЦИОННОЙ ДИФФУЗИИ
Процессы переноса вещества путем диффузии связаны с наличием градиента концентраций диффундирующего вещества в среде, заполненной другим веществом. Процессы диффузии описываются уравнениями законов Фика:
dm — — D(dc/dx)Sdt; I
* ЛСЛ* /Л 2Ч <8Л1°)
~=D(dh/dx2), ]
где т — количество продиффундировавшегося вещества; S— площадь сечения диффузионного потока; t — время; dc/dx — градиент концентраций, отрицательный потому, что диффузия идет от большей концентрации к меньшей; D — коэффициент пропорциональности или коэффициент диффузии.
Интеграл второго уравнения системы (8.110), т. е. второго закона Фика, будет равен для бесконечно длинного цилиндра при взаимной диффузии двух газов следующему выражению:
/тт
с'-=т—-I S ‘-^тО-Ч-тйг)! (8ЛИ)
где Со — концентрация в начале процесса диффузии в сечении трубы О—О; <f[x/-j4Dt] — функция, значение которой можно взять из справочника по значениям функций Фурье — Фика.
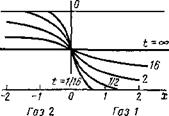
На рис. 8.18 представлено решение этого уравнения в виде изо - хрон концентраций (линий для постоянного значения времени), причем с увеличением времени при данном значении х (расстояние от начального сечения) концентрация возрастает и стремится к значению Со/2. Расчет развития диффузионных процессов на основании второго закона Фика сохраняется для жидких и для твердых сред, но коэффициенты диффузии будут значительно меньше, чем для газообразных систем.
|
Рис. 8.18. Решение уравнения Фика для взаимной диффузии двух газов в бесконечном цилиндре в зависимости от времени |
Для газообразных систем коэффициенты диффузии вычисляют на основании кинетической теории газов:
й=Ш/ 3, (8.112)
средняя скорость движе-
где К — длина свободного пробега; и ■ ния газовых молекул.
Как видно из уравнения (8.110), размерность коэффициента диффузии сохраняется (м2-с-1).
Некоторые значения коэффициентов диффузии газов приведены в табл. 8.9.
Коэффициенты диффузии в жидкостях на несколько порядков меньше, чем в газах, например коэффициент диффузии магния в жидком алюминии при 973 К составляет 7,54-10~9 м2-с~1, а коэффициент диффузии NaNC>3 в расплавленном KNO3 при 633 К составляет 5,22 • 10~9 м2-с-1.
Коэффициенты диффузии в жидкостях могут быть рассчитаны по уравнению Стокса:
D = -=&-, (8.113)
олцг v ’
где k — постоянная Больцмана; Т — температура; к] — коэффициент вязкости среды; г — раднус частицы.
|
Таблица 8.9. Коэффициенты диффузии в газах
|
Для твердых кристаллических тел коэффициенты диффузии еще меньше. Например, алюминий, диффундирующий в твердую медь, при температуре 1123 К имеет коэффициент диффузии £ = 2,19ХКГ13 м2-с-1.
Высокая энергия активации диффузии в твердых телах делает коэффициенты диффузии очень малыми согласно уравнению (8.99).
Некоторые данные о константах в этом уравнении приведены в табл. 8.10.
|
Таблица 8.10 Значения постоянных в уравнениях коэффициентов диффузии в твердых металлах
|
Помимо изотермической диффузии, описываемой уравнениями законов Фика (8.110), перенос атомов может возникнуть под действием различных температур, т. е. в неоднородном температурном поле. Такая неизотермическая диффузия может вызвать перераспределение или сегрегацию компонентов сплава в температурном поле, созданном термическим циклом сварки. Это будет особенно заметно для элементов, обладающих высокой подвижностью, например, для водорода Н.