Золи
Наиболее высокомодульными щелочными силикатами являются стабилизированные кремнезоли. Это дисперсные системы с низкой вязкостью и клейкостью. Раствор с содержанием Si02 более 10% при размерах частиц до 7 нм прозрачен, выше 50 нм — молочный; выше 100 нм наблюдается седиментация. Точка нулевого заряда частиц кремнезема находится в области рН, близкой к двум, и в щелочных средах заряд частиц отрицателен. Отрицательный заряд частиц можно рассматривать как результат адсорбции гидроксильных ионов на кремнеземе или как результат взаимодействия поверхностных групп —ОН с ионами гидроксила:
= Si0H+0H~->-H20+ = Si0-
Хемосорбция многозарядных катионов иа частицах способна изменить не только величину заряда поверхности, но и ее знак. Заряд частиц придает стабильность частицам, предотвращая их взаимодействие.
Поскольку золь представляет собой также насыщенный при том или ином рН раствор кремнезема, необходимо сказать о его Растворимости. Аморфный кремнезем растворяется в воде при 25 °С в количестве 0,0070—0,0150%. Такая разница (более чем в два раза), обусловливается различием состояния поверхности и микропримесями. Растворимость кристаллических форм суще - Ственно ниже. Минимуму растворимости отвечает рН несколько больше семи. В этом случае в равновесии с аморфным кремнеземом находится практически мономерная неионизированная фор - ма кремнезема, поскольку концентрации ионных форм, определение по известным константам диссоциации Si(OH)4, по порядку Величин несопоставимы. С увеличением рН до 10 растворимость кРемнезема повышается за счет именно ионных форм в соответствии с термодинамическими константами равновесия. С ростом температуры растворимость Si02 растет, увеличиваясь в интервале от 25 до 100 °С примерно в 3 раза, и может быть описана уравне. ниєм' 1 g С=—810/74-4,82, где Т — абсолютная температура. С — концентрация Si02, мг на 1 кг раствора. При температуре вы' ше 200 °С растворимость кремнезема понижается в связи с медлен, ной кристаллизацией аморфного кремнезема в гидротермальных условиях. Гидратированные формы кремнезема имеют существен - но меньшую растворимость, чем безводные или гидратированные только с поверхности. Это изменение можно примерно оценить из сопоставления растворимости кремнезема (% Si02) различ - ной степени гидратации [2]:
Si02-2,5H20—0,0018; Si02• 2,0Н2О—0,0044; Si02-1,5Н20—0,0058;
Si02- 1,0Н2О—0,0061; Si02• 0,5Н20—0,0120.
Гидратированные формы кремнезема образуются при температуре ниже 70 °С. Растворимость кремнезема, как и других веществ, зависит от кривизны поверхности. Увеличение растворимости с кривизной особенно велико для частиц малых размеров (меньше 2—3 нм) и падает до нуля для частиц диаметром больше 15— 20 нм. Скорость растворения кремнезема в воде в области рН 3—7 пропорциональна концентрации ионов гидроксила, но при более высоких рН эта связь ослабевает.
И на скорость растворения, и на растворимость кремнезема сильно влияет присутствие ионов алюминия, в меньшей степени — ионов Fe (III). Если не рассматривать экзотические способы образования золей (такие как диспергирование гелей или пирогенио - го кремнезема в слабых щелочных растворах), то основным способом производства золей нужно считать полимеризацию мономерного кремнезема, который можно получить, например, пропуская раствор силиката через слой катионита в Н+-форме. Эта полимеризация или, точнее, поликонденсация с образованием силоксано - вой связи, происходит при участии ионных форм:
= Si0H+-0Si=-^0H-+^Si-0— Si=;
= SiOH+0Н--^Н20 + S SiO".
Уже при низких степенях полимеризации происходит образование циклических форм, сшивание циклов в параллельных плоскостям и появление объемных структур с последующим ростом до образования дисперсной частицы кремнезема. В общем случае образовавшиеся частицы взаимодействуют-друг с другом в зависимости от условий, приводя к коагуляции кремнезема или образованию геля. Если агрегирование частиц предотвратить тем илв иным способом, то они будут продолжать расти до некоторой величины. Этого можно добиться, не допуская возрастания концентрации электролита в растворе выше 0,05—0,1 н и повышая р^ раствора до 8—9 добавлением щелочи. Так как при полимеризации мономерного кремнезема образуются частицы разных размеров, главным образом 1—2 нм, то после исчерпания мономера 0 системе станут заметными процессы укрупнения частиц из-за различия в их растворимости: мелкие частицы растворяются, а крупные увеличиваются в размере. Это будет продолжаться до тех пор, пока не останутся частицы кремнезема, весьма мало различимые по растворимости, т. е. по размерам. Табл. 14 дает представление о размерах частиц кремнезема, полученных при различных условиях.
|
Таблица 14. Рост частиц кремнезема при нагревании 4%-ного золя кремневой кислоты, стабилизированного NaOH при рН 8—10 [2]
|
Данные, приведенные в табл. 14, показывают, что размер образующихся частиц зависит прежде всего от температуры. При низких температурах (ниже 25 °С) медленный рост частиц продолжается несколько месяцев, и размер частиц в конечном итоге не превышает 6 нм. Получение крупнодисперсных золей требует высокой температуры и низкой щелочности. Если щелочность становится выше допустимой, то при />300 °С в автоклаве образуются кристаллы кварца. При формировании золя необходимое время нагревания с увеличением температуры падает и в дальнейшем рост частиц останавливается. При заданной температуре Увеличение щелочности системы приводит к уменьшению конечных Размеров частиц. Выше 80 °С частицы кремнезема получаются Практически безводными с плотностью около 2,2 г/см3, в то время как при низких температурах полимеризующийся кремнезем продолжает оставаться гидратированным изнутри.
Основные технологические приемы производства золей сводятся к следующему. При получении мономерного кремнезема через Понообменник пропускают разбавленный раствор силиката натрия (^4% S1O2).. и в дальнейшем требуется его концентрирование, что достигается выпариванием. Эту операцию сочетают с выращива нием золя до нужных размеров. Для этого в малой части раствор; кремнезема при выпаривании формируется золь с частицами не большого размера. Затем к этому золю непрерывно по мере испа. рения воды добавляют исходный раствор малополимеризованног( кремнезема (золь-питатель), который получается на выходе и - ионообменника после добавления небольшого количества щелочи За счет различия в растворимости частиц разного размера вновь вводимый кремнезем переосаждается на крупных, ранее сформиро вавшихся частицах. Следовательно, скорость выпаривания долж, на быть соразмерна скорости роста частиц. Если золь-питатель вводят стабилизированным щелочью, то рН раствора по мере выпаривания увеличивается и рост частиц прекращается. Чтобк избежать этого, для выращивания крупнодисперсных золей в золь питатель щелочь не добавляют; тогда рН в выпариваемой системе меняется незначительно. Скорость подачи золя-питателя регулируется обычно по программе в соответствии с меняющейся В системе концентрацией кремнезема и его поверхностью, чтобы предотвратить возникновение новых центров роста. Подобным способом, не прибегая к автоклаву, удается получать золи с частица ми до 100 нм. Повышая температуру выращивания, можно довести размеры частиц кремнезема до 150 нм. Золь при таком способе выращивания имеет узкий спектр по размерам частиц.
Получение растворов кремневой кислоты, из которых выращивают золь, возможно различными путями. При этом в качестве сырья большей частью желательно использование растворов жид кого стекла — дешевого продукта, выпускаемого в большом количестве. Помимо описанного выше использования катионитов, удаление ионов натрия возможно путем электролиза растворов силикатов с ртутным катодом. Согласно Вейлу [13], электролиз концентрированных растворов провести не удается, необходимо их разбавление, следовательно, и последующая выпарка. Возможно также получить золи нейтрализацией растворов щелочных силикатов кислотами с последующим электродиализом. Образующиеся при этом кислоту и щелочь можно вновь употреблять для приготовления раствора силиката и его нейтрализации.
Существует множество модификаций и сочетаний этих основных приемов: ионный обмен, нейтрализация раствора силикатов, выращивание. Так как устойчивость образующегося золя зависит от концентрации электролитов в растворе и от его собственной концентрации, то удаление электролита необходимо сочетать с добавлением новых порций питателя. При необходимости получения очень чистых золей, свободных от примесей, главным образом от посторонних катионов, используются другие методы получения растворов кремневой кислоты. Это гидролиз SiCl4 с последующи»1 удалением образующейся НС1, гидролиз алкилсиликатов в водно - органических смешанных растворах. Очень чистые кремнезолК образуются при прямом взаимодействии порошка металлического.„емния с водой, только необходимо предварительно убрать оксидную пленку с поверхности кремния плавиковой кислотой. Специфические золи, не способные к гелеобразованию, можно получить прямым диспергированием различных пирогенных крем - неземных материалов. Концентрирование золя обычно производится выпаркой, но возможны и другие способы, такие как центрифугирование, ультрафильтрация через различные мембраны. ультрафильтрация — наименее энергоемкий метод концентрирования. Он легко сочетается с удалением посторонних эле-ктро - титов из золя при добавлении воды в фильтрующийся золь так, "чтобы по мере увеличения концентрации золя концентрация электролита падала. Современные методы изготовления прочных мембран с высокой однородностью пор дают возможность производительно вести процесс. Повышение температуры способствует увеличению производительности фильтра. Даже небольшие примеси микрогеля кремнезема, меньше 0,5% от общего его содержания, уменьшают производительность мембраны наполовину. В проведенных нами опытах по ультрафильтрации на ацетатцеллюлозных мембранах золей со средним диаметром частиц 9 нм, стабилизированных калиевой щелочью до модуля 95, был получен золь 30% Si02, причем содержание щелочи в фильтрате составляло 10% от исходной величины, а кремнезема — меньше 5%.
Стабилизация золей, как уже говорилось, производится добавлением щелочи или аммиака с целью создания отрицательного заряда, препятствующего агрегации частиц. Оказалось, что крупнодисперсным золям (более 150 нм в диаметре) требуются следовые количества щелочи, чтобы препятствовать слипанию частиц. Чем выше дисперсность, тем более щелочная среда требуется для стабилизации коллоидной системы. Эта взаимосвязь есть продолжение рассмотренной ранее зависимости размера коллоидных частиц в равновесных полисиликатных растворах от модуля. Отсюда одной из трудных задач оказалось получение стабильных концентрированных (я^20% Si02) золей с размерами частиц меньше 5 нм, поскольку их тенденция к самопроизвольному росту и гелеобразованию весьма высока. Необходимость получения таких дисперсий вытекала из решения ряда практических задач. Помимо специальных технологий производства, такие золи требуют очистки от солей, так как их присутствие влияет на заряд частиц и 8заимодействие зарядов.
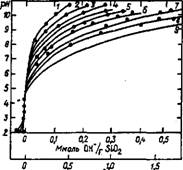
На рис. 38 приведена зависимость плотности ионного заряда на коллоидных частицах кремнезема от рН раствора при различных концентрациях постороннего электролита. Плотность ионного заряда не зависит от размера частиц, если последние хорошо формированы при температуре выше 80 °С и не обладают микро- пористостью. Катионы создают внешнюю обкладку двойного электрического слоя коллоидной частицы и часто составляют как бы и°нную пару на' поверхности. Если размеры противоионов вели - Ки> как у катионов четвертичного аммония, то при представленной
|
Число ионов W Ho 1Hm поверхности Рис. 38. Зависимость плотности заряда на поверхности коллоидного кремнезема от рН раствора и концентрации электролита [2] Концентрация NaCl, моль/дм3: 1 — КГ4; 2 — Ю-3; 3 — 4• Ю-3; 4-Ю"2; 5 — 4-Ю-2; 6— 10-'; 7 — 4-Ю-'; 8— 1,0; 9 — 4,0 |
На рис. 38 плотности зарядов коллоидных частиц и большом ра диусе слабополяризуемых катионов возникает дополнительная сте рическая стабилизация дисперсий. В этом видится одна из причиї высокой эффективности катионов четвертичного аммония при ста билизации дисперсий. Поскольку поверхность гидратированны) изнутри, т. е. образованных при температуре ниже 80 °С, золеі выше, чем плотных, сформированных при высокой температурі частиц, то для стабилизации последних требуется меньше щелочи чем для первых. В технологии растворов силикатов известно, чт( при введении реагентов в систему не удается полностью избежаті локальных явлений, связанных с высокой скоростью реакций сравнению со скоростью гомогенизации. Это обстоятельство спра ведливо также для золей: при стабилизации их щелочью обязательна высокая скорость перемешивания. Избыток стабилизатор; понижает устойчивость системы и увеличивает ее вязкость.
Выпускаемые промышленностью золи характеризуют по ины» параметрам, чем те, что приняты для растворов жидкого стекла Общее содержание кремнезема определяют стандартными анал» тическими методами. Другой важнейшей характеристикой является размер частиц. Так как технология изготовления зол^ позволяет получать золи, достаточно однородные по размерам, т' ограничиваются обычно определением среднего диаметра части1 или связанной с ним удельной поверхности, принимая плотност' кремнезема в частицах 2,2 г/см3. Размеры частиц можно оценит» по величине поглощения монохроматического света, например пр1' длине волны 400 нм. Для золей с концентрацией кремнезема менеі 5% и размером частиц более 20 нм справедливо линейное сoof ношение между оптической плотностью lg (/0//i) и процентнЫ" содержанием кремнезема, причем угол наклона линии зависит от размера частиц (здесь /о и /і — соответственно интенсивность падающего и прошедшего через кювету света). Имея такой калибровочный график, можно по оптической плотности и содержанию кремнезема в золе определить размер частиц. Наиболее часто используется для определения поверхности золя метод титрования его щелочью в интервале рН 4,0—9,0, основанный на постоянстве плотности ионного заряда на поверхности частиц разных размеров.
Навеску золя, содержащую точно 1,5 г Si02, разбавляют очищенной от С02 водой при комнатной температуре и подкисляют соляной кислотой до рНл:3. Затем разбавляют до объема 135 мл, добавляют 30 г кристаллической NaCl и перемешивают. Сразу же после растворения, приливая 0,1 н NaOH, доводят рН до 4,0 и титруют со стеклянным электродом, пригодным для высокого содержания натрия, до рН 9,0, сохраняющегося в течение примерно 1 мин. Удельная поверхность (м^/г), приведенная к методу БЭТ, рассчитывается по уравнению [2j : А = 26,4 (V—V), где V — объем раствора 0,1 н NaOH, см3, необходимый для титрования золя, содержащего 1,500 г Si02, при рН от 4,0 до 9,0; vt — объем щелочи, пошедшей на титрование в холостом опыте, не содержащем золя.
Существуют разновидности метода определения поверхности золя путем титрования, тогда расчетное уравнение изменяется в каждом случае, а значения коэффициентов корректируются по экспериментальным данным. Возможно, в целях уточнения метода, введение поправок в расчет на растворимый кремнезем [2], т. е. на те формы Si02, которые не входили в дисперсную фазу. Распределение частиц по размерам находят при необходимости с помощью электронного микроскопа или методом ультрацентрифугирования.
В производстве золей важной характеристикой, определяющей устойчивость системы, является концентрация посторонних электролитов (сверх концентрации, которая обусловлена введением стабилизирующей щелочи). Общую концентрацию электролитов находят по удельной электропроводности х при 25 °С золя, оттитрованного серной кислотой до рН=4,5 и разбавленного до 4% Si02, по формуле N=8,0 (и—4,3 • Ю-5), где N — общая нормальность электролитов в разбавленном золе. По результатам титрования с учетом разбавления вычисляют концентрацию Na2S04 в разбавленном золе, которая получилась за счет нейтрализации стабилизирующей щелочи. Разность между этими величинами дает концентрацию посторонних электролитов в разбавленном золе, которую при желании можно пересчитать на исходный Концентрированный золь.
Золи кремнезема относят к ньютоновским жидкостям. Их вязкость низка по сравнению с растворами щелочных силикатов, зависит от концентрации кремнезема в золе, и эту зависимость °писывают той или иной модификацией теоретического уравнения
Эйнштейна, которое для однородных сферических частиц имеет вид ті/ло=1+2,5ф, где т) и т)о — соответственно вязкость дисперс. ной системы и дисперсионной среды; ф — объемная доля дисперс. ной фазы.
Анализ этих модификаций в широкой области концентраций привел к обобщенному эмпирическому уравнению:
Л/Л0= 1 +2,5ф+ 10,05ф2+0,00273ехр (16,6q>).
Объемная доля дисперсной фазы должна включать не только объем собственно кремнезема, но и объем прилегающих к нему ионных и гидратных оболочек, вплоть до поверхности скольжения. Для золей с диаметром частиц более 20 нм объемом этих оболочек можно пренебречь; если частицы менее 5 нм, их доля может составлять десятки процентов. При рН около 2, когда поверхность кремнезема не имеет заряда, объем оболочек минимален.
То же самое уравнение Эйнштейна в дифференциальной форме иногда используют для описания образования фазы микрогеля в золе. Если ф — объемная доля фазы геля, то D In R = Kdq. Интегрирование этого уравнения при начальных условиях ф=0; т)=т|і (где т)б — вязкость свободного от гелевой фазы золя при данной концентрации кремнезема) приводит к экспоненциальной зависимости относительной ВЯЗКОСТИ Т)/г)о" от объемной доли гелевой фазы.
Химические свойства кремнезема в золе принципиально не отличаются от его свойств в кристаллическом или аморфном состоянии, но характеризуются большей реакционной способностью как из-за большой поверхности реакции, так и в связи с высокой аморфностью кремнезема в дисперсной фазе. Особую группу составляют реакции взаимодействия частиц золя непосредственно между собой или с помощью связующих агентов. Эти различные виды агрегации частиц могут происходить по разным причинам: под влиянием вносимых в систему реагентов, при возрастании концентрации кремнезема в процессе сушки, самопроизвольно при заданных условиях. Другую важную группу составляют реакции, относящиеся к химии поверхности кремнезема. Это различные виды адсорбции веществ, модифицирующие свойства поверхности дисперсной фазы, меняющие по величине или знаку электрический заряд поверхности, делающие ее менее гидрофильной или даже гидрофобной. В эту же группу входят взаимодействия, характеризующие адгезию кремнезема на тех или иных поверхностях. Как реакции, приводящие к агрегации частиц, так и взаимодействия на поверхности определяются в значительной степени величиной плотности заряда частиц, поскольку ван-дер-ваальсовое взаимодействие является если не единственным, то, по крайней мере, первичным по отношению к водородным и химическим СВЯЗЯМ. Зависимость плотности заряда частиц золя от концентрации постороннего электролита и рН раствора приведена на рис. 38.
80
Специфическая адсорбция многозарядных катионов, таких как А1, ре, может привести к перезарядке поверхности. При отсутствии зарядов в области низких рН стабильность золей обусловлена наличием гидратных оболочек, препятствующих агрегированию частиц между собой.
Айлер определяет несколько видов агрегации частиц золя: гелеобразование, коагуляцию, флокуляцию и коацервацию, которые подчас (особенно при высоких концентрациях кремнезема) трудноразличимы. Гелеобразование (желатинизация) золя заключается в образовании цепочек (сеток) из связанных между собой частиц кремнезема, причем концентрация кремнезема остается постоянной по всему объему золя. Золи из мелких частиц обычно сохраняют свою прозрачность, но характеризуются нарастающей во времени вязкостью. Заканчивается процесс полным структурированием и потерей подвижности. На ранних стадиях гелеобра - зования взаимодействие частиц носит обратимый характер и возможна пептизация геля, но образование силоксановых связей между частицами делает структурирование необратимым.
Коагуляция — это неупорядоченное агрегирование частиц кремнезема. Для него характерно объединение частиц в более или менее крупные рыхлые агрегаты, что приводит к потере прозрачности и постепенной седиментации агрегатов. Флокуляция — это неупорядоченная агрегация частиц с участием сшивающих аген: тов, образующих мостики между частицами. При высыхании такой системы, в отличие от коагуляции, создается весьма открытая структура, так как отсутствует непосредственное слипание частиц. Коацервация — образование двух жидких фаз — происходит при адсорбции золем поверхностно-активных веществ так, что поверхность кремнезема становится гидрофобной. В результате гидрофобные частицы кремнезема, взаимодействуя между собой, образуют свою жидкую фазу с высокой концентрацией кремнезема, а вода, почти лишенная кремнезема, — свою отдельную фазу, в которую обычно переходят электролиты.
Области применения золей весьма разнообразны. Они используются в различных композициях в качестве связующих веществ, широко применяются в производстве катализаторов и адсорбентов. Золи добавляют для загущения различных жидких систем, для получения пленок гидрофильного или гидрофобного характера на самых различных поверхностях. Они входят в состав различных неорганических красок и покрытий, а также используются в качестве полупродукта, кремнезема высокой реакционной способности.
Производство золей является многотоннажным и насчитывает десятки наименований марок, отличающихся концентрацией Si02 видом стабилизатора, размером частиц, величиной рН, различным °-бразом модифицированной поверхностью. Зарубежные фирмы ^пускают также золи по заказу, мелкими партиями специального Назначения.