Химические свойства растворов силикатов
Общепризнано, что в химии силикатов, а также в химии раст воров силикатов результат химического взаимодействия трудно,1 подчас и невозможно свести к ряду химических реакций в привык
Н0М ДЛЯ химиков формульном выражении. С одной стороны, это обусловлено сложным и большей частью неизвестным полимерным составом раствора, который формально характеризуют силикат - ным модулем, и неизвестным характером полимерных превраще - нИй Ъ ходе взаимодействия. С другой стороны, такая-ситуация складывается из-за некристаллического аморфного состояния продуктов реакции. Обычно они имеют нестехиометрический состав и развитую поверхность; большую роль в этом случае играют адсорбционные явления, и отличить адсорбцию от химических реакций можно только условно или в специальном исследовании.
Другой особенностью химии растворов силикатов является то обстоятельство, что результат взаимодействия реагентов зависит не только от их химической природы, но и от целого ряда нехимических факторов: порядка смешения реагентов, их начальной концентрации, скорости перемешивания при смешении и т. п. Общая причина этой группы явлений — гелеобразование на границе раздела взаимодействующих или смешиваемых фаз. Это приводит к осложнениям при гомогенизации реакционной системы и к возрастанию роли диффузионных процессов, предшествующих химическому взаимодействию реагентов. Поэтому различные технологические приемы, используемые при обеспечении взаимодействия реагентов, могут играть решающую роль в создании систем с заданными свойствами. Такими технологическими приемами, помимо перемешивания, могут быть предварительное растворение твердых реагентов в том же самом растворителе (например, в воде); их диспергирование; проведение гетерогенной реакции при непрерывном обновлении поверхности (например, в шаровой мельнице); растворение различных исходных реагентов в двух несмешиваю - щихся растворителях с последующим эмульгированием и т. п. Описание результатов реакции и использования тех или иных технологий проведения этих реакций оказывается громоздким, сводится, в конечном итоге, к бесконечному множеству примеров. Ниже будут изложены только основные закономерности и главные итоги взаимодействия растворов силикатов с различными реагентами.
Высокомодульные концентрированные растворы силикатов Щелочных металлов, получаемые автоклавным растворением силикат-глыбы, являются, как уже отмечалось, системами, переходными от растворов к коллоидам. Им уже в значительной степени присущи превращения, характерные для коллоидной химии: гелеобразование, коагуляция, флокуляция. Эти явления очень часто' сопутствуют, накладываются на основное химическое взаимодействие, придавая химии растворов силикатов своеобразие.
Взаимодействие кислот с растворами силикатов сводится к реакции Н+ + 0Н~-*-Н20. При этом протон Н+ может находиться в составе иона гидроксония или других бренстедовских кислот типа НСОзі СНдСООН, NHЈ кислотной формы ионита. Эта основная реакция может сопровождаться следующими явлениями или иметь следующие последствия: понижение рН раствора, увели-
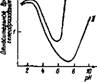
Рис. 34. Влияние рН на процесс гелеобразовання кремнезема в отсутствии (/) и в присутствии (//) солей натрия [2]
Чение концентрации посторонних электролитов, возрастание сили катного модуля раствора, изменение химической природы аниона находящегося в растворе. На рис. 34 показано влияние рН раство ра на скорость гелеобразовання кремнезема. Максимум скорости гелеобразовання приходится на диапазон рН = 5,5—7,5. Наиболее полное и быстрое выпадение кремнезема наблюдается при прили - вании кислоты в количестве, эквивалентном общей щелочности раствора силиката. Очевидно, что, приливая раствор силиката к избытку кислоты, при быстром перемешивании можно проскочить этот диапазон рН и сразу выйти на устойчивые системы при рН, равном 2. Обратный порядок приливання приведет к образованию геля или к неоднородной системе при медленном перемешивании. Из рисунка следует, что использование сильнокислотных катионитов, обусловливающее малую ионную силу раствора, может дать совсем иной результат, чем адекватная нейтрализация щелочи кислотой в диапазоне рН = 7—10. Изменение природы аниона в растворе, т. е. частичная замена гидроксильного иона анионом вводимой кислоты, имеет следствием большую или меньшую потерю устойчивости системы, поскольку гидроксильный ион лучше любого другого аниона хемосорбируется на поверхности полимерных частиц, сообщая им отрицательный заряд, препятствующий их агломерации. В зависимости от способности аниона кислоты сорбироваться на поверхности кремнезема полная или частичная нейтрализация раствора щелочного силиката той или иной кислотой может дать внешне различные результаты: выпадение объемистого аморфного осадка (коагуляция), образование студенеобразной массы (гелеобразование), помутнение раствора из-за образования микронеоднородностей в системе, сохранение прозрачного раствора с меньшим или большим изменением вязкости.
Концентрация раствора щелочного силиката весьма сильно влияет на выпадение осадка кремнезема при нейтрализации кислотами. Естественно, что чем выше концентрация силикатного раствора, тем вероятней выпадение осадка кремнезема или гелеобразование.
|
|
Температура процесса нейтрализации или последующее нагре - вание также сказываются на результате. Повышение температурь1 всегда ускоряет физико-химические процессы, и система быстрее достигает более устойчивого состояния.
Так как растворы щелочных силикатов имеют сильнощелочную реакцию, то нейтрализовать их полностью или частично можно любыми кислотами, в том числе кислыми газами (С02, H2S, S02), борной кислотой, кислыми солями (бикарбонаты, кислые фосфаты), которые при растворении сообщают системе рН меньший, чем рН раствора силиката.
Своеобразием отличается нейтрализация растворов силикатов пиросолями, солями типа бихроматов, а также сложными эфира - ми. Будучи продуктами конденсации кислых солей, пиросоли при взаимодействии со щелочами нейтрализуются до нормальных солей, например S207~ + 20H~-*-H20+2SC)4~. Эта реакция, или реакция гидролиза сложных эфиров, может быть медленной стадией, и тогда смешение реагентов удается произвести значительно раньше реакции нейтрализации. В противоположность этому нейтрализация растворов силикатов кислотами, как правило, протекает с диффузионным контролем. Следует отметить, что титрование растворов щелочных силикатов кислотами дает неверные результаты, если в процессе титрования происходит выпадение осадка кремнезема, который адсорбирует как кислоту, так и индикатор.
Добавление к раствору силикатов растворимых сильных оснований с катионом, отличным от катиона щелочного силиката, вообще говоря, не ведет к каким-либо реакциям (действие гид - роксидов щелочноземельных металлов будет рассмотрено ниже). Формально прибавка щелочи уменьшает силикатный модуль раствора. Если к концентрированному высокомодульному раствору добавлять концентрированную щелочь, то это может привести к кристаллизации (например, силиката натрия), поскольку низкомодульные растворы мало склонны к высоким пересыщениям. В этом случае легко образуются неоднородные мутные растворы, поскольку результат от локального, по месту ввода щелочи, повышения рН раствора наступит раньше, чем система окажется гомогенной. Кроме того, введение концентрированной щелочи сопровождается резким изменением вязкости как в сторону повышения, так и в сторону понижения в зависимости от силикатного модуля исходного раствора (см. рис. 28). С другой стороны, при небольшом добавлении щелочи к концентрированному высокомодульному силикатному раствору анионный состав раствора меняется не сразу и, видимо, достаточно долгое время может сохраняться его отличие от состава с тем же самым модулем, полученного непосредственно растворением безводного силиката. Влияние вводимого катиона на некоторые технологические свойства раствора Силиката натрия может быть весьма существенно, если в систему вводятся катионы тетраалкиламмония (NR^~) или Li; особенно это относится к устойчивости высокомодульных растворов и их совместимости с органическими компонентами. Наоборот, введение катиона натрия с натриевой щелочью способно заметно повлиять на свойства растворов силиката лития или тетраалкиламмония. Добавление калиевой щелочи к растворам натриевых силикатов или наоборот оказывает заметное влияние только при сопоставимых по порядку величины концентрациях катионов в образующейся системе. Концентрированные растворы аммиака вызывают немед. ленное гелеобразование или, точнее, желатинизацию силикатного раствора. Силикатный модуль в образовавшемся студне может оказаться несколько выше, чем в исходном растворе силиката. Разбавленные растворы аммиака не вызывают видимых изменений в силикатной системе, кроме эффекта разбавления.
Разбавление растворов щелочных силикатов водой в общем случае уменьшает рН раствора и тем самым влияет на анионный состав раствора в сторону увеличения степени полимерности. Однако скорость этого изменения в большой степени зависит от силикатного модуля исходного раствора. В сильнощелочных системах все изменения завершаются за несколько минут после разбавления, в то время как в высокомодульных системах процесс может растягиваться на недели и месяцы. Как уже отмечалось, увеличение концентрации щелочи всегда делает силикатную систему более динамичной.
Добавление к раствору щелочных силикатов сильных электролитов, катионы которых не образуют нерастворимых силикатов, отличается по результату большим разнообразием. Соли аммония, алюминия и соли других слабых оснований гидролизуются практически до конца в растворах щелочных силикатов. Их действие эквивалентно реакции нейтрализации кислотой с образованием растворимой соли:
NH4C1 + 0H-->NH3+H20 + C1-.
Реакция несколько иного порядка протекает при действии на растворы жидкого стекла кремнефторидов:
SiF§~ + 40H--*6F - + Si02+4H20.
Помимо уменьшения щелочности раствора, в этом случае повышение силикатного модуля связано с увеличением кремнезема в системе, который образуется в той или иной форме в зависимости от рН. Так как поглощение щелочи в этой реакции велико, то даже из разбавленных низкомодульных растворов может выпадать осадок кремнезема. При использовании концентрированных реагентов получившаяся масса способна к затвердеванию, что используется во многих технологических процессах.
Другой результат от введения солей щелочных металлов состоит в гидратации добавляемых электролитов. Их добавление к разбавленным растворам щелочных силикатов не дает какого-либо эффекта, а в концентрированных растворах силикатов введение нейтральных солей приводит к перегидратации, т. е. перераспределению воды между гидратными оболочками силикатов щелочных металлов и вновь вводимыми ионами. Гидратация ионов в растворах щелочных силикатов является условием общей стабильности системы, и перегидратация может привести к потере устойчивости по отношению к коагуляции или гелеобразованию. Этому способствует увеличение ионной силы образующегося раствора и ослабление электростатического взаимодействия ионов. Естественно, чем выше силикатный модуль раствора, тем легче нарушается стабильность системы. Так, например, поваренная соль вызывает коагуляцию силикатных растворов с модулем не ниже двух. Также очевидно, что в целях коагуляции лучше использовать концентрированные растворы электролитов. Повышение температуры всегда способствует коагуляции. Состав выпадающего в результате коагуляции осадка трудно поддается анализу из-за его сильной адсорбционной активности. Полагают, что модуль выпадающего осадка кремнезема всегда выше, чем в растворе, как будто коагуляции подверглась наиболее высокомолекулярная часть кремнезема, находящегося в исходном растворе. Тем не менее осадки, образующиеся при действии солей щелочных металлов, растворимы в воде. По Айлеру [2], ионы щелочного металла, в частности натрия, могут служить в этом случае звеньями, связывающими полисиликатные ионы, если ионы металла содержатся в большом избытке. Соли лития, будучи добавлены в большой концентрации к раствору силиката натрия, способны образовывать малорастворимые осадки.
Концентрированные растворы силикатов натрия и калия практически не смешиваются с водорастворимыми органическими веществами, такими как спирты, ацетон. Добавление спирта вызывает расслоение системы. В нижнем слое остается весь силикат с модулем несколько выше исходного, а в верхнем — водно-спиртовой раствор, содержащий немного щелочи. Полагают, что изопропило - вый спирт, добавляемый в большом избытке к раствору щелочного силиката, осаждает его из раствора, без существенного изменения полимерного состава. Разбавленные растворы щелочных силикатов смешиваются с органическими водорастворимыми соединениями до тех пор, пока воды, связанной с силикатами, достаточно для того, чтобы препятствовать осаждению.
Растворы силикатов лития и тетраалкиламмония способны смешиваться со спиртами и ацетоном, что используется в технологической практике.
Взаимодействие растворов щелочных силикатов с растворами солей щелочноземельных металлов и их твердыми соединениями дает широкий ряд ценных продуктов. Сюда относятся различные адсорбенты, наполнители резин и других эластомеров, бумаги, красок, различные обесцвечивающие агенты, носители катализаторов и собственно катализаторы, осаждающие агенты. Эти реакции имеют место в многочисленных твердеющих композициях, в процессах обескремнивания воды, получения разнообразных пористых Материалов с высокоразвитой поверхностью и т. д.
Изучению как самого процесса взаимодействия жидкого стекла с солями щелочноземельных металлов, так и идентификации проДуктов этого взаимодействия посвящено множество исследований.
В общем случае при сливании двух растворов на границе раздела фаз образуется мембрана (коллоидная пленка) из аморфных гидросиликатов щелочного металла, препятствующая дальнейшему смешению растворов, через эту пленку относительно легко диффундируют вода и ионы, не образующие труднорастворимых силикатов: ионы гидроксила, гидроксония, щелочных металлов, некрупные анионы. В результате модуль силикатного раствора повышается и возможно выпадение кремнегеля, а по другую сторону мембраны могут образовываться малорастворимые гидроксиды щелочных металлов. Эта общая картина взаимодействия тем более реальна, чем выше концентрация реагентов в растворах и чем выше модуль жидкого стекла. При смешении разбавленных растворов образование сплошных мембран маловероятно, в данном случае целесообразно говорить о параллельных реакциях взаимодействия иона щелочноземельного металла М2+ с силикатными ионами с образованием связей М—О—Si= и с гидроксильными ионами с образованием связей М—О—Н. Являясь кислотой Льюиса, ион М2+ взаимодействует только с одной электронной парой гидроксила или кремнекислотного иона, каков бы ни был отрицательный заряд последнего. Поэтому ион М2+ или сшивает крем - некислородные ионы, или взаимодействует с двумя гидрокси - лами, давая М(ОН)г, или образует смешанные системы типа Н—О—М—О—Si = . При этом имеют место следующие закономерности. Высокомодульные концентрированные жидкие стекла, характеризующиеся многообразием полимерных ионов и мицелл, способствуют образованию аморфных продуктов даже без признаков кристалличности. Низкомодульные разбавленные силикатные растворы, содержащие ионы (по преимуществу мономерные силикаты), более склонны к кристаллизации. В ряду Be—Ва гидроксид бария является наиболее сильным основанием и наименее склонен образовывать связи Ва—ОН, поэтому образование кристаллических силикатов в этой системе наиболее вероятно. Тем не менее кристаллизация силикатов — процесс очень медленный. Практически всегда при взаимодействии ионов щелочноземельных металлов с силикатами образуются аморфные продукты нестехио - метрического состава, которые невозможно зачастую трактовать как определенные химические соединения или их смесь. Нередко, однако, при осаждении силикатный модуль осадка Si02/M0 такой же, как силикатный модуль исходного раствора БЮг/МгО.
Ввиду сложности процесса взаимодействия жидких стекол с растворами солей щелочноземельных металлов качество получаемых продуктов с теми или иными технологическими свойствами в очень сильной степени зависит от частных тонкостей технологии, а не только от температуры, концентрации реагентов, скорости перемешивания, порядка смешения реагентов и скорости смешения, глубины предварительной частичной нейтрализации жидкого стекла кислотой. Поэтому требования к технологическим разработкам и к соблюдению технологии весьма высоки. Так, например, для получения эффективных адсорбентов из силикатов магния, обесцвечивающих минеральные масла, осаждение силикатов из жидкого стекла проводят реакцией с СаСЬ и последующим ионным обменом кальция на магний в растворе магниевых солей.
Как уже отмечалось, осадки силикатов щелочноземельных металлов содержат в большей или меньшей степени и ионы щелочного металла, и анионы соли использованного щелочноземельного металла. Они рентгеноаморфны и обнаруживают признаки кристаллизации при нагревании. Растворы щелочных силикатов эффективно взаимодействуют также со многими твердыми веществами, в состав которых входят ионы щелочноземельных металлов: различные глины, стекла, золы, шлаки и, конечно, малорастворимые соли этих металлов, такие как карбонаты, сульфаты, фосфаты, фториды, силикаты, оксиды и гидроксиды. Со всеми веществами этого типа жидкие стекла образуют твердеющие системы. Время твердения при этом широко варьируется от нуля до бесконечности. Оно существенно зависит от типа твердого вещества, типа его кристаллической структуры или степени его аморфности, от температуры процесса, степени его дисперсности, от концентрации и модуля жидкого стекла, соотношения Т:Ж.
Вязкость смеси СаСОз с низкомодульным жидким стеклом быстро растет во времени, в то время как такая же смесь с высокомодульным жидким стеклом может оставаться без видимых изменений длительное время. При модуле 2 натриевое жидкое стекло с СаСОз схватывается при 30 °С за 6 ч и при 40 °С менее чем за 2 ч; при модуле 3,3 смесь начинает схватываться при этих же температурах соответственно за 100 и за 20 ч. Такая же смесь с модулем 4 в течение длительного времени обнаруживает только признаки взаимодействия. Кальциты гораздо менее реакционноспособны по сравнению с арагонитами. Свежеосажденный мел наиболее реак - ционноспособен в жидкостекольных системах. При взаимодействии щелочных силикатных растворов с различными кальцийсодер- жащими материалами переход Са2+ в раствор может предшествовать образованию силикатов кальция. В других случаях осаждение кремнезема на кальциевых поверхностях твердой фазы является первой стадией, и тогда взаимодействие реагентов в течение длительного времени ограничивается узкой зоной контакта фаз и диффузия ионов кальция оказывается лимитирующей стадией. Обновление поверхности механическими способами в таких случаях становится мощным кинетическим фактором. Некоторые сформировавшиеся в геологические эпохи кальций - или магнийсодержащие минералы столь прочно удерживают эти ионы в своей структуре, что практически инертны, и только поверхности минералов имеют сродство к кремнезему. Если при взаимодействии жидких стекол с растворимыми солями щелочноземельных металлов обнаружение й идентификация продуктов реакции является сложной и неоднозначно решаемой задачей, то в гетерогенных процессах эта проблема усугубляется.
Соединения щелочноземельных металлов во многих случаях применяют в качестве отвердителей жидкостекольных композиций. При использовании высокоактивных реагентов необходимы точная дозировка и обеспечение воспроизводимых условий смешения. Менее активные реагенты не так чувствительны к условиям, но требуются в гораздо большем количестве или с гораздо большей поверхностью. Они могут оставаться в значительных количествах в образовавшемся композиционном материале и тем влиять на его свойства. В ряде случаев использования малоактивных форм различие между отвердителем и наполнителем жидкостекольных систем оказывается чисто условным.
Взаимодействие растворов щелочных силикатов с растворимыми солями других поливалентных металлов, таких как цинк, кадмий, медь, никель, железо, марганец, свинец и другие, во многом протекает аналогично взаимодействию с солями щелочноземельных металлов. Образование студенистых осадков малорастворимых гидроксидов металлов происходит еще более легко и также способствует созданию мембран на границах смешиваемых фаз. Образование кристаллических продуктов тоже маловероятно ввиду полимерности не только анионов, но и катионов. Редкое исключение составляет относительно легко кристаллизующийся силикат меди, образующийся при взаимодействии щелочных силикатов с растворами сульфата или хлорида меди. В местах контакта фаз рН резко изменяется, так как ионы гидроксила поглощаются катионами поливалентного металла, что способствует полимеризации кремнезема. Поверхность студенистых осадков более развита и склонность к адсорбции и соосаждению различных ионов больше. Продукты взаимодействия представляют собой смесь гидроксидов, силикатов и основных солей в аморфном состоянии, причем соотношение между ними определяется теми же условиями проведения реакции. Оксиды цинка и свинца, в том числе сурик РЬ304, осаждают кремнезем из растворов жидких стекол, причем их активность зависит от температурной обработки, которой они подвергались. Хорошо сформированные состарившиеся окислы большинства тяжелых металлов практически инертны в щелочных силикатных системах. С высшими окислами молибдена и вольфрама, находя - , щимися в ионной форме молибдатов и вольфраматов, в кислых средах мономерный кремнезем образует гетерополикислоты. Полимерные и коллоидные формы кремнезема взаимодействуют с молибденовой кислотой медленней по мере образования мономерных форм, на этом основано условное деление общего содержания кремнезема в жидких силикатных системах на растворимый (a-Si02) и коллоидный. Хроматы и бихроматы осаждают кремнезем из растворов щелочных силикатов, при этом отмечается появление полезных технических свойств осажденных форм.
Уже упоминалось, что соли алюминия полностью гидролизу- ются в избытке раствора щелочного силиката. Взятые в стехио - метрических соотношениях, эти реагенты образуют хлопьевидные
Осадки, в которых можно предполагать присутствие силиката алю - миния. Реакция в растворе между щелочными силикатами и алюминатами дает целый набор связок, обладающих ценными техническими свойствами. Кроме того, на этой реакции основано получение в автоклавных условиях малорастворимых щелочных алюмосиликатов — искусственных цеолитов, в которых ион щелочного металла легко обменивается в водных средах на щелочноземельные ионы или ионы тяжелых металлов.
Реакции жидких стекол с некоторыми металлами и металлоидами основаны исключительно на щелочных свойствах силикатных растворов, поэтому с высокомодульными стеклами они практически не протекают. Такими реакциями являются реакции дис- пропорционирования галогенов и серы в щелочных растворах с образованием галогенидов и гипогалогенидов и, соответственно, сульфидов и гипосульфитов. Кальций, барий и щелочные металлы восстанавливают водород из воды, и эта реакция с растворами силикатов протекает при любых рН практически до конца. Металлический цинк, алюминий, кремний в мелкодисперсном состоянии тоже вытесняют водород из воды при высоких рН, образуя твердеющие системы. В частности хорошо известны цинковые противокоррозионные покрытия по железу на жидкостекольной основе. В щелочных силикатных системах окисление цинка, кремния и алюминия может замедляться на какой-то стадии взаимодействия, при этом образуются не вспучивающиеся в дальнейшем от выделения водорода самотвердеющие системы. Подобной активностью по отношению к жидким стеклам обладают некоторые силициды, в частности силицид железа.