Отверждение жидкого стекла соединениями кальция и других двухвалентных металлов
Взаимодействие растворов силикатов с соединениями кальция занимает важное место в практической химии и заслуживает отдельного анализа. Чтобы разобраться в огромном количестве известных из практики фактов, подытожим общехимические сведения, характеризующие их состояние и поведение в водной среде.
Вода медленно разлагает путем гидролиза кристаллическую решетку таких силикатов кальция, как ЗСаО • S1O2, с образованием Са(ОН)2 и гидросиликатов кальция с меньшей основностью, чем исходный. Еще более медленно подвергается гидролизу 2CaO-Si02, а менее основные силикаты кальция практически не взаимодействуют с водой. В водном растворе NaC104 при рН=8ч-9 комплексы типа [CaOSi (ОН) з] + неустойчивы и образуются только при избытке солей [60]. Ионы Са2+ не образуют двойных связей с одним атомом кислорода, а в щелочных растворах кальций существует в форме Са2+, СаОН+, Са(ОН)2. На поверхности кремнезема в водных растворах ионы Са2+ адсорбируются так, что на один поверхностный атом кремния приходится ион кальция. Поскольку в щелочных средах поверхность коллоидных частиц кремнезема ионизирована и в целом заряжена отрицательно, адсорбция приводит к полной или частичной перезарядке и является причиной коагуляции. Перезаряженная в специальных условиях, такая поверхность сама может адсорбировать, например, анионы жирных кислот, создавая гидрофобность коллоидных частиц.
Осаждаемые солями кальция из растворов жидкого стекла силикаты кальция аморфны при обычных температурах. Кристаллические продукты могут образовываться или в автоклавных условиях, или из очень разбавленных растворов с низкой щелочностью, а также при старении. Осаждение силикатов щелочноземельных, многовалентных и тяжелых металлов возможно, как правило, при рН чуть меньших, чем рН осаждения соответствующих гидроксидов. Поэтому при смешении двух растворо» наряду с силикатами металлов или раньше их всегда образуются в большем или меньшем количестве (в зависимости от интенсивности перемешивания) как гидроксиды металлов, так и гели кремнезема (см. разд. 2.4.4). Ионы кальция в воде сильно гидратИ - рованы. В некоторых случаях, например при взаимодействий Са2+ со фторид-ионом, в водных средах образуются студенистые слизи высокой степени оводненности, и при комнатных температурах они не обнаруживают даже признаков кристаллизации хотя растворимость кристаллов CaF2 крайне мала.
При взаимодействии Са2+ с силикатами образованию кристал лических продуктов препятствует также многообразие форм силИ катных анионов, не позволяющее строить кристаллическую струк - туру. Айлер [2] отмечает, что кристаллизация силикатов кальция при комнатных температурах возможна только при развитии деструктивных процессов, приводящих к образованию мономерах силикатных анионов. Поэтому развитию процессов кристаллизации силикатов кальция будут способствовать повышение температуры, высокая щелочность системы и дефицит воды в ней.
Одним из авторов были проведены методом вращающегося диска исследования по кинетике растворения водорастворимых солей в растворах, содержащих осаждающий ион, т. е. ион, с которым растворяющаяся соль могла образовать малорастворимое соединение. Было обнаружено, что с увеличением концентрации осаждающего иона скорость растворения росла до некоторого предела, после которого резко уменьшалась из-за блокировки поверхности растворяющейся соли новообразованиями. Концентрация, при которой наступала пассивация, была тем выше, чем больше были растворимость растворяющейся соли, скорость перемешивания и чем меньше сродство осаждающего иона к осаждаемому. Схожесть параметров кристаллических решеток обеих солей также играет роль в процессе пассивации.
Учитывая все изложенное, можно ожидать, что при смешении жидкого стекла с раствором, например СаС12, из-за различия рН растворов на границе двух жидких фаз быстрее всех будет протекать реакция гидролиза [обратная реакция (а), см. 3.1]. Нейтрализация заряда анионов приводит к их моментальной коагуляции на стыке фаз, и если концентрация силикатов достаточно велика, образуется мембрана с отрицательным зарядом со стороны силиката и положительным со стороны раствора хлорида кальция. При высокой вязкости силикатного раствора мембрана превратится постепенно в гелевую оболочку из скоагу - лировавшего кремнезема с небольшим градиентом концентрации по кальцию со стороны раствора СаС12 и по натрию со стороны силиката. Так происходит, после просушки от внешней влаги, образование гранул из капель жидкого стекла или различных смесей на его основе, обладающих некоторой водостойкостью наружного, частично кальцинированного слоя, но не обладающих влагонепроницаемостью [58, 59]. Подобной технологией можно Использоваться для обратной задачи — капсулирования кремнеземом водорастворимых соединений различных металлов и мало - Растворимых окислов.
При хорошем перемешивании не очень вязких растворов мембрана будет непрерывно разрушаться, что даст возможность взаимодействия силикатов с ионами кальция с образованием ^Si—О—Са+, =Si—О—CaOH, = Si—О—С а—О—Si=. Образование первого вида частиц означает перезарядку мицелл крем- ^зема, их коагуляцию и вовлечение в качестве противоионов в конечный продукт. Образование последнего вида частиц представляет собой образование гетерополимеров, т. е. происходит сшивка кремнеземных анионов ионами кальция с образова - нием более сложных структур. Гетерополимеры, так же как и силикатные гомополимеры, в щелочной среде необходимо рассмат - ривать как динамичные системы с высокими абсолютными скоростями прямых и обратных реакций, особенно в случаях, когда степень связанности кремнезема невелика. Поэтому можно говорить о времени жизни кальция в связке Si—О—Са до очередного разрыва связи. Это время жизни в твердеющей системе будет непрерывно возрастать как из-за потери влаги, так и вследствие увеличения вязкости.
Результат взаимодействия растворов солей кальция с жидким стеклом заключается в коагуляции силикатного раствора. Состав выпавшего аморфного осадка существенно зависит от того, что к чему приливали, от интенсивности перемешивания, от концентрации используемых растворов, от рН образовавшейся реакционной смеси и может включать в себя как гидроокиси кремнезема и кальция, так и силикаты кальция с захваченными ионами хлора. Такой характер взаимодействия наблюдается с большинством солей двухвалентных металлов. О нем очень часто говорят как о соосаждении гидроокисей металла и кремния, об адсорбции гидроокиси металла на коллоидном кремнеземе или, наоборот, об осаждении кремнезема на окислах и гидроокисях металлов. В очень разбавленных растворах с pH=8-f-10 взаимодействие реагентов может проявляться в виде опалесценции, появляющейся через часы или сутки после смешения растворов. Присутствуя в малых концентрациях, ионы двухвалентных металлов, и в частности ионы кальция, вызывают флокуляцию коллоидных форм кремнезема из слабощелочных растворов за счет образования связей =Si—О—Са—О—Si = , но если ионы кальция предварительно переведены в растворимые хелатные формы, то осаждение кремнезема не происходит [2].
|
I |
|
С а, |
Хелатами называются циклические соединения с металлами tana оксалата кальция
О=с—О
I
О=с—о
Где одна молекула кислоты без образования двойных связей занимает обе валентности металла, что создает особую прочность молекулы. К хелатам относятся комплексоны металлов, например трилон Б.
|
О О |
|
О О |
|
02S. |
Хелатный цикл состоит обычно из пяти, шести и более атомов - но иногда возможно образование четырехатомных циклов, чтс характерно для сульфатных и карбонатных анионов [62] с образованием
Са или ОС
Комплексоны, как известно, используются в аналитической хнмии для количественного определения различных поливалентных металлов за счет связывания их в прочные, но, обычно, растворимые хелатные формы, за счет чего подчас осуществляется переход в раствор даже весьма мало растворимых соединений этих металлов. В кинетике процессов, где образуются или разрушаются силикаты кальция, возможность реализации хелатов, включающих ион кальция, может играть заметную роль. Способ- - ность силикатного тетраэдра образовывать хелаты с кальцием или другими поливалентными металлами в литературе не отмечается.
Различные содержащие кальций соединения с невысокой растворимостью часто используются для отверждения жидкого стекла. Кроме того, жидкое стекло употребляется как добавка в вяжущие системы. Поэтому анализ взаимодействия жидкого стекла с кальцийсодержащими твердыми фазами представляет интерес, особенно с такими как ЗСаО-Si02(C3S) и 2СаО-Si02(C2S),— одними из основных составляющих многих цементов. Механизм реакций, возникающий в системе C3S — вода, полностью не известен, но многочисленные работы по гидратации цемента и отдельных его компонентов с водой позволяют создать следующую картину. В кристаллической решетке 3Ca0-Si02 существуют следующие виды химических связей: =Si—О—Са— и —Са—О—Са—. Если первые довольно устойчивы по отношению к воде, то вторые быстро взаимодействуют с протоном воды по реакции
—Са—О—Са--------- (-НгО->—Са+ +Н—О—Са-------------- |-ОН.
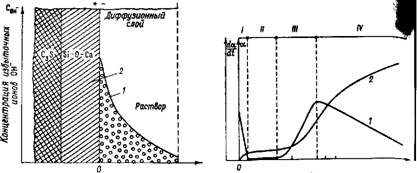
Это позволяет перейти в раствор из нескольких поверхностных слоев твердой фазы части окиси кальция, слабо связанной с основным каркасом кристаллической решетки (рис. 45).
В результате на границе раздела фаз возникает двойной электрический слой и начинается индукционный период. Измерение дзета-потенциала показывает, что твердая фаза заряжена положительно по отношению к раствору [61]. Этот положительный заряд образуют ионы кальция, жестко связанные с кристаллической решеткой системой связей Si—О—Са+, поскольку известно, что с одним силикатным тетраэдром SiO*" ион кальция связан только одной связью, не образуя хелатов. Со стороны раствора плотную часть двойного электрического слоя образуют гидроксильные ионы, часть из которых связана с ионами Кальция специфически, т. е. химической связью, а не только электростатически. Известно, что в растворе гидроокиси кальция значительная часть кальция находится в форме Са(ОН) + и даже Молекул Са(ОН)2. Далее в глубь раствора ионы ОН" образуют Диффузную часть двойного электрического слоя, создающую по - Тенциал течения, или дзета-потенциал. Со стороны твердой фазы к раствору примыкает тонкая, порядка четырех слоев кристалли-
|
Врет, T Рис. 45. Строение границы раздела фаз при гидратации 3Ca0-Si02 1 — зависимость избыточной концентрации ОН - по толщине диффузионного слоя; 2~ несколько атомных слоев полуразрушенной кристаллической решетки 3Ca0-Si02 |
Рис. 46. Изменение степени гидратации а (2) и скорости гидратации (/)
От времени I, II, III, IV — стадии гидратации
Ческой решетки, пленка, частично сохранившая каркас и связи исходной структуры, но потерявшая часть ионов кальция и оксидных ионов, место которых могут занять молекулы воды. Следует особо отметить, что изолированные друг от друга кремне - кислородные тетраэдры исходной структуры связывает именно кальций и эти связи должны быть разорваны, чтобы разрушилась вся система. Двойной электрический слой создает потенциальный барьер как для заряженных частиц, так и для полярных молеку-1 воды.
Описанная система достаточно устойчива, но не равновесна11 даже не метастабильна; просто абсолютные скорости возможны* реакций крайне малы. Она во многих чертах похожа на пассивна состояние металлов в агрессивных средах или на описаннУ1" ранее блокировку осаждающим ионом процесса растворения соЛ'
Кинетическая кривая гидратации алита (рис. 46), определ^ ная непосредственно или из термокинетических данных [61, g точности воспроизводит классическую зависимость степени превращения от времени для топохимических реакций и, если эТо так, то следующее за индукционным периодом ускорение реакций в рассматриваемой системе связано с возникновением и расширением нового фронта реакции: старая фаза — новая фаза', развитие зародышей новой фазы, образовавшихся в полуразрушенном поверхностном слое, и увеличение поверхности по новому фронту создает известное возрастание скорости реакции", наступающее после индукционного периода. Обычно лимитирующая стадия топохимических реакций совершается в один-два элементарных акта, например поворот элемента структуры по оси связи или диффузионный скачок частицы по поверхности раздела.
Когда новый фронт реакции охватит всю поверхность гидра - тирующейся частицы C3S, наступает максимум скорости реакции, соответствующий точке перегиба на кинетической кривой. Процесс начинает затухать в связи с сокращением поверхности реакции. Двойной электрический слой исчезает или уменьшается, как только хотя бы часть кальция из кристаллической решетки приобретает подвижность.
По наблюдениям исследователей отношение Ca/Si в поверхностном слое твердой фазы на ранних стадиях равно 2,5 и выше, а позднее оно падает до 1,5—2. Падение связано с окончанием индукционного периода. Основанием для этого падения является реакция гидролиза
, 0+Н20 — Si—ОН+Са2+ + ОН".
Это протолитическая реакция перехода протона от молекулы воды к связывающему кислороду. Как указывалось ранее, в щелочной среде возможно также протекание гидролиза по принципу трансатаки силикатного тетраэдра гидроксильным ионом
OH~ + ^;Si—О—Са+ + Н20-»-Н—О—Si - :+Са (ОН) 2.
Термодинамическим обоснованием возможности такой реакции является то, что рН жидкой фазы в индукционный период равен 12,3—12,5. При таком сравнительно невысоком рН равновесное Распределение мономерных силикатных анионов таково, что основ - нУю их часть составляют ионы H2Si04~. Это и соответствует п°явлению гидратов силиката кальция низкой основности, и только к°гда рН жидкой фазы возрастет, основность гидросиликатов м°жет повыситься.
Если рассматривать систему р—2Ca0-Si02—Н20, то все основные идеи, изложенные выше, сохранятся, р—2Ca0-Si02 имеет "кристаллическую структуру, в которой некоторые ионы кальция и оксид-ионы слабее связаны с основным кристаллическим кар - Касом и способны медленно переходить в раствор из тонкого
поверхностного слоя. Их будет гораздо меныге, чем у C3S, де. фектов кристаллической структуры окажется меньше, и все после, дующие процессы станут развиваться медленнее, но качественно одинаково.
Предложенная схема, подытоживая основные исследования по гидратации силикатов кальция, помогает уяснить как действуют различные добавки в раствор, в том числе и щелочных силикатов, на процесс гидратации. Так, введение в раствор анионов, закрепляющих двойной электрический слой, т. е. образующих с Са прочные связи, плохо разрушаемые водой, замедлит процесс гидратации. Это ионы ОН", F", РОЇ]- и т. п. Анионы карбонатов, сульфатов, оксалатов, склонные к образованию <елатов, большей частью не блокируют поверхность растворяющейся фазы, несмотря на малую растворимость соответствующих соед-шений кальция, а образуют осадки непосредственно в растворе что приводит к увеличению скорости растворения. Интересно огметить, что ионы HCOjT замедляют процесс растворения и гидратации силикатов кальция, несмотря на менее щелочную реакцию среды. Анионы, образующие с кальцием хорошо растворимые соли, внедряясь в плотную часть двойного электрического слоя, будут способствовать переходу кальция в раствор. Особую роль играет С1~, который и в электрохимических процессах является деполяризатором, замещая ОН" на границе раздела фаз, причем концентрация СГ на несколько порядков выше, чем ОН-. Но введение в раствор хлоридов щелочных металлов не так эффективна, как добавление хлоридов кальция и, возможно, магния. Магний выведет из состава раствора практически все ОН--ионы, осаждаясь в виде MgClOH, а кальций более мягко свяжет гидроксильные ноны, сам дольше оставаясь в растворе, понижая его рН и разрушая двойной электрический слой.
При введении трех - или двухкальциевого силиката в концентрированные растворы жидкого стекла, порядка нескольких молей Si02 на литр, дзета-потенциал если - и возникает, то незначительный, только за счет разности концентраций силикат-ионов в той и другой фазе. Кроме того, рН жидкого стекла почти на порядок ниже, чем необходимо для создания блокировки гидроксиль - ными ионами межфазного перехода, и жидкое стекло обладает "огромным буферным действием. Поэтому скорость перехода в раствор ионов кальция велика и индукционный период практически не возникает.
Ионы кальция мягко связываются силика-ными анионами, оставаясь в растворе до тех пор, пока концентрация связанного кальция не возрастет до такой степени, что ускорится вторичный процесс сшивания силикатных ионов между собої ионами кальция и образование макроагрегатов силикатов калыия, выпадающих в осадок.
Приведенная общая картина гидратации силикатов кальция в водных средах, в том числе и их взаимодействие с жидким стек - ,0м, опирается на многочисленные исследования, часть из ко т0рых интересно здесь привести для обсуждения отдельных деталей процесса. Табл. 22 иллюстрирует влияние щелочи на гидратацию р - и y-C2S на ранних стадиях: В обоих случаях щеточная среда создавалась добавлением к воде щелочи до рН=11 и степень гидратации оценивалась по величине потерь при прокаливании твердой фазы.
|
Таблица 22. Потери при прокаливании, %, при гидратации C2S в водной и щелочной среде [39]
|
Из табл. 22 следует, что введение щелочи несколько увеличивает степень гидратации (а) на самой первой стадии (см. кинетическую кривую гидратации на рис. 46), но на второй стадии индукционный период в присутствии щелочи растягивается для j3-C2S более чем в два раза, что свидетельствует о блокирующем действии гидроксильных ионов во втором периоде.
На рис. 47 представлена кинетика твердения (по нарастанию пластической прочности) жидкого стекла с модулем 1,5 при введении в качестве отвердителя порошка p-2Ca0-Si02, а также изменения концентрации кальция в жидкой фазе. Переход кальция в раствор осуществлялся в этом случае сразу с максимальной скоростью, минуя первый, второй, третий периоды гидратации, и в Дальнейшем только ослабевает. Кальций в растворе связывается силикатными ионами, но прочность начинает нарастать, когда скорость образования агрегатов за счет сшивания кальцием силикатных ионов с образованием связок • Si—О—Са—О—Si: ; и выпадения этих агрегатов в виде твердой фазы существенно возрастет. Поэтому концентрация кальция в растворе сначала замедляется в своем росте, а затем начинает уменьшаться, т. е. Растворимые формы в процессе твердения играют роль промежуточных соединений. Максимальная концентрация Са выступает как величина, при которой скорость перехода Са в раствор Равна скорости его выпадения в твердую фазу. Эта последняя скорость определяется концентрацией и модулем жидкого стекла. Скорость перехода кальция в раствор, если она лимитируется стадией диффузии, будет мало зависеть от природы кальцийсо - ^еРжащих твердых фаз и станет сильно зависеть от их природы аРи ограничении процесса растворения химическими стадиями,
|
П= |
1,5 |
Я=1,98 |
П— |
3,4 - |
||
|
Исходная Са-фаза |
Исходная концентрация Si02 |
Предельная концентрация Са |
Исходная концентрация Si02 |
Предельная концентрация С а |
Исходная концентрация SiOa |
ПрєдельЦ^* концентра, ция Са |
|
Т а б л и ц а 23. Предельная концентрация Са, моль/л, в растворах силиката иатр„ различных модулей и концентраций J39J ' |
|
2,30 2,32 2,35 3,10 5,00 |
|
2,28 2,36 2,30 3,05 5,05 |
|
0,209 0,207 0,200 0,360 0,500 |
|
2,40 2,40 2,40 2,82 3,98 |
|
1 |
_ _ |
_ |
_ |
9 |
|||
|
Вода — 100 |
3 |
12 |
0 |
1 |
52 |
14 |
27 |
|
28 |
32 |
16 |
5 |
76 |
50 |
55 |
|
|
180 |
57 |
40 |
6 |
80 |
76 |
57,5 |
|
|
Жидкое стекло — |
3 |
Мгновенное |
47 |
15 |
0 |
Мгновенное |
|
|
100, е= 1300 кг/м3 |
28 |
Схватывание |
70 |
22 |
0 |
Схватывание |
|
|
180 |
92 |
110 |
0 1 |
||||
|
Раствор KF — 100 |
1 |
— |
— |
— |
— |
— |
22 |
|
0=1300 кг/см3 |
3 |
0 |
0 |
0 |
0 |
13 |
38 |
|
28 |
7 |
5 |
4 |
4 |
28 |
43 |
|
|
180 |
50 |
42 |
19 |
75 |
50 |
60 |
|
|
Жидкое стекло — 85, |
1 |
— |
— |
0 |
0 |
0 |
86 |
|
Раствор KF — 15 |
3 |
50 |
17 |
0 |
0 |
0 |
85 |
|
28 |
80 |
55 |
0 |
0 |
0 |
110 |
|
|
180 |
90 |
102 |
0 |
0 |
0 |
120 |
|
Таблица 24. Влияние KF на процесс гидратации клинкера и его отдельных фаз |65| |
|
Вид и состав затворителя, масс.^ |
|
Время гидратации, Сут |
|
Предел прочности при сжатии, МПа |
|
C3S |
|
P-c2s |
|
СзА |
|
C. AF |
|
Цементный клинкер |
Например при использовании менее основных, чем 2Ca0-Si02 силикатов кальция. Это рассуждение может быть подтверждено табл. 23 из того же источника [39].
В работе [64] блокирование поверхности портландцементного клинкера фосфат-ионами приводило к понижению концентрации кальция в жидкой фазе на полтора порядка в начальный период взаимодействия клинкера с жидким стеклом. Фосфат натрия (2,5 масс. %) вводился вместе с частью воды в систему пере^ добавлением жидкого стекла («=3,2; р=М50 кг/м3) в количестВе 10 масс. % от количества цемента.
|
C2S C3s Са(ОН)2 C3S C3s |
|
0,165 0,170 0,172 0,620 1,100 |
|
0,20 0,20 0,20 0,20 0,22 |
|
СА |
Использование KF в качестве замедлителя гидратации ие - мента и его отдельных фаз при их затворении раствором жидкого стекла исследовано в работе [65] и представлено в табл. 24
Действительно, силикатные фазы и СзА существенно ускоряют - сЯ в гидратации при замене воды жидким стеклом, причем ранний набор прочности реализуется, видимо, главным образом за счет силикатов, образующихся из жидкого стекла при переходе кальция в раствор. Более позднее нарастание прочности обусловлено скорее медленной гидратацией Са-содержащей фазы по обычному механизму в условиях потери подвижности системы. К сожалению, авторы [65] не указали модуль жидкого стекла, но если а=3, то 40% кремнезема вяжущей системы находится в жидком
Стекле и 60% в P-C2S.
При использовании C3S кремнезем делится примерно пополам между фазами. Естественно, что ранее образовавшиеся гидроси - дикаты кальция будут менее основными, чем получившиеся позднее, и в затвердевшей системе будет существовать градиент концентраций по кальцию.
Необходимость использования больших количеств фтористого калия для требуемого замедления гидратации силикатных фаз свидетельствует о том, что роль фтора состоит не только в блокировке поверхности твердой фазы, но и в перехвате перешедших в раствор ионов кальция. Сродство ионов кальция к иону фтора гораздо больше, чем к силикатному иону. Если на 100 г C3S используется 15 г раствора KF, то это означает, что в системе атомов Са в 14 раз больше, чем атомов фтора, но в раствор из C3S переходит только чуть больше трети кальция. Образование цепочек >Si—О—Са—F, не способных к сшиванию силикатных частиц, является основой замедления начального схватывания.
На алюминатные фазы раствор жидкого стекла и KF действуют иначе, и четких закономерностей по табл. 24 не прослеживается. Можно предполагать, что было использовано жидкое стекло разных модулей. Так или иначе, но в низкоосновных фазах СА или CS появляются в кристаллической решетке связи Si—О—Si или А1—О—А1, которые разрываются гидроксильными ионами, и для активизации таких фаз в вяжущей системе требуются гораздо более щелочные затворители — или низкомодульные жидкие стекла, или непосредственно щелочи.
Касаясь отношения жидкого стекла к другим Са-содержащим твердым фазам или, в более широком смысле, к твердым фазам, содержащим двухвалентные металлы, способные в принципе осаждать силикаты из раствора, следует отметить ярко выраженную избирательность, подчас почти непредсказуемую. Пожалуй, естественно, что структуры, сложившиеся за геологические периоды, или вещества СИЛЬНО отожженные ведут себя как инерты ПО отношению к жидкому стеклу, в то время как эти же вещества, образованные в более мягких условиях, активно с ним взаимодействуют. Этим обстоятельством широко пользуются, и подбором Температуры обжига твердой фазы создают требуемую активность по отношению к жидкому стеклу. Так, например, поступают с окисью магния. Более непонятно то, что мел вводят в
Жидкостекольные краски как инерт, практически не влияющИ| на жизнеспособность краски, т. е. не осаждающий силикаты из раствора и вполне совместимый с жидким стеклом. В то время известняк и мрамор с той же степенью измельчения могут рассматриваться как отвердители.