ИЗОТОПЫ И ИЗОБАРЫ
Существование атомов различных элементов, обладающих одинаковым атомным весом, наводило на мысль о том, что среди атомов одного и того же элемента должны существовать атомы различного веса. Эти атомы, очевидно, должны обладать одинаковым зарядом ядра, но иметь различный атомный вес.
Чтобы проверить справедливость этого предположения, необходимо было попробовать отделить такие атомы друг от друга. Но как это можно сделать? Ведь у атомов, ядра которых обладают одинаковым зарядом, электронные оболочки совершенно одинаковы.. Значит, и химические свойства их также одинаковы, <и разделить такие атомы химическими способами очень трудно.
Разделить различные атомы и определить их массы можно примерно таким же способом, каким определили массу электрона. Для того чтобы измерить массу атома этим способом, нужно, во-первых, зарядить атом. Ведь электрически незаряженный атом не отклоняется электрическими и магнитными силами. Для того чтобы зарядить атом, достаточно оборвать у него один или два электрона. Атом превратится в положительный ион (ионом называется заряженный атом; теряя электрон, атом превращается в положительно заряженный ион — коротко — положительный ион; присоединяя к себе лишний электрон, атом превращается в отрицательный ион). Заряд иона нам будет известен — он будет равен по величине (но не по знаку) заряду одного или двух электронов.
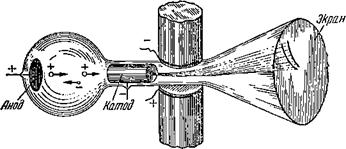
Опыт можно очень облегчить, если взять вещество, у которого атомы свободны, не связаны в молекулы. Кроме того, интересно изучить вещество, у которого атомный вес сильно отличается от целочисленного ‘). Очень подходящим элементом поэтому оказывается инертный газ неон (атомный вес 20,2), который и был исследован первым. Вот упрощённое изображение прибора, с помощью которого был исследован неон (рис. 17). Неон помещался под небольшим давлением в специальном сосуде. В газе, по многим причинам, всегда существуют свободные электроны. Бели очень сильно зарядить анод и катод (см. рисунок), то эти сводные электроны, отталкиваясь от катода и устремляясь к аноду, будут по дороге сталкиваться с атомами неона и обрывать у них электроны. Положительно заряженные ионы неона устремятся в обратном направлении, отталкиваясь от анода к катоду. Но сквозь отверстие в катоде пройдут не все ионы — длинный тонкий канал в катоде пропустит только те ионы, которые
•) О малых отклонениях атомного веса от целочисленного (на доли процента) мы говорить не будем. Такие отклонения связаны с запасом энергии в атомном ядре. Этот вопрос выходит за рамки нашей книжки.
Движутся в одном и том же направлении — вдоль оси прибора. Вылетев из катода, ионы подвергаются действию больших электрических и магнитных сил. Это делается при помощи сильного магнита. К полюсам его прикреплены металлические пластинки, защищённые от соприкосновения с железом магнита прокладками из изолятора. Эти металлические пластинки заряжаются разноимёнными зарядами. Под действием электрических сил ионы отклоняются вверх. Магнитные силы заворачивают их вправо.
Если бы все ионы, обладающие одинаковой массой и зарядом, имели одну и ту же скорость, все они пришли бы
|
Рис. 17. Упрощённая схема прибора для определения массы атомов Неона. |
В одну и ту же точку экрана. Но ионы зарождаются в самых различных местах трубки и подвергаются действию электрических сил разное время. Они получают в результате самые различные скорости и поэтому отклоняются по-разному. На экране ионы расположатся вдоль особой кривой линии, форму которой можно рассчитать. Быстрые ионы отклонятся меньше и окажутся ближе к оси трубки, медленные отклонятся сильнее.
Ионы различных масс и зарядов располагаются на различных кривых. Ионы с большой массой под действием тех же сил будут отклоняться меньше. По форме полученных кривых были определены массы ионов. Оказалось, что неон состоит из смеси атомов, часть которых имеет атомный вес 20, а часть—22. Более точные опыты позволили обнаружить ещё атомы неона с массой 21.
Конечно, кроме ионов, обладающих разными массами, в приборе окажутся ещё ионы, обладающие разными за
Рядами; ведь у некоторых атомов могут оказаться оторванными не один, но два электрона. Эти ионы будут отклоняться электрическими и магнитными силами гораздо сильнее. Они будут размещаться на экране на отдельных кривых.
Так было доказано, что атомный вес химического элемента есть в действительности средний вес различных по массе атомов.
Рис. 18. Левый верхний угол таблицы Менделеева. Показаны устойчивые изотопы. |
 Атомы одного и того же химического элемента, различные по массе, были названы изотопами, то-есть занимающими одно и то же место в таблице Менделеева.
Атомы одного и того же химического элемента, различные по массе, были названы изотопами, то-есть занимающими одно и то же место в таблице Менделеева.
Позднее были построены гораздо более совершенные приборы. Электрические и магнитные силы в них действуют так, что все ионы одинаковой массы, независимо от их скорости, собираются в одну точку. Эти приборы позволили определять массы ионов с точностью до сотых долей процента. Приборы эти называются масс - спектрографами. Все известные химические элементы исследованы теперь с их помощью. Оказалось, что почти все элементы обладают несколькими изотопами. Таким образом, почти в каждой клетке менделеевской таблицы оказывается несколько различных сортов атомов.
На рисунке 18 мы приводим тот же уголок таблицы, что и на рисунке 4, но так, как его следует писать в наши дни. Верхнее число здесь попрежнему — атомный номер, показывающий заряд ядра и число электронов в атоме. Числа, стоящие под названием элемента — атомные веса изотопов. Рядом с ними в скобках — содержание изотопов в обычном встречающемся в природе веществе. Так, изотопа неона с весом 20 в природном неоне содержится 90 процентов, изотопов веса 21—0,27 процента и изотопов веса 22—9,73 процента.
Сразу же ого-воримся: в клетках этой таблицы указаны только устойчивые, то-есть не радиоактивные изотопы.
Существуют в них ещё «временные жильцы»— неустойчивые изотопы, которые распадаются и перебираются «на постоянное жительство» в другие клетки. О них мы расскажем ниже.
Вы видите, что даже водород и тот обладает двумя устойчивыми изотопами с атомными весами 1 и 2. Более тяжёлый изотоп водорода, получивший особое название—«дейтерий», в соединении с кислородом даёт так называемую «тяжёлую воду». По своим свойствам она заметно отличается от обычной воды: тяжелее, замерзает при четырёх. градусах тепла и т. д.
Простейшее из всех существующих ядер — ядро изотопа водорода 1 получило название протон. Протон обладает зарядом, равным по величине заряду электрона, но обратным по знаку.
Часто один из изотопов значительно преобладает над другими. При этом средний атомный вес будет очень мало отличаться от веса преобладающего изотопа.
Так, кислород содержит 99,76 процента изотопа с весом 16, 0,04 процента с весом 17 и 0,20 процента с весом 18.
В качестве единицы массы физики принимают 7i6 веса изотопа 16, а химики Vi6 естественной смеси изотопов. Различие оказывается небольшим, так как изотопа 16 много больше, чем других.
Всем известное олово, средний атомный вес которого равен 118,7 состоит из десяти изотопов с весом от 112 до 124. Больше всего в нём изотопа с весом 120, а именно, 28,5 процента.
Как мы уже заключили из факта бета-распада, должны существовать также атомы различных элементов, обладающие одинаковым атомным весом. И действительно, существуют атомы калия с массой 40 и кальция с масоой 40, кадмия—112, 114, 116 и олова—112, 114, 116 и так далее.
Атомы различных элементов, обладающие одинаковым весом, называются изобарами.
Таким образом, таблица Менделеева гораздо богаче различными атомами, чем это представлялось раньше.
В наши дни известны 280 различных сортов атомов, имеющихся в природе. Дальше мы расскажем об искусственно получаемых атомах, число которых не меньше. Все искусственно получаемые атомы, если они отличаются от атомов, встречающихся между естественными изотопами, радиоактивны. Через сравнительно небольшой промежуток времени — от долей секунды и до нескольких дней, очень редко дольше, они (превращаются в атомы обычных, устойчивых изотопов.