ТЕХНОЛОГИЯ ПРОИЗВОДСТВА СОЕДИНЕНИЙ ЛИТИЯ ИЗ РУДНЫХ КОНЦЕНТРАТОВ
Продуктами переработки литиевых концентратов являются соли лития (карбонат, сульфат, хлорид) и гидроксид. Наиболее распространенный конечный продукт - карбонат лития, который служит исходным материалом для получения других соединений, в частности хлорида лития, из которого производят металлический литий.
В промышленной практике преимущественно применяют три способа разложения литиевых концентратов: сернокислотный, сульфатный (спекание с K2S04) и известковый. Кроме того, иногда используют известково-хлоридный способ.
Сернокислый способ
Разложение серной кислотой используют для литиевых концентратов всех типов: сподуменовых, лепидолитовых и амблигонитовых. В результате разложения концентрата концентрированной серной кислотой при 200 - 250 °С и последующего выщелачивания продукта водой получают растворы, содержащие сульфат лития, из которых осаждают карбонат лития.
Переработка сподумена. Для эффективного разложения сподумена серной кислотой необходима первоначальная термическая обработка его примерно при 1100 °С для превращения а - в /3-сподумен (а - сподумен практически не разлагается серной кислотой.). Обжиг проводят в барабанной печи. Особенность взаимодействия серной кислоты с /3- сподуменом состоит в замещении катионов лития протонами кислоты при сохранении структуры /3-сподумена:
О
2S0-300 с
Li20 • А1203 • 4Si02 + H2S04 Li2S04 + Н20 *
*А1203 • 4Si02. (10.1)
Поскольку кремний и алюминий остаются в неизменной решетке алюмосиликата, литий избирательно извлекается в водный раствор, который поэтому содержит сравнительно мало примесей.
Концентрат и серную кислоту смешивают в шнеке, который подает смесь в барабанную печь (стальной нефутерованный барабан), где при 250 °С быстро (10 - 15 мин) протекает сульфатизация.
Сульфатизированный материал выщелачивают водой, подавая в реактор мел для нейтрализации избытка серной кислоты (до рН = 6 + 6,5). Отфильтрованный раствор очищают от магния нейтрализацией известью (рН = 12 + 14), а затем от кальция осаждением СаС03 содой.
Примеси железа и алюминия осаждают в форме гидроксидов при рН = 7 при одновременной выпарке раствора до концентрации Li2S04 200 г/л.
После отделения осадка фильтрацией из раствора осаждают карбонат лития насыщенным раствором соды. Промытые осадки содержат 96 - 97% Li2C03. Извлечение в карбонат из сподуменового концентрата составляет 85 - 90 %.
Переработка лепидолита. Лепидолит можно непосредственно сульфатизировать серной кислотой при 320 - 330 °С. Для ускорения процесса иногда применяют предварительное плавление лепидолита при 1090 °С, превращая его в стеклообразную массу, которую после измельчения сульфатизируют.
Получаемые при переработке лепидолита сернокислые растворы содержат Li2S04, K2S04, Na2S04, Al2(S04)3.
Большую часть алюминия обычно выделяют в форме калиевых квасцов K[A1(S04)2] • 12Н20, охлаждая растворы до -5
0 °С (в раствор добавляют сульфат калия). Дополнительно алюминий выделяют из нейтрализованного раствора в составе А1(ОН)3. В процессе последующего выпаривания раствора кристаллизуется часть K2S04 и Na2S04. Из отфильтрованного раствора осаждают карбонат лития.
Сульфатный способ
Способ основан на спекании литиевых концентратов с сульфатом калия с последующим выщелачиванием спека водой.
В случае переработки сподумена в процессе спекания, проводимого при 920 - 1150 °С, а-сподумен превращается в /3-сподумен, который вступает в обменную реакцию с сульфатом калия:
2(Li, Na) [Al(Si03)2] + K2S04 2(K, Na)[Al(Si03)2] + U2S04. (Ю-2)
/3-сподумен а-лейцит
При охлаждении а-лейцит переходит в /3-лейцит. Переход а *■ /3-сподумен способствует быстрому протеканию твердофазной реакции вследствие того, что при перестройке решетки атомы обладают повышенной подвижностью.
Так как реакция (10.2) обратима, требуется большой избыток K2S04 {до 150%) для Обеспечения высокой степени превращения.
На рис. 80 приведена типовая схема переработки сподумена сульфатным способом.
Шихту спекают в барабанных печах при 1100 - 1150 °С в течение 1 - 2 ч. Выщелачивание проводят на холоду в барабанных мельницах (растворимость Li2S04 понижается с повышением температуры).
Сульфатные щелоки содержат 110 - 150 г/л Li2S04, 150 -
200 г/л K2S04, значительные количества Na2S04 примеси
Концентрат сподунена
K2S04
Ill
Смешение и измельчение Cnenatfue
Гг
Гашение спека
Їг
Выщелачивание и измельчение Декантации или фильтрование ■
NaOH
II
(К2С03)
Осатдение т'е/іеза и алюминия
Остаток
, t
(Отвал)
Промывная Вода
АКОЮз
И Fе(0Н),
3K2S04-Na2S04
Фильтрование
Раствор \
Упаривание
Кристаллизоиия гпазе/шта
Раствор сульфатов
Кек
Вода
IIГ
Промывка
Центрифугирование
Раствор Liz s"4
Іг
Осатдение карбоната
Насыщенный раствор Na2CQ3
Декантация Центрифугирование
I
Li2C03
Промывка
Вада
Ґ/аточньщ раствор Кристаллизация миробипита Центрифугирование
Na2s04-10h2q
И2С0} і
Сушка
FuTcoTF
Маточный раствор
(Конверсия в K2SO4 и пи в отвал)
Промывная вода
(на приготовление воствора Na2C03j
Рис.80. Технологическая схема переработки сподумена спеканием с сульфатом калия
Сульфатов Mg, Al, Fe. Эти примеси осаждают в форме гидро - ксидов гидроксидом натрия или карбонатом калия. Последующую переработку растворов с выделением карбоната лития проводят, используя различные варианты. Один из них показан на рис. 80. В этом варианте основное количество сульфата калия выделяют кристаллизацией двойной соли 3K2S04 - Na2S04 (глазерита), которую используют для приготовления шихты сподумена с K2S04.
Сульфатный способ применяют также для переработки лепидолита и циннвальдита, различие лишь в дозировке сульфата калия в шихте и ниже температура спекания (850 - - 950 °С).
К преимуществам сульфатного способа переработки литиевого сырья относятся его универсальность и высокая степень вскрытия концентрата. Недостаток - высокий расход сульфата калия. Однако создание более рациональных схем переработки растворов, обеспечивающих высокую степень регенерации K2S04, позволит существенно улучшить экономические показатели процесса.
Известковый способ
Известковый способ заключается в спекании литиевых концентратов (сподумена или лепидолита) с известью или мелом. При последующем выщелачивании спека водой получают раствор, содержащий гидроксид лития, который кристаллизуется в результате выпаривания раствора в составе моногидрата LiOH • Н20.
Рассмотрим основы этого процесса на примере сподумена. При спекании сподумена с известью (или мелом) в барабанных печах при 1150 - 1200 °С образуется алюминат лития и силикат кальция:
Li20 • А1203 • 4Si02 + 8СаО =
= Li20 • А1203 + 4(2СаО • Si02). (10.3)
При выщелачивании спека водой в присутствии избытка извести алюминат лития реагирует с Са(ОН)2 с образованием гидроксида лития:
Li20 • АІ2Оетв)+Са(ОН)2(раств)=2ЬІОН(раств)+СаО • А12Оэтв). (ю.4)
Содержащиеся в спеке алюминаты калия и натрия также реагируют с Са(ОН)2, образуя КОН и NaOH. Гидроксид лития LiOH • HjO кристаллизуют из растворов путем выпаривания под вакуумом. Выпаривание проводят в несколько стадий. Из растворов с концентрацией LiOH ~ 160 г/л после охлаждения выделяются кристаллы LiOH • Н20, которые отделяют от маточного раствора центрифугированием. Маточный раствор возвращается на выпаривание. По мере накопления примесей маточные растворы периодически выводят из цикла и направляют на регенерацию.
Если необходимо, кристаллы LiOH • Н20 очищают перекристаллизацией, используя для растворения очищенную воду. Для получения безводного гидроксида лития моногидрат обезвоживают при 600 - 650 °С.
Известковый способ применяют также при переработке ле - пидолитовых концентратов. В отличие от сподумена спекание лепидолита с известью (или мелом) проводят при более низкой температуре (900 - 950 °С).
К преимуществам известкового способа относятся его применимость к любым типам литиевых концентратов, возможность прямого получения гидроксида лития, дешевизна реагентов, возможность использования отходов (шлаков, содержащих силикаты и алюминаты кальция) для производства вяжущих строительных материалов, а также возможность попутного получения солей калия из маточных растворов.
Вместе с тем, способ имеет серьезные недостатки. Он преимущественно применим к богатым литиевым концентратам, однако и в этом случае извлечение в готовый продукт не превышает 70 %, что обусловлено ограниченной растворимостью гидроксида лития и способностью шламов после выщелачивания к схватыванию. Другой недостаток - необходимость выпаривания больших объемов растворов.
Получение чистого хлорида лития
Безводный хлорид лития, служащий исходным материалом для производства лития, обычно получают из карботана лития. По действующим в СССР техническим условиям в хлориде лития допускается содержание примесей в следующих пределах, % не более: Na 0,12; Ca 0,03; Al 0,05; Fe 0,005; SO*~ 0,1; Si02 0,05; POf 0,005. 336
Для получения хлорида лития указанной чистоты обычно требуется предварительная очистка карбоната лития от примесей. Очистку проводят методом перекристаллизации через хорошо растворимый бикарбонат лития (способ Труста). С этой целью через водную суспензию Li2C03 пропускают С02, что приводит к переходу лития в раствор в виде бикарбоната LiHC03.
При кипячении раствора бикарбонат разрушается, из р. ас - твора осаждается очищенный Li2C03.
Для получения хлорида лития влажный карбонат растворяют в 30 %-ной соляной кислоте. Раствор очищают от примеси ионов SOJ" добавлением ВаС12. Затем для очистки от других примесей раствор нейтрализуют добавлением LiOH до щелочности 0,01 н. При кипячении выделяются гидроксиды, карбонаты или основные соли примесей кальция, бария, магния, железа.
Очищенный раствор с концентрацией LiCl 350 - 360 г/л поступает на выпаривание. Трудности выпаривания и последующего обезвоживания хлорида обусловлены высокой корродирующей способностью LiCl и его растворов. Для выпаривания используют аппараты из керамики или специальных сплавов, а для обезвоживания хлорида - керамическую аппаратуру. В результате выпаривания кристаллизуется хлорид LiCl • Н20. Хлорид затем обезвоживают при 120 - 150 °С.
3. ТЕХНОЛОГИЯ ПРОИЗВОДСТВА ЛИТИЯ
Получение лития электролизом
Вследствие высокого сродства к кислороду и к галогенам литий получают либо электролизом расплавленных сред, либо металлотермическим восстановлением с отгонкой лития.
Электролиз проводят в электролите при соотношении LiCl: КС1 = 1:1 (по массе), что близко к составу эвтектики в системе LiCl - КС1, плавящейся при 361 °С. Это позволяет проводить электролиз при 400 - 460 °С.
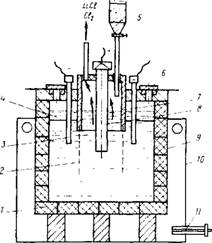
На рис. 81 показана принципиальная схема электролизера с двумя прикатодными пространствами, отделенными от анодного пространства диафрагмами. Стальной кожух ванны футеруют графитом - наиболее устойчивым материалом по отношению к хлориду лития. Однако и графит медленно взаимодейс-
Ріс.81. Схема электролизера для получения металлического лития: 1 - графитовая футеровка; 2 - диафрагма из железной сеткк; 3 - стальные катоды; 4 - жидкий литий; 5 - бункер для загрузки солей; 6 - отверстие для вычерпывания жидкого лития; 7 - диафрагма; 8 - графитоиый анод; 9 - стальной кожух ванны; 10 - камера для разогрева ванны; 11 - газовая горелка
Твует с образованием карбида лития Li2C2, разлагающегося в электролите с выделением углерода. Графитовая футеровка и аноды в промышленных ваннах работают около трех месяцев. Для получения лития более высокой чистоты применяют металлические злектолизеры с водоохлаждаемыми стенками, на которых образуется гарниссаж из застывших солей, защищающий электролит от взаимодействия с металлической стенкой.
Для расплавления электролита можно использовать внешний нагрев, в дальнейшем тепловой режим поддерживается теплом, выделяющимся при прохождении тока через электролит.
Катодами служат пластины из низкоуглеродистой стали, анодами - графитовые стержни. Потенциалы разложения LiCl и КС1 в электролите эвтектического состава при 400 °С равны 3,78 и 3,89 В соответственно, что обусловливает частичное выделение калия на катоде.
Электролиз ведут при 400 - 430 °С при плотности тока на катоде и аноде 2,0 - 5,0 и 0,8 - 1,5 А/см2 соответственно. Выход по току достигает 90 - 93 %. Выделяющийся на катоде жидкий литий всплывает на поверхность электролита, и его вычерпывают железной сетчатой ложкой по мере накопления. Металл защищен от окисления тонкой пленкой солей, хорошо смачивающих жидкий литий.
По ходу электролиза в анодное пространство периодически вводят LiCl, поддерживая в ванне его содержание 55 - 57 % (по массе). Примерное содержание примесей в электролитическом литии, %:Na 0,3 - 2,5; К 0,02 - 1,5; Си, Fe, Са - от 0,001 до 0,4; Si 0,004 - 0,8; А1 0,002 - 0,12; Mg 0,003; СІ 0,01.
Хлор из анодного пространства направляется в абсорбер, орошаемый известковым молоком.
Электролизом, помимо лития, можно получать сплавы лития с другими металлами (кальцием, магнием, тяжелыми металлами). Для этого либо вводят в электролит хлорид соответствующего металла, либо ведут электролиз с растворимым анодом из металла - компонента сплава с литием.
Получение лития вакуумгермическими методами
Электролитический метод получения лития имеет определенные недостатки: исходный хлорид лития относительно дорог. Вследствие близости потенциалов выделения лития, калия и натрия электролитический литий содержит заметное количество примесей калия и натрия, что требует его дополнительной очистки. Необходимо поглощение или утилизация выделяющегося на аноде хлора. В связи с этим разработаны варианты вакуумтермических методов получения лития восстановлением из оксида лития, моноалюмината (Li20 А1203), а также непосредственно из сподумена.
Восстановление оксида лития. Оксид лития получают термическим разложением карбоната лития. При 810, 890 и 1270 °С давление С02 над карбонатом лития равно 2; 4,3 и 101 кПа (15, 32 и 760 мм рт. ст) соответственно. Чтобы в процессе разложения карбоната лития не происходило его расплавления (температура плавления Li2C03 735 °С), что затрудняло бы удаление С02, оксид лития получают прокаливанием брикетированной смеси Li2C03 и СаО (при соотношении 1:1,5 по массе) при 850 °С в вакууме (для сдвига реакции в сторону выделения С02). В результате получают смесь Li20 с СаО. Последняя, как показано ниже, является полезным компонентом шихты.
В качестве доступного восстановителя оксида лития применяют порошкообразный кремний:
2Li20 + Si = Si02 + 4Li (10.5)
При стандартных условиях реакция (10.5) характеризуется положительным изменением энергии Гиббса и является эндотермической:
ДС»8К = 298 кДж, ДЯ°298К = 320 кДж.
Следовательно, реакция (10.5) может протекать при повышенных температурах в вакууме с отгонкой газообразного лития из сферы реакции. Однако в этих условиях часть оксида лития связывается в ортосиликат:
4Li20 + Si = 4Li(ra3) + Li4SiQ4. (10.6)
Присутствующий в исходной шихте оксид кальция предотвращает эту реакцию, связывая Si02 в ортосиликат кальция:
Li4Si04 + Si + 4СаО = 4Li(ra3) + 2Ca2Si04; (Ю.7)
О
Д^іооок = -351 КДж.
Прокаленную смесь лития и кальция измельчают, смешивают с порошком кремния (избыток 10 % против расчетного количества) и брикеты из этой смеси нагревают в вакуумной печи при 1000 - 1300 °С и давлении в печи 0,113 Па. Литий собирается в конденсаторе. Выход лития при 1000 °С - 75%, при 1300 °С - до 93%. Основные примеси: 0,04% Са и 0,01% Si.
Восстановление алюмината лития. Литий высокой чистоты с выходом 95 - 98% можно получить восстановлением моноалюмината лития алюминием в вакууме при 1150 - - 1200 °С. Алюминат лития получают прокаливанием смеси Li2C03 с А1203.
Восстановление протекает по реакции:
3(Li20 • А1203) + 2A1 = 6Li(ra3) + 4Al203. (ю.8)
Равновесное давление лития для этой реакции при 1100 °С равно 33,3 Па. Следовательно, восстановление можно проводить при 1200 °С и остаточном давлении около 13,3 Па. Для достижения высокого извлечения лития применяют избыток алюминия. Восстановление алюмината лития не требует введения в шихту оксида кальция, что обеспечивает получение металла более высокой чистоты.
Образующийся в результате восстановления оксид алюминия используют для получения алюмината лития.
Рафинирование лития
Для очистки лития от механических примесей используют переплавку и отстаивание под слоем вазелинового или парафинового масла, а также фильтрование жидкого лития через сетчатые или проволочные фильтры из железа, титана или молибдена. Порошкообразные или губчатые титан и цирконий, уран могут служить поглотителями кислорода и азота из расплавленного лития. Эти металлы практически нерастворимы в литии.
Очистку от других щелочных металлов ведут, используя различие в термической устойчивости гидридов. Давление диссоциации гидридов LiH, КН и NaH достигает 0,1 МПа (1 ат.) при 850, 427 и 420 °С соответственно. Температура плавления гидрида лития 688 °С. При нагревании лития в водороде при 700 - 800 °С калий и натрий испаряются и остается LiH, который затем разлагается нагреванием в вакууме. Сильно загрязненный литий, например, полученный восстановлением сподумена, может быть очищен электролитическим рафинированием.
Эффективен метод рафинирования лития дистилляцией в вакууме. Сначала при 450 °С отгоняют основное количество примесей щелочных металлов (калия, натрия). Литий затем испаряют при 600 - 800 °С под давлением 1,3 • Ю-3 Па (~10_5мм рт. ст.), поддерживая температуру в конденсаторе 340 - 420 °С. При извлечении лития в конденсат 85 - 90 % содержание примесей в нем снижается до тысячных долей процента. Дистилляционные установки изготовляют из металлов, не взаимодействующих с литием. К ним относятся чистое железо, титан, ниобий, тантал, молибден.
Меры безопасности, упаковка и хранение лития
При плавке и разливке лития на воздухе возможно его загорание. Загоревшийся металл рекомендуется засыпать сухим хлористым натрием, хлористым литием, содой (не бикарбонатом) или смесью, состоящей из инертного порошка (графит, хлорид натрия), 10 - 20 % вязких органических веществ (смола, смешанная с полиэтиленом) и добавок стеара - тов и талька. Литий выпускают в виде слитков, гранул, прутков, проволоки. Хранят литий в герметичной железной таре под слоем пастообразной массы из парафина и минерального масла либо под газолином или петролейным эфиром, заполняющими тару доверху. Перед применением лития минеральное масло смывают петролейным эфиром или бензолом, которые затем испаряют в вакууме. Удобно хранить литий, запрессовывая его в герметичные тонкостенные трубчатые алюминиевые или медные оболочки, от которых затем можно отрезать нужные куски лития.