ПРОИЗВОДСТВО ТРИОКСИДА МОЛИБДЕНА
Молибденовые минералы, руды и концентраты
Молибден - малораспространенный элемент. Среднее содержание его в земной коре 3 • Ю-4 % (по массе).
Известно около 20 минералов молибдена, из которых промышленное значение имеют четыре: молибденит MoS2, повел- лит СаМо04, молибдит Fe2(Mo04)3'7 '/2 Н20 и вульфенит PbMo04. За исключением молибденита все минералы относятся к вторичным, образовавшимся в результате окисления молибденита. В рассеянном состоянии молибден иногда присутствует в лимоните и некоторых сульфидных минералах, особенно в халькопирите.
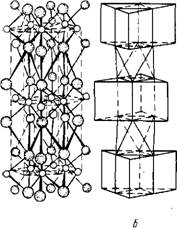
ОМо ©S а
Молибденит MoS2 - наиболее распространенный и промыш - ленно важный минерал молибдена. Это мягкий, свинцово - серого цвета минерал. Плотность 4,7-4,8 г/см3, твердость по минералогической шкале 1-1,5. Молибденит обладает гексагональной кристаллической решеткой слоистого типа (рис.5). Слои ионов молибдена расположены между двумя слоями ионов серы и образуют трехслойные упаковки. Совершенная спайность кристаллов молибденита обусловлена слабой связью между тройными слоями S-Mo-S. Молибденит встречается большей частью в кварцевых жилах, часто ас-
Р«с. 5. Кристаллическая структура молибденита;
А - расположение центров ионов; б - та же решетка, изображенная в виде координационных полиэдров - тригональних призм (в центре призм - ионы молибдена, в вершинах - ионы серы)
социируется с шеелитом, касситеритом, вольфрамитом, висмутовым блеском, пиритом, халькопиритом, арсенопиритом.
Минерал иногда содержит изоморфную примесь редкого металла рения (от 0,04 до 0,0004 %).
Повеллит и молибдит встечаются часто в зонах окисления молибденитовых руд. Состав молибдита непостоянен, его можно выразить общей формулой xFe203 • уМоОэ • zH20.
Вульфенит встречается в окисленных зонах свинцовых месторождений. В настоящее время промышленное значение этого минерала невелико.
Различают несколько типов молибденовых руд:
Простые кварцево-молибденовые руды, в которых молибденит залегает в кварцевых жилах.
Кварцево-молибдено-вольфрамитовые руды, содержащие наряду с молибденитом вольфрамит.
Скарновые руды. В рудах этого типа молибденит часто с шеелитом и некоторыми сульфидами (пирит, халькопирит) находится в кварцевых жилах, заполняющих трещины в скарнах (окремненных известняках).
Медно-молибденовые руды, в которых молибденит сочетается с сульфидами меди и железа.
В некоторых рудах содержание меди невелико, в других - превалирует медь, а содержание молибдена незначительное (сотые и тысячные доли процента). Молибден извлекается из них попутно с медью.
Наиболее значительные месторождения молибденовых руд в зарубежных странах находятся в западной части США, Мексике, Чили, Юго-Восточной части Канады, Южной Норвегии и восточных штатах Австралии.
Ряд месторождений эксплуатируется в СССР: на Северном Кавказе и в Закавказье, Казахстане, Красноярском крае и других районах. Эксплуатируются руды с содержанием от 0,05 до 1-2 % молибдена.
Для обогащения молибденсодержащих руд применяют почти исключительно флотацию. Обогащение простых кварцево - молибденовых руд несложно. Вначале обычно проводят коллективную флотацию сульфидов. Затем флотируют молибденит при депрессировании сульфидов меди и железа сернистым натром или цианидами в щелочной среде. После нескольких перечисток получают концентраты, содержащие 85-95 % MoS2 при извлечении из руды 90 %. В качестве пенообразователя 42 применяют сосновое масло, собирателями служат керосин, трансформаторное масло.
При обогащении медно-молибденовых руд вначале получают коллективный медно-молибденовый концентрат. Затем медь и молибден разделяют, флотируя молибден при депрессировании сульфидов меди.
При обогащении кварцево-молибдено-вольфрамитовых руд сочетают методы гравитации (для получения вольфрамитового концентрата) и флотации (для молибденита).
При обогащении шеелито-молибденитовых скарновых руд вначале флотируют молибденит, а затем из хвостов молибденовой флотации извлекают шеелит (вместе с повеллитом) флотацией при помощи жирных кислот.
При обогащении некоторых медно-молибденитовых руд и окисленных руд получают в результате обогащения промпро - дукты, бедные по содержанию молибдена, которые направляют на гидрометаллургическую переработку с целью получения "химического концентрата".
По действующим в СССР государственным стандартам в мо- либденитовых концентратах марок КМ1, КМ2 и КМЗ содержание молибдена должно быть не ниже 50, 48 и 47 % соответственно. В них лимитируется содержание примесей Р, As, Си, Si02, Sn.
Производство молибденовых концентратов в капиталистических странах в 1985 г. находилось на уровне 80700 т (по содержанию металла). Из них примерно 60 % производят США, 20% Чили, 10% Канада.
Способы переработки молибденовых концентратов
Молибденитовые концентраты служат исходным сырьем для производства ферромолибдена и химических соединений — триоксида молибдена. Последний получают из огарка - продукта окислительного обжига концентрата, используя метод возгонки или химическую (гидрометаллургическую) переработку. Молибденит можно разложить, используя гидрометаллургические методы окисления, исключающие окислительный обжиг. К ним относятся окисление азотной кислотой, автоклавное окисление кислородом в щелочных и кислых растворах, окисление растворами гипохлорита натрия. Разложение азотной кислотой уже используют в промышленной практике.
Окислительный обжиг молибденитовых концентратов Теоретические основы
При окислительном обжиге молибденитового концентрата протекает ряд химических реакций, которые можно подразделить на четыре группы:
Окисление молибденита с образованием триоксида молибдена.
Взаимодействие между триоксидом молибдена и молибденитом.
Окисление сульфидных минералов сопутствующих элементов (меди, железа и др.) с образованием оксидов и сульфатов.
Взаимодействие между триоксидами молибдена и оксидами, карбонатами, сульфатами элементов-примесей с образованием молибдатов.
Окисление молбденита. При температуре выше 500 С минерал молибденит интенсивно окисляется кислородом воздуха с образованием МоОэ по суммарной экзотермической реакции
MoS2 + ЗУ2 02 = Мо03 + 2S02. (1.25)
Эта реакция практически необратима (AG° = -880 кДж/моль) и протекает при сколь угодно малой концентрации кислорода в газовой фазе. Высокий тепловой эффект реакции (957 кДж/моль) обеспечивает возможность проведения обжига за счет теплоты процесса при температуре выше возгорания молибденита. Последняя зависит от крупности частиц концентрата, а также условий обжига и находится в интервале 365-500 С.
При окислении частицы молибденита покрываются оболочкой триоксида молибдена, через которую кислород и сернистый газ должны диффундировать в противоположном направлении. Исследования показали, что при 550-600 С оксидная оболочка пористая и не препятствует протеканию окисления.
При отсутствии или ограниченном доступе воздуха при температурах 550-600 С триоксид молибдена реагирует с молибденитом с образованием диоксида молибдена:
MoS2 + 6Мо03 = 7Мо02 + 2S02. (1.26)
При обжиге насыпного слоя концентрата на поду печи диоксид молибдена образуется в начальный период окисления вследствие взаимодействия наружного слоя МоОэ с нижележащими слоями MoS2. Когда большая часть MoS2 прореагирует, диоксид молибдена окисляется до триоксида. Следовательно, процесс окисления MoS2 при обжиге включает
Следующие стадии:
MoS2 + 3,5 02 = МоОэ + 2S02; (1.27)
MoS2 + 6Mo03 = 7Мо02 + 2S02; (1.28)
Мо02 + 1/202 = Мо03. (1.29)
Необходимо проводить обжиг в условиях, обеспечивающих полное окисление Мо02 до Мо03. В частности, температура обжига не должна превышать 600 С во избежание образования спекшихся кусков огарка, внутрь которых затруднен доступ воздуха.
Окисление примесей других сульфидов. Известно, что сульфиды меди, железа, цинка, свинца реагируют с кислородом при температурах 550- 600 °С с образованием оксидов и сульфатов:
Me S + 1,5 02 = Me О + S02; (1.30)
2SOz + 02 2S03; (1.31)
Me О + S03 Me S04. (1.32)
Следует отметить, что поверхность частиц Мо03 служит катализатором образования S03 в результате реакции S02 с кислородом. Сульфаты железа в значительной степени диссоциируют выше 450-500 С, сульфаты меди - выше 600-650 °С, сульфат цинка - выше 700 С.
Если в концентрате содержится кальцит, в процессе обжига возможно образование сульфата кальция:
СаС03 + S03 = CaS04 + С02. (1.33)
Образование молибдатов. В интервале температур 500-600 С триоксид молибдена взаимодействует с оксидами, карбонатами и сульфатами ряда элементов с образованием молибдатов:
СаСОэ + Мо03 = СаМоО, + С02; (1.34)
CuO + Мо03 = CuMo04; CuS04 + M0O3 = CuMoO, + S03(S02, 02); Fe203 + ЗМ0О3 = Fe2(Mo04)3.
По аналогичным реакциям образуются ZnMo04 и PbMo04.
Кремнезем, обычно содержащийся в молибденитовых концентратах, не взаимодействует с триоксидом молибдена.
Практика обжига
На заводах обжиг молибденитовых концентратов проводят в многоподовых печах с механическим перегребанием и в печах кипящего слоя при 560-600 °С. Иногда обжиг ведут в барабанных печах, которые однако мало пригодны для обжига сульфидных концентратов так как в них трудно обеспечить поддержание необходимой температуры.
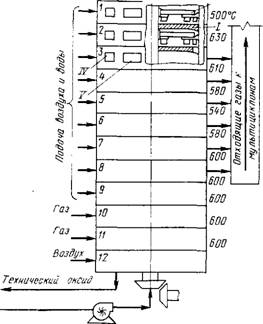
Обжиг в многоподовых печах. Многоподовые печи широко используют в цветной металлургии для обжига сульфидного сырья. В печах этого типа осуществляется противоток материала и газов и интенсивное окисление при пересыпании материала с пода на под, что обеспечивает возможность ведения процесса за счет теплоты реакции. Обжиг ведут в печах с 8, 12 и 16 подами. Температуру регулируют подачей воздуха отдельно на каждый под, газы с подов отводятся в общий газоход (рис.6). Можно эффективно регулировать температуру впрыскиванием на каждый под вместе с воздухом некоторого количества воды. На первых двух подах 12-подовой печи испаряются и сгорают фло - тореагенты и лишь несколько окисляется молибденит. Во второй зоне (3-6 поды) окисление протекает с преимущественным образованием Мо02 (по реакции между MoS2 и МоОэ). В третьей зоне (7-8 поды) диоксид молибдена окисляется до Мо03. В четвертой зоне (9-11 поды) завершается окисление (содержание серы ~0,1 %), причем на этих подах устанавливают горелки, так как тепла не хватает.
Пылевынос при обжиге в многоподовых печах составляет 10-15 %. Система пылеулавливания состоит из циклонов и электрофильтров. Пыль неполно окислена и возвращается на дообжиг.
Производительность печей по концентрату 70-80 кг на 1 м2 пода в 1 сут.
Обжиг в печах кипящего слоя (КС). В печах КС частицы материала находятся в восходящем потоке газа в "кипящем" или "псевдожидком" состоянии, характеризуемом интенсивным движением (циркуляцией) частиц. В такое состояние зернистый материал переходит при достижении некоторой критической скорости газового потока, определяемой из зависимости между сопротивлением слоя и линейной скоростью газа.
Концентрат MoSj Воздрат пыпи
Выпуск Воздуха, охлаждающего Зал, 8 атмосферу
Т°с
Рве. 6. Схема 12 - подовой печи для обжига >толибденитового концентрата (фирма Клаймакс, США):
I - под; II - полый вал; III - держатель с гребками; IV - окна для подачи воздуха; V - дверки для чистки
Л ГГГ
Сопротивление КС аналогично гидростатическому давлению столба жидкости и может быть рассчитано по уравнению:
ЬР = HitTB - ГгазХі - S),
Где H - высота КС; и ^газ - плотность твердых частиц и газа; б - относительная доля газа в единице объема слоя ("порозность слоя").
Преимущества обжига в КС вытекают из следующих его особенностей:
Благодаря хорошему контакту частиц с газом химические реакции в КС протекают быстро;
Подвижность слоя, подобная подвижности жидкости, позволяет легко осуществить непрерывную выгрузку, "вытекание" материала из печи через разгрузочную трубу;
КС обладает высокими теплопроводностью и коэффициентами теплопередачи. Это позволяет поддерживать во всей массе слоя заданную температуру. Избыточное тепло из слоя легко отводится с помощью холодильников.
Применительно к обжигу молибденитовых концентратов обжиг в КС был впервые исследован и осуществлен в промышленных масштабах в СССР. На рис.7 показана одна из конструкций печи КС и общая схема установки. Печь представляет собой огнеупорную шахту прямоугольного или круглого сечения в нижней части ее находится воздухораспределительная
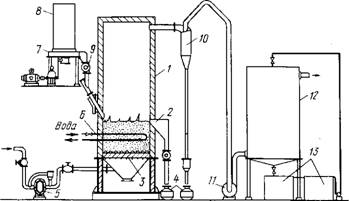
Рже. 7. Схема установки для обжига молибденитовых концентратов в кипящем слое:
1 - шахта печи; 2 - порог выгрузки; 3 - подина; 4 - сборники огарка и пыли; 5 - воздуходувка; 6 - система водяного охлаждения; 7 - тарельчатый питатель; 8 - бункер; 9 - шлюзовый питатель; 10 - циклон; 11 - вентилятор; 12 - мокрый электрофильтр; 13 - сборники пульпы
Решетка (подина), которая состоит из стальных сопел с грибовидными съемными колпачками.
Концентрат подается в печь из бункера тарельчатым пи - тате-лем с регулируемым числом оборотов тарелки. На уровне 1000 - 1500 мм от подины расположен разгрузочный порог, через который непрерывно выгружается огарок. Температура в слое (560 - 570 °С) поддерживается автоматическим регулированием подачи в слой концентрата в пределах ±2,50 от заданной. Избыточное тепло отводится подачей воды в трубы, установленные в КС. Часть тонких частиц концентрата (20 - 40 % в зависимости от гранулометрического состава) уносится с газами из слоя. Система, состоящая из циклонов и электрофильтра, обеспечивает полное улавливание пыли, причем в циклонах ее оседает 85 - 90 %.
Циклонная пыль при принятых режимах обжига окислена не полностью и содержит 8 - 10 % серы. Пыль можно возвращать на обжиг после предварительной грануляции на чашевом грануляторе. Опыт работы промышленных печей показал следующие преимущества обжига в КС:
А) производительность печей КС, равная 1200 - 1300 кг/м2 пода печи в сутки, в 15 - 20 раз выше, чем подовых обжиговых печей;
Б) процесс полностью автоматизирован, обжиг ведется при строго определенной температуре;
В) огарки КС не содержат диоксида молибдена, а содержание молибдатов в них ниже, чем в огарках подовых печей. Это обеспечивает более высокое прямое извлечение молибдена в аммиачные растворы при гидрометаллургической переработке огарков;
Г) при обжиге в КС с газами удаляется более 90 % рения в виде Re207, тогда как при обжиге в подовых печах степень отгонки рения составляет 60 - 70 %.
Недостаток обжига в КС - высокое содержание в огарка* общей серы (2 - 2,5 %, из которых 1,5 - 2 % - сульфатная сера). Это объясняется тем, что при обжиге в КС подавляющая часть кальцита реагирует с S03 с образованием CaS04 , тогда как при обжиге в подовых печах кальцит, находящийся в контакте с МоОэ, переходит в СаМо04. Вследствие высокого содержания серы огарки КС непригодны для выплавки ферромолибдена. На ферросплавных заводах обжиг ведут в многоподовых печах.
Производство чистого триоксида молибдена Способ возгонки1
Относительно низкая температура кипения триоксида молибдена (1155 °С) послужила основой для разработки промышленной технологии ее получения из молибденовых огарков методом возгонки. Метод применяют на заводах США и Австрии.
Ниже приведено давление пара триоксида молибдена при различных температурах:
T, °С 650 750 800 900 1000 1100 1155
Р, кПа.... 0,066 0,233 1,34 7,15 26,4 63,4 101
В парах молекулы МоОэ полимеризованы. При 800 - 1100 °С в парах преобладает тример Мо309.
Скорость испарения зависит от температуры и скорости газа над поверхностью расплава (МоОэ плавится при 795 °С). Даже при относительно малых скоростях воздуха (0,2 - 0,3 см/с) скорость испарения чистого триоксида молибдена значительна и возрастает от 12,3 при 900 °С до 110 кг/(м2-ч) при 1100 °С.
Скорость испарения из огарков существенно ниже, чем из чистого триоксида, так как в них содержатся примеси, снижающие давление пара МоОэ. По мере испарения скорость испарения из огарков уменьшается вследствие увеличения концентрации в них примесей.
Скорость испарения из огарков, содержащих 48 - 50 % молибдена, при 1000 °С и скорость потока воздуха 2 - Зсм/с составляют величину порядка 10 - 20 кг/(м2-ч). Наиболее сильно влияют на скорость и степень возгонки примеси оксидов кальция, магния и свинца, образующих прочные молибдаты. Молибдат железа Fe2(Mo04)3 термически устойчив в присутствии избытка МоОэ. Примесь СиО мало влияет на степень возгонки, так как CuMo04 разлагается при температурах процесса (950 - 1100 °С). Молибдат свинца заметно испаряется при 1050 °С без разложения. Поэтому
Способ носит название "возгонка", хотя речь идет об испарении, так как выше 800 °С триоксид находится в жидком состоянии.
В присутствии примеси свинца во избежание загрязнения возгонов процесс следует проводить при 900 - 950 °С. Возгонку триоксида молибдена из огарков на предприятиях США ведут в электрических печах непрерывного действия с вращающимся кольцевым подом, покрытым слоем кварцевого песка (рис.8). Нагрев осуществляется стержнями из карбида кремния (силитовые стержни), расположенными радиально над подом. Огарок непрерывно загружается на подину, расплавляется и пропитывает слой песка. Подаваемый в печь воздух уносит пары триоксида молибдена через ряд отверстий, рас-
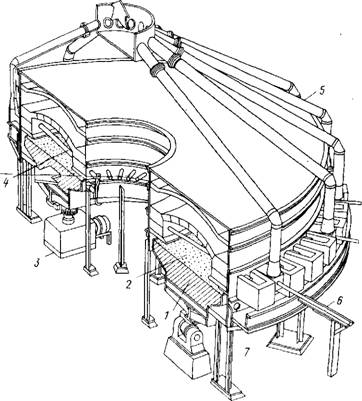
Рис. 8. Разрез электрической печи непрерывного действия с вращающимся коль Цевым подом для возгонки Мо03 из огарков (фирма Клаймакс, США): 1 - кольцевой вращающийся под; 2 - шихта; 3 - привод; 4 - силитовый нагрева тельный элемент; 5 - трубы, отсасывающие пары триоксида; 6 - труба, отсасы вающая пыль из участка загрузки; 7 - отверстие для подачи воздуха
Положенных на уровне пода, в общий коллектор, откуда через систему кулеров (где оседает часть МоОэ) газы поступают в рукавные фильтры.
Загружаемый огарок проходит под нагревательными элементами один раз. За один оборот пода возгоняется ~60 - 65 % МоОэ. Оставшаяся масса удаляется с пода шнековым скребком и перерабатывается гидрометаллургическим способом или поступает на выплавку ферромолибдена. Производительность печи 3,75 т чистого Мо03 в 1 сут.
Если используется высокосортный молибденитовый концентрат (56% Мо; 0,16% Си; 0,38% Fe; 0,06% Са; 0,04% Pb; 0,28 % А1203; 4,5 % Si02), возогнанный триоксид имеет высокую чистоту (99,975 % МоОэ). Он дисперсен (насыпная масса ~0,24 г/см3, тогда как обычно используемый в производстве триоксид молибдена имеет насыпную массу ~0,8 - 1г/см3). Столь легкие, объемистые порошки неудобны для транспортировки и использования. Перед упаковкой возогнанный триоксид увлажняют водой, уплотняют и сушат.
Преимущества способа возгонки состоят в получении чистого триоксида молибдена без затрат реагентов по короткой технологической схеме. Однако триоксид высокой чистоты можно получить из богатых, с малым содержанием примесей, концентратов. Другой недостаток - малая насыпная масса триоксида, что затрудняет непосредственное его использование для производства молибдена восстановлением водородом. С целью получения более "тяжелого" Мо03, а также дополнительной очистки возогнанный триоксид растворяют в аммиачной воде и выделяют из раствора парамолибдат аммония (см. ниже).
Гидрометаллургический способ переработки огарков
Наиболее распространен аммиачный способ переработки огарков (рис.9). Огарок выщелачивают раствором аммиака. Из раствора после очистки его от примесей выделяют парамолибдат аммония.
Выщелачивание. При обработке огарка растворами аммиака МоОэ растворяется с образованием молибдата аммония:
MoOj + 2NH4OH = (NH4)2Mo04 + H20 .
Реакция растворения экзотермическая. Тепловой эффект ее равен 161 кДж/моль, реакция необратима и имеет первый порядок по концентрации аммиака:
(dGMO/dr) = - KGmoCnh , 1 з
Где GMO - содержание молибдена в твердой фазе (в долях единицы по отношению к исходному содержанию).
В интервале 20 - 60 °С зависимость константы скорости выщелачивания от температуры при концентрации аммиака 8 % описывается уравнением:
Раствор NH40H
1пАГ = -9600/Г + 31,6 .
Обожженный малибденитовый концентрат (огарок)
(1.38)
Выщелачивание
I
Хвосты \
(NH4)2S
Очищенный раствор
На дополнительное извпечение молибдена
Раствор
7іГ
Очистка
1
Сульфидный кек В отвал
Вариант I
НС1
Нейтрализация
ВариантП
Выпарка Кристаллизация
Маточный раствор
Кислый маточный растВор
Осадок лолималибдата
Перекристаллизация На регенерацию молибдена
Маточный раствор
Периодически
Выводят на очистку am лримесей
Кристаллы ларамалибдата аммония Прокаливание
Трехокись молибдена
Рис. 9. Схема получения триоксида молибдена из огарков гидрометаллургическим способом
Энергия активации Е = 79,5 кДж/моль, что отвечает протеканию выщелачивания в кинетической области (при условии интенсивного перемешивания).
Степень извлечения молибдена из огарка в аммиачный раствор зависит от состава огарков. Примеси молибдата кальция, диоксида молибдена и оставшегося неокисленным молибденита практически нерастворимы в аммиачной воде. Связанный в эти соединения, молибден остается в хвостах выщелачивания.
Молибдаты железа разлагаются аммиачной водой, но недостаточно полно вследствие образования пленок гидроксидов железа. Двухвалентное железо частично переходит в аммиачный раствор в форме железо-аммиачного комплекса [Fe(NH3)6]2+.
Молибдаты и сульфаты меди, цинка и никеля легко растворяются в аммиачной воде с образованием аммиачных комплексов [Me(NH3)„]2+. Для меди и цинка п = 4, никеля п = = 6. Содержащийся в огарках после обжига в КС сульфат кальция при выщелачивании аммиачной водой переходит в менее растворимый молибдат кальция:
CaS04 + MoOf = СаМо04 + SOf. (i,39)
Это понижает степень выщелачивания триоксида молибдена. Для предотвращения реакции (1.39) в аммиачный раствор добавляют карбонат аммония. В этом случае сульфат кальция переходит в карбонат кальция.
Огарки выщелачивают 8 - 10%-ным раствором аммиака в стальных реакторах на холоду или при нагревании до 50 - 70 °С при отношении Т:Ж=1:(3+4). Расход аммиака равен 120 - 140 % от стехиометрического. В конечных растворах избыточная концентрация аммиака должна быть 25 - 30 г/л для предотвращения образования малорастворимых полимолиб - датов.
В зависимости от состава огарков извлечение молибдена в раствор составляет 80 - 95 %, выход хвостов (масса хвостов по отношению к массе исходного огарка) колеблется от 10 до 25 %, а содержание молибдена в них - от 5 до 25 %. Из хвостов молибден извлекается в особой побочной ветви технологической схемы.
Очистка растворов от примесей меди и железа. Аммиачные растворы содержат 120 54 - 140 г/л Мо03 и примеси ионов меди, железа, иногда цинка и никеля, ионы щелочных металлов. Для очистки от ионов меди и железа применяют осаждение их сульфидов сернистым аммонием.
Произведение растворимости CuS равно 8,5-10_4S (растворимость сульфида 9,1 • 10_23моль/л). Несмотря на то, что ионы меди находятся в составе прочного аммиачного комплекса, в растворе имеется некоторая концентрация ионов Си2+. Связывание последних в малорастворимый сульфид приводит к смещению равновесия диссоциации комплекса и полному осаждению меди по суммарной реакции:
[Cu(NH3)J2+ + NH4HS + 20НҐ = CuS + 4NH3 +
+ NH4OH + H20 . (1.40)
Железо также полно осаждается в виде сульфида. Его аммиачный комплекс непрочный, а произведение растворимости FeS малое (3,7-Ю-19). По-иному обстоят дела с примесями цинка и никеля.
Следует учитывать, что в растворе низкая концентрация ионов S2-, так как добавляемый сернистый аммоний образует оксисульфомолибдат (NH4)2Mo04_xSx. Произведения растворимости ZnS и NiS достаточно малы (6,9-Ю-26 и 7,9-Ю"26 соответственно). Однако вследствие прочности аммиачных комплексов концентрация свободных ионов цинка и никеля столь низкая, что не достигается значение произведений растворимости их сульфидов (с учетом того, что в растворе малая концентрация ионов S2-). Вследствие этого примеси ионов никеля и цинка остаются в растворе.
Количество добавляемого сернистого аммония для осаждения сульфидов меди и железа строго дозируют. Осаждение ведут на холоду в гуммированных реакторах с мешалками.
Выделение молибдена из аммиачных растворов
Способ выпарки. Если после осаждения сульфидов содержание примесей щелочных металлов, никеля и цинка незначительное, из растворов можно выделить методом выпарки и кристаллизации чистый парамолибдат аммония (ПМА):
7(NH4)2MoO„ + 4Н20 = (NH4)6MO7024 ■ 4H20 + 8NH3 . (1.41)
Аммиачные растворы, содержащие 120 - 140 г/л МоОэ, выпаривают в аппаратах из нержавеющей стали с паровой рубашкой или с естественной циркуляцией в греющих трубках. Выпарку ведут до концентрации МоОэ примерно 400 г/л, после чего горячий раствор фильтруют и собирают в кристаллизаторе из нержавеющей стали с мешалкой и системой охлаждения. Вследствие различий в растворимости ПМА при 90 °С (~500 г/л) и 20 °С (~300 г/л) после охлаждения из раствора выделяется в кристаллы до 50 - 60% молибдена. Маточный раствор после отделения кристаллов на центрифуге дополнительно выпаривают и кристаллизуют ПМА. Хвостовой маточный раствор, в котором концентрируются примеси, выпаривают досуха, прокаливают остаток при 450 - 500 °С и загрязненный триоксид возвращают на операцию выщелачивания.
Способ нейтрализации. Способ выпарки не обеспечивает требуемую чистоту ПМА в случае существенного содержания в аммиачных растворах примесей щелочных металлов, цинка и никеля. В связи с этим на заводах СССР получил распространение способ промежуточного выделения полимолибдата (тетрамолибдата) аммония нейтрализацией аммиачного раствора. Осаждение ведут из аммиачных растворов с концентрацией МоОэ 280 - 300 г/л (если необходимо, растворы предварительно концентрируют выпариванием).
При осторожной нейтрализации раствора, нагретого до 55 - 65 °С соляной кислотой (до рН=2*3), и интенсивном перемешивании в осадок выделяется 96 - 97 % молибдена в форме двухводного тетрамолибдата:
4(NH4)2MO04 + 5Н20 = (NH4)2M04O13-2H2O* + 6NH4OH . (1.42)
Выпавший кристаллический осадок необходимо быстро отфильтровать, так как при контакте с раствором двухводная ме - тастабильная соль теряет воду, образуя дисперсный осадок.
В кислом маточном растворе остаются примеси ионов щелочных металлов, тяжелых металлов, соединения мышьяка, фосфора, серы. Поэтому осадки тетрамолибдата аммония имеют высокую степень чистоты, но они содержат 0,2 - 0,4 % ионов хлора, трудно отмываемых водой.
Для отделения ионов хлора проводят перекристаллизацию осадка тетрамолибдата. Соль растворяют в 3 - 5 %-ном растворе аммиака при 70 - 80 °С до насыщения (плотность раствора 1,41 - 1,42 г/см3). После охлаждения до 15 - 20 °С из раствора выделяется 50 - 60% молибдена в форме кристаллического ПМА (NH4)6Mo7024 • 4Н20. Маточный раствор служит для последовательной перекристаллизации примерно 10 партий осадков тетрамолибдата, после чего направляется на очистку.
Сочетание выделения тетрамолибдата аммония способом нейтрализации с последующей перекристаллизацией осадков через аммиачные растворы позволяет получить ПМА более высокой чистоты, чем это достигается способом выпарки. Содержание примесей в ПМА характеризуется следующими показателями по отношению к молибдену, %: Sn, Pb, Bi, Cd <0,0001; Zn, Mg, As, P, S, Ni, Cr, Ca -<0,001; Si, Al <0,003; Fe < 0,005 .
В кислом маточном растворе после отделения кристаллов тетрамолибдата аммония остается 3-4 % молибдена от исходного количества (что отвечает концентрации молк^ :ена 6-10 г/л). После подкислении до рН = 2 и длительного стояния из них выделяются аморфные осадки полимолибдатов различного состава, возвращаемые на операции очистки от примесей. Из хвостовых маточных растворов, содержащих ~1 г/л Мо, последний извлекают сорбцией на антпнообменных смолах.
Извлечение молибдена из хвостов аммиачного выщелачивания огарков
Хвосты выщелачивания в зависимости от состава огарков содержат 5 - 25 % молибдена в форме молибдатов кальция и
Железа, диоксида молибдена, неокислившегося молибденита,
2-
А также сорбированных анионов Мо04 . Другие компоненты хвостов: оксиды и гидроксиды железа, кремнезем, иногда шеелит или вольфрамит. Для извлечения молибдена из хвостов применяют щелочные способы (спекание с содой, выщелачивание растворами соды в автоклавах) или разложение соляной кислотой.
В случае значительного содержания в хвостах Мо02 и
MoS2 целесообразно использовать спекание с содой. Влажные хвосты смешивают с содой, полученную пастообразную массу нагревают на поду отражательной печи при 700 - 750 °С в течение 4 - 6 ч. Спек выщелачивают водой, получая растворы молибдата натрия.
Если молибден находится в хвостах в форме молибдатов, а содержание Мо02 и MoS2 низкое, вместо спекания может быть применено непосредственное выщелачивание растворами соды в автоклавах при 180 - 200 °С. Перевод раствора молибдата натрия в раствор молибдата аммония наиболее просто можно осуществить методом ионного обмена. Молибден сорбируют на слабоосновной смоле (АН-1, ЭДЭ-10П и др.) при pH=2-f4. Со смолы молибден затем десорбируется растворами аммиака, и полученный аммиачный элюат присоединяется к основным растворам аммиачного выщелачивания огарков.
Термическое разложение парамолибдата аммония
В производственной практике триоксид молибдена получают термическим разложением ПМА при 450 - 500 °С в барабанных печах непрерывного действия. ПМА теряет четыре молекулы воды при 90 - 110 °С, а продуктом, предшествующим образованию МоОэ, является безводный тетрамолибдат. Следовательно, разложение протекает по схеме:
О о
90-100 С 200 с
(NH4)6Mo7024 * 4HjO KNH4)6Mo7024 KNH4)2Mo4
О
280-380 С
013 *-Мо03 . (1.43)
В результате термического разложения получают порошок триоксида молибдена бледно-зеленого цвета.
Общее извлечение молибдена из концентрата в готовый продукт при переработке огарка по гидрометаллургической схеме (рис.9) составляет 94 - 95 %.
Азотнокислый способ переработки молибденитового концентрата
Азотная кислота концентрацией выше 25 % при нагревании окисляет молибденит с образованием молибденовой кислоты, что используют иногда вместо окислительного обжига. Молибденит взаимодействует с азотной кислотой по реакции:
MoS2 + 6HNO3 = Н2МоО„ + 2H2S04 + 6NO. (1.44)
Некоторая часть молибдена остается в кислом маточном растворе, вероятно, в составе сульфатокомплекса [Mo02(S04)n]2n-2_. Весь содержащийся в концентрате рений переходит в раствор в виде рениевой кислоты. С увеличением концентрации азотной кислоты и температуры скорость окисления молибденита возрастает, причем оба фактора способствуют коагуляции молибденовой кислоты. После разложения 30 - 35 %-ной кислотой при 90 % кислые маточные растворы содержат 12 - 14 г/л Мо, тогда как после разложения 54 %-ной кислотой - 2,5 - 3 г/л Мо. Реальный расход кислоты зависит от осуществления разложения. При проведении процесса в замкнутой системе, включающей регенерацию азотной кислоты из оксидов азота, общий ее расход существенно понижается. Регенерация основана на известном методе получения азотной кислоты, включающем: окисление "NO кислородом
2NO + 02 = 2N02 ; (1.45)
Абсорбцию N02 в воде
2N02 + Н20 = HNOj + HNO3 ; (1.46)
Диспропорционирование HN02
HN02 = V3HNO3 + V3NO + V3H20 . (1.47)
Результирующая реакция абсорбации N02
3NO, + Н20 = 2HN03 + NO. (1.48)
Таким образом, используя циркуляцию газов с одновременным введением в систему кислорода, можно проводить процесс при расходе кислоты ниже стехиометрического количества.
На одном из отечественных предприятий разложение ведут в непрерывном режиме. Пульпа, состоящая из смеси концентрата и 30 - 35 %-ной азотной кислоты, проходит последовательно через батарею цилиндрических аппаратов из нержавеющей стали. В каждый аппарат подают острый пар и воздух. Циркуляция пульпы внутри аппаратов обеспечивает участие кислорода в регенерации части азотной кислоты. Процесс проводят при 90 - 110 °С.
• Примерно 80 - 85 % молибдена находится в осадках в составе молибденовой кислоты. Отфильтрованные осадки выщелачивают аммиачной водой, растворы перерабатывают по обычной схеме.
Кислые маточные растворы содержат, г/л: Мо 10 - 15; Fe 5 - 10; Си 1,5 - 8; H2SO„ 200 - 250; HN03 ЗО - 50; Re 0,01 - 0,15.
Молибден и рений извлекают из маточных растворов, используя различные варианты жидкостной экстракции или ионного обмена. Для обезвреживания сбросных газов, содержащих NO и NOj, используют способ "сжигания" в пламени природного газа. При избытке газа оксиды восстанавливаются до элементарного азота:
4NO + СН4 = 2N2 + С02 + 2HjO ;
2N02 + CH4 = N2 + C02 + 2HjO.