ДИГИДРОАБИЕТИНОВЫЕ КИСЛОТЫ
Е. Иоганссон [132] в 1917 г. и X. Винхауз [159] в 1921 г. при гидрировании абиетиновой кислоты в спиртовом растворе с использованием платинового катализатора получили дигидроабие
Тиновую K«cao%. Проведя реакцию в тех же условиях, JI. Ружичка и {43] при гидрировании абиетиновой кислоты получили йірвдроабиетиновую кислоту СюНзгОз с темп. пл. 157—1594^|№4»8в'(в спирте). Позднее Л. Ружичка и С. Кауфман {14$], жЩя&ауя палладированиый углекислый кальций, получили смесь, продуктов гидрирования и среди них дигидро - абиетинойукГ кислоту с темп. пл. 166—168°С, {«]о+10,3° (в спирте).
Несколько раньше Р. Ломбар [138] при гидрировании абиетиновой кислоты под большим давлением с использованием палла дирован^ого угля в качестве катализатора получил дигидро - абиетииовую кислоту С20Н32О2 с темп. пл. 176° С, Она была идентична той днгидроабиетиновой кислоте, которую Получит Е, флек и С. Палкин {127] из диспропорционирован - ной 'канифоли,
В 1942—1944 гг. Р. Ломбар [138] продолжил исследование продуктов гидрирования абиетиновой кислоты. Он нашел, что при парциальном гидрировании в спиртовом растворе с использованием в качестве катализатора платины получается а-дигидроабиетиновая кислота с темп. пл. 166° С, [a]j^-26° (в спирте), а если гидрирование абиетиновой кислоты вести при большом давлении с использованием палладия, нанесенного на уголь, то получается р-днгидродбиетиновая кислота, темп. пл. 175°С, [а]3 +123° (в спирте). При воздействии спиртового раствора соляной кислоты a-дигидроабиетиновая кислота изомери - зуется в р-кислоту.
Последующие исследования Р. Ломбара и* Д. Збелена [138] показали, что a-дигидроабиетиновая кислота была смесью ди - гидрокислот. Авторы установили, что можно получить четыре дигидроабиетиновые кислоты:
А-д иг и Яро а б иет иио в у ю кислоту (LXXV) с темп. пл. 143—14Т С In},+ 43 9°; метиловый эфир ее имеет темп. пл. 84е и [Ah+35,5° С;
Э д и г и д р о а б и с т н н о п у ю кислоту (LXXVI) с темп пл 177°С и [A]J+127,6°,
В-д иг и д ро а б Иет ин ову ю кислоту (LXXVII) с темп. пл. 170° С н [аЬ-ЗЗ0;
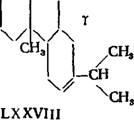
У-Д и Гидроабиетиновую кислоту (LXXV1I1) с темп, пл 155-15ГС, [«Ь+31,9°.
А и В-дигидроабиетиновые кислоты (LXXV) и (LXXVII) получены гидрированием абиетиновой кислоты с использованием в качестве катализатора палладия, нанесенного на уголь. А-днгидроабиетиновую кислоту выделили через соль с пиперидином, а В-дигидроабнетиновую — позднее через соль с бутанол - амином или С дй-н-амиламином.
А-дигидроабиетиновая кислота получена также при гидри- ровацри левопимаровой и неоабиетиновой кислот.
Р-и у-диї-идроабиетиновьіе кислоты (LXXVI) и (LXXVIII) получены при изомеризации соляной кислотой в кипящем спиртовом растворе А - и В - днгидроабиетнновых кислот (LXXV) и (LXXVII).
При этом из А-днгидроабиетнновой кислоты образовалась р-кнслота, а из В-кислоты образовалась у-кнслота.
Р-днгндроабнетнновая кислота не гидрируется н не окисляется, что указывает на то, что двойная связь ее находится у третичных углеродных атомов и, вероятнее всего, в положении 13, 14.
При лактонизацин А - и р-дигндроабиетнновых кислот количественно образуется лактон; В - и у-днгидроабнетнновые кислоты не образуют лактон.
|
Ноосх/сн8 |
Исходя из перечисленных соображений, Р. Ломбар и Д. Эбе - лен предложили следующие структуры дигндроабнетнновых кислот:
А -> СН8
|
/ С |
|
/ С |
|
/ -сн |
|
/ |
СНЯ
УСН8 —сн ХСн3
|
LXXV Ноосх/сн8 |
|
LXXVI НООСх/СН3 |
|
|
|
В Сня |
|
/ - СН |
|
Чсна |
LXXVII
В гидрированной канифоли можно ожидать присутствие А - и В-дигндроабиетнновых кислот, но удалось доказать присутствие только 'В-изомера, так как в изомернзованной гидрированной канифоли найден унзомер, а при обработке гидрированной канифоли серной кислотой получено 8% лактона [138].
Легче всего р-дигидроабиетиновая кислота (LXXVI) выделяется из диспропорционированной канифоли, содержащей де-
Гидро-, p-дигидро - и р-тетрагидроабиетиновые кислоты. Для разделения этих кислот применяют следующую методику. Сначала все кислоты превращают в аммониевые соли, при этом в виде нерастворимой в воде аммониевой соли удаляется из смеси тет- рагидроабиетиновая кислота.
Затем соли оставшихся смоляных кислот переводят в метиловые эфиры; в этом случае из смеси удаляется дегидроабие - тиновая кислота (LXXI) в виде кристаллического метилового эфира (LXXII). Некристаллизующийся маточный раствор содержит эфир дигидроабиетиновой кислоты. Чтобы получить fj-дигидроабиетиновую кислоту (LXXVI), эфир омыляют 10%- ным раствором едкого кали в н-бутиловом спирте, соли разлагают и кислоту кристаллизуют из этилового спирта. Полученная р-дигидроабиетиновая кислота имеет состав С20Н32О2 С темп. пл. 174—176° и [а]д + Ю8° (в спирте) [127].
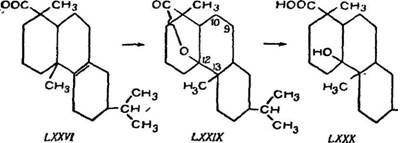
Образующийся при сульфировании лактон р-дигидроабиети- новой кислоты (LXXIX) с темп. пл. 130—131° С и [а]^ —3° при обработке щелочными растворами дает гидрокситетрагидроі Абиетиновую кислоту (LXXX) с темп. пл. 164—165° С, метиловый эфир которой имеет темп. пл. 50—51° С, темп. кип. 175—180° при 2 мм остаточного давления рт. ст. [а]^ +21° (в спирте).
Первоначально считали, что лактон образует цикл при 10 углеродном атоме, затем строение кислоты (LXXX) и лактона (LXXIX) определялось Е. Флеком и С. Палкиным [127].
|
|
|
,см ■Сн ЧСн |
Они считали, что существует три возможные точки лактонизацин р-дигидроабиетиновой кислоты (LXXVI) с образованием •циклов при 9 и 13-м углеродных атомах.
Чтобы сделать выбор между этими тремя возможностями, авторы предприняли окисление гидрокснтетрагидроабиети - новой кислоты (LXXX), полученной при гидролизе лактона. гТак как опыт окисления не привел к образованию кетона, что [неизбежно при лактонизацин при 10 и 9-м углеродных атомах, то авторы (оговариваясь, что они понимают слабость доказательства путем исключений) призвали логичность нахождения третичной гидроксильной группировки в гидрокситетрагидро - абиетиновой кислоте при 13-м углеродном атоме. Следовательно, точка лактонизации в лактоне также должна находиться при этом же атоме.
Образование такого лактоиа возможно только в том случае, если кольца А и С находятся в цис-положении. На примере дегидроабиетииовой кислоты показано, что они в действительности находятся в транс-положении.
Д. X. Р. Бартон [114] сделал заключение, что при образовании лактона может происходить перемещение угловой метальной группы в положение 13, а лактон будет выглядеть так, как показано формулой (LXXIX).