Электронный Парамагнитный резонанс в биологии
Исследования ксантиноксидазы
Мы уже говорили о том, что одной из главных групп ферментов является группа окислительных ферментов (оксидоредуктазы), включающая дегидрогеназы и оксидазы. В эти две подгруппы входит ряд очень важных и интересных ферментов, и не удивительно, что многие из них подробно изучались методом ЭПР. Особенно тщательно была изучена ксантиноксидаза молока. Краткий обзор результатов, полученных в этих исследованиях, даст представление о том, какого рода информацию можно получить, с помощью метода ЭПР.
В состав ксантиноксидазы входят флавин, ионы железа и молибдена. Поэтому были основания предполагать, что в процессе катализируемых ею реакций наряду с образованием свободных радикалов должны иметь место изменения валентности атомов, железа и молибдена и потому исследования методом ЭПР в этих случаях будут весьма эффективными. Ксантиноксидаза удобна для исследования методом ЭПР также и потому, что ее получают из молока, доступного в любых количествах.' Этот фермент можно получить в высокоочищенном состоянии и в очень больших количествах в течение всего нескольких дней. Кроме того, известно, что при определенных условиях хранения он не утрачивает активности в течение нескольких месяцев. Первые ЭПР-исследова - ния ксантиноксидазы молока были проведены Брэем с сотр. [8]. В 1959 г. им удалось показать, что при восстановлении наблюдаются два разных сигнала ЭПР. У одного из них значение g-фак- тора было очень близко к значению g-фактора свободного электрона, и поэтому этот сигнал был отнесен к флавиновому радикалу; значение g-фактора второго сигнала было равно 1,97 и было приписано пятивалентному атому молибдена Мо5+ [далее обозначаемому Mo(V)].
Дальнейшие исследования [9, 10] показали, что на самом деле спектр ЭПР ксантиноксидазы состоит из четырех ЭПР-сигналов — двух уже описанных, относящихся к флавину и Mo(V), и двух других с значениями g-фактора 4,2 и 1,9. Оба эти сигнала были отнесены к атомам железа — первый к его окисленной форме, а второй к восстановленной. Но затем обнаружилось, что поведение первого сигнала не согласовывалось с кинетикой других
компонент, и потому было предположено, что он обусловлен примесным железом; это кажется вполне вероятным, поскольку в биологических образцах очень часто присутствует в виде примеси трехвалентный ион железа. В дальнейшем Брэй совместно с Байнертом и Пальме - ром [11, 12] изучили кинетику второго сигнала (g — 1,9) значительно более подробно. Они применяли технику быстрого замораживания, что позволяло проследить кинетику сигналов ЭПР с временными интервалами порядка миллисекунд. В этих исследованиях были обнаружены по меньшей мере четыре различных сигнала, время возникновения и исчезновения которых исчислялось миллисекундами; это дало основание предполагать, что они связаны с самим ходом ферментативной реакции.
|
1003 |
|
Б(*2}_ |
|
А<*2) |
|
2,00 1,97 1,95 Значениед |
|
Фиг. 81. Спектры ЭПР ксантиноксидазы [12]. .4 — до начала реакции; Б—Д — через последовательные промежутки времени по мере протекания реакции с ксантином. Ср. с кривыми, приведенными на фиг. 36, которые показывают изменение каждой компоненты спектра во времени. |
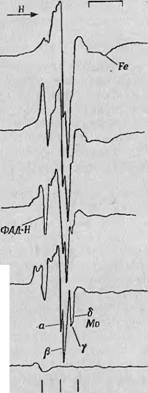
Типичная картина кинетики этих четырех сигналов уже была показана на фиг. 36 в качестве иллюстрации к методу быстрого замораживания. Можно видеть, что сигнал свободных радикалов флавина (кривая I) растет очень быстро в течение первых 20 мс, после чего проходит резкий максимум и затем падает в течение нескольких сотен миллисекунд. Из двух компонент сигнала Mo(V) одна достигает точки перегиба менее чем через 20 мс (кривая III) а другая — только через 50 мс (кривая II). Сигнал железа (кривая IV) Также растет гораздо медленнее и достигает максимума через 100 мс. Эти сигналы, записанные в виде первой производной, показаны на фиг. 81. На спектре А, полученном до начала реакции ксантиноксидазы с ксантином, можно различить лишь слабое
поглощение в области G = 2,00, соответствующей свободному электрону. Спектры Б — Д получены спустя разное время после начала реакции (Б — через 26 мс и Д — через 1400 мс). Сложные спектры Б и В представляют собой совокупность всех четырех сигналов. По прошествии 1400 мс некоторые сигналы почти полностью исчезают и сохраняется лишь сигнал, обусловленный железом.
В области значений g-фактора 1,95—1,97 спектр имеет сложную структуру, изменяющуюся в ходе восстановления фермента. Из этой сложной структуры можно вычленить по меньшей мере два сигнала, состоящие каждый, из двух компонент и обладающие разной кинетикой. На фиг. 81 одна пара компонент обозначена - а. и Р, другая — у и б. Было показано, что можно получить спектры, содержащие либо только ос - и f$-, либо только у - и б-компоненты. Первые наблюдаются в тех случаях, когда реакция протекает при рН 6,0, вторые — при рН 9,6. Тщательный анализ структуры этих разделенных сигналов показал, что оба они обусловлены различными химическими разновидностями ионов Mo(V). Этот вывод основан на том, что в обоих случаях хорошо разрешается их сверхтонкая структура, обусловленная взаимодействием неспаренных электронов с ядром молибдена, особенно в случае у - и 6-сиг - аалов [12]. В табл. 3 указывалось, что 75% общего числа изотопов молибдена обладают ядерным спином, равным нулю. Поэтому их спектр ЭПР представляет собой одиночную нерасщепленную линию. Но помимо этого изотопа, имеется еще 25% Мо9Б и Мо97, ядерный спин которых равен Б/2 и которые, следовательно, должны давать спектр, состоящий из шеста сверхтонких линий.
Для подкрепления этой интерпретации Брэй и Меривезер [13] в последующих работах получили препарат ксантиноксидазы ■с повышенной концентрацией изотопа Мо9Ь. Увеличение доли итого изотопа должно было привести к возрастанию интенсивности сигнала со сверхтонкой структурой из шести линий и, следовательно, либо подтвердить, либо отвергнуть предположение, что эти сигналы обусловлены молибденом. Сначала пробовали искусственно ввести в фермент обогащенный этим изотопом молибден, используя методы химического обмена, но эти эксперименты окончились неудачей. Поэтому были предприняты попытки получить меченый фермент посредством прямого биологического синтеза. В этих экспериментах Мо95 вводили животному и затем спустя некоторое время выделяли из молока этого животного фермент с включенным в него изотопом. Для определения степени включения изотопа в ксантиноксидазу к вводимому раствору добавляли небольшое количество радиоактивного Мо90. Было найдено, что если корове весом 546 кг однократно ввести 184 мг натриевой соли Мо"6 и 310 мкКи Мо99, то в течение 72 ч после инъекции получается молоко с высокой радиоактивностью, из которого можно выделять ксантиноксидазу. Измерения радиоактивности показали, что в фермент включается 68% введенного изотопа, так чтс в конечном счете около 75% общего числа изотопных атомов молибдена в полученном препарате ксантиноксидазы обладают ядерным спином.
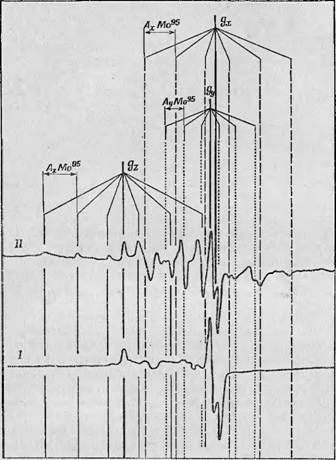
Далее на этих препаратах с повышенным содержанием Мо95 были повторены эксперименты по разделению сигналов а, Р и у, б. Сначала методом быстрого замораживания растворов при рН 10 были получены сигналы у и б, которые наблюдались спустя очень короткое время (порядка 10 мс) после начала реакции На фиг. 82 показан сигнал ЭГ1Р от обогащенного Мо95 фермента (кривая II) и для сравнения — спектр обычного фермента (кривая I). Хорошо видно, что после обогащения фермента Мо95 компоненты у и б приобретают отчетливую хорошо разрешенную сверхтонкую структуру из шести линий. Можно отметить значи тельную анизотропию g-фактора; значение Gz равно 2,025, a Gx и Gv Равны соответственно 1,951 и 1,956. Хорошо видно, что сверхтонкая структура из шести лиши расположена симметрично относительно положения по полю Gz и что возрастание интенсивности сверхтонких компонент сопровождается ослаблением центральной линии. Эти результаты не только окончательно подтверждают, что сигналы у и б обусловлены ионом молибдена, но на их основе, исходя из наблюдаемых значений G фактора, можно предположить, что Мо(У) входит в состав кубической структуры со слабым ромбическим искажением. Кроме того, кажется вполне вероятным, что среди лигандов имеется один или несколько атомов серы, возможно принадлежащих цистеиновому остатку в белке.
Таким я<е образом исследовались сигналы а и Р, и также удалось показать, что они связаны с ионами молибдена; кроме того, результаты этих экспериментов позволили предположительно определить природу лигандов Мо95. Описанная работа иллюстрирует, каким образом можно использовать анализ сверхтонкой структуры в ферментативных исследованиях, даже если образцы находятся в жидком или, как в данном случае, в замороженном состоянии. Очень интересна примененная авторами техника биологического обогащения фермента изотопами, обладающими ядер нымз сиинамз.
На фиг. 83 схематически изображен механизм ксантинокси дазной реакции, построенный яа основе ЭПР-исследований. Вертикальные колонки представляют различные окислительно-восстановительные системы, а горизонтальные прямоугольников каждом из них соответствуют различным уровням окисления (полностью окисленное состояние каждой системы изображено наверху) Стрелками с соответствующим обозначением показано присоедк нение или отщепление электронов или протонов, а стрелками без обозначений — случаи, когда переноса электронов как такового нет, но происходит превращение в пределах одного и того же окис- лительно-восстановительного состояния Все промежуточные продукты, обнаруживаемые методом ЭПР, заключены в жирную
|
Фиг. 82. Спектры ЭПР ксантпноксндазы, обогащенной Мо!'5 [13]. На спектрах'; пр'едставден у б-мошбденовый сигнал, наблюдаемый в ^рбласти, высоких рН 1 —: сцектр орьмноЁ^к^антгаоксндазы; II - спектр !;кса1Щ5гноксидазь'ь обогащенной »1о8г'. Xopomrf'EiffiBoJyBeniraeHHe интенсивности сверхтопких лпшш, 'овд'СлБвленных Mo? v |
Рамку; моясно видеть, что метод ЭПР позволяет контролировать значительную часть стадий|этого ферментативного процесса.
Механизм действия ьц'с'антыноксидазы еще не выяснен окончательно, но приведенные результаты наглядно показывают пгиро-
компонентов ферментной системы, но и дает возможность на основании картины сверхтонкого расщепления точно идентифицировать эти компоненты.