Добавки в бетон Справочное пособие
ПРОДУКТЫ ГИДРАТАЦИИ
1.4.1. Трехкальциевый силикат. Понимание поведения при гидратации индивидуальных составляющих цемента и их смесей — основа для интерпретации сложных реакций, протекающих при гидратации цемента в различных условиях.
Трехкальциевый и двух - кальциевый силикаты составляют 75—80 % цемента (см. табл. 1.1). В присутствии ограниченных количеств воды реакция между C3S и водой может быть представлена следующим образом:
3Ca0.Si02 + xH20-H/Ca0-Si02. •(*+!/-3) Н20 + + (3-0) Са(ОН)2
Нли более конкретно:
2(3Ca0-Si02) + 7H20-+3Ca0.2Si02- •4Н20 + ЗСа(0Н)2.
Приведенные выше уравнения реакции приблизительны, поскольку нелегко определить состав C-S-H (отношения C/S и S/H); кроме того, имеются проблемы, связанные с определением Са(ОН)г. В полностью гидратированном цементе или C3S 60—70 % твердой фазы состоит из C-S-H. Он плохо закристаллизован, содержит частицы коллоидных размеров, показывает два размытых небольших пика на рентгенограмме. Степень гидратации C3S может быть измерена определением C3S или Са(ОН)г рентгеновским методом, неиспаряемой влаги прокаливанием или Са(ОН)г термическим или химическим методами. Каждый из этих методов
9
|
Са(он)2,%
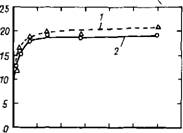
10 20 30 т 50 t, сут Рис. 1.1. Зависимость содержания гид - рокснда кальция, образующегося при гидратации C. sS, от времени гидратации 1—химический метод; 2—термический метод |
Имеет свои ограничения. Количество Са(ОН)2, определенное рентгеновским и химическим методами, неодинаково. К примеру, в работе[2] найдено 22 % Са(ОН)г в камне из портландцемента рентгеновским методом, а химическим методом (экстракция) Са (ОН)2 определяется на 3—4 % больше. Эту разницу можно отнести за счет аморфного Са(ОН)2- С другой стороны, в работе [3] сообщается, что метод экстракции дает Са (ОН) г на 30—90 % больше, чем рентгеновский метод. Термогравиметрический метод анализа приводит к тем же величинам, что и рентгеновский. В последнее время дифференциально-термический анализ был применен в работах [4, 5] для определения Са(ОН)2 в гидра - тированном C3S.
На рис. 1.1 сравниваются относительные количества Са(ОН)2, образовавшегося в разные периоды гидратации, определенного при применении химического метода и диффе - ю ренциально-термического анализа (ДТА). Хотя общая тенденция аналогична, результирующая величина выше при применении химического метода. Это может быть объяснено воздействием на фазу C-S-H растворителей, используемых при химической экстракции. Отсюда ясно, что определение состава C-S-H, которое основано на определении C3S и Са(ОН)г, имеет ограничения. Состав фазы C-S-H может быть изменен с помощью добавок. Прямой метод определения отношения C/S основан на таких методах, как электронная микроскопия или электронная спектроскопия. Несмотря на то что имеется несколько различающихся величин, в основном отношение C/S после небольшой продолжительности гидратации находится в пределах 1,4—1,6 [6]. Имеются проблемы, связанные с определением воды, химически связанной в C-S-H. Встречаются затруднения при дифференциации ее от поровой воды. Стехиометрию C-S-H определяют в предположении, что в пробе либо вовсе не остается, либо остается очень мало адсорбированной влаги в условиях d-сушки (давление паров воды при температуре сублимации твердого СОг, т. е. при —78° С). В недавних исследованиях было показано, что высшие гидраты могут существовать и при влажности, близкой к d-сухим условиям [7].
Считается, что высушивание до относительной влажности (ОВ) 11 % является надежным способом для изучения стехиометрии гидратов силиката кальция. В этих условиях может быть с достаточной надежностью оценена адсорбированная вода. Не следует полагать, что высшие гидраты не существуют при ОВ выше 11 %. Согласно работе [8] C3S, гидрати - рованный в колбе до C-S-H и доведенный до равновесия при 11 % ОВ (начиная со 100 % ОВ), имеет состав 3,28СаО - • 2Si02-3,92H20.
1.4.2. Двухкальциевый силикат. При гидратации C2S, как и C3S, имеются неопределенности, связанные с нахождением стехиометрического состава фазы C-S-H; гидратация двух - кальциевого силиката может быть представлена следующим уравнением:
2(2Ca0-Si02)-f5H20-^3Ca0-2Si02- •4Н20 + Са(0Н)2.
Количество Са(ОН)2, образующегося в результате такой реакции, меньше, чем при гидратации C3S. Фаза двухкаль - циевого силиката гидратирует - ся намного медленнее, чем фаза трехкальциевого силиката.
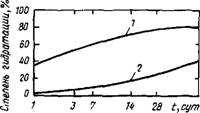
На рис. 1.2 сравниваются между собой скорости гидратации C3S и C2S. Абсолютные значения скоростей неодинаковы в разных пробах; это индивидуальная характеристика, однако в среднем скорость реакции у C3S намного выше.
Повышенную реакционную способность C3S объясняют следующими причинами: в C3S координационное число Са2+ выше 6; координация Са2+ нерегулярна; в кристаллической решетке C3S имеются пустоты;
|
Рис. 1.2. Кинетика изменения относительной степени гидратации СзS (1) н C2S (2) |
Наблюдаются различия, встречающиеся в позициях на Ферми-уровнях. Проведены некоторые предварительные работы для определения относительной реакционной способности Са2+ в CaO, Са(ОН)2, C3S и при смешивании каждого из них с известными количествами AgN03 [9]. Найдено, что при последующем нагревании реакция AgN03 с СаО, Са (ОН)2 и гид - ратированным C3S стехиомет - рична относительно Са2+. Только 27 % Са2+, присутствующего в C3S, и 6 % Са + из C2S реагируют с AgN03. Возможно, что активности C3S и C2S являются таковыми вследствие дефектов в их структуре. Имеются данные о том, что при гидратации C3S, полученного присоединением одной молекулы меченого Са к C2S, начальные продукты реакции содержат в основном меченый ион Са2+. Необходимы дальнейшие работы, прежде чем будут сделаны окончательные выводы.
1.4.3. Трехкальциевый алюминат. Несмотря на то что среднее содержание С3А в портландцементе составляет 4—11 %, его влияние весьма заметно на начальной стадии гидратации. Он обычно ответствен за феномен «ложного» схватывания; образование различных гидратов алюминатов кальция, кар - бо - и сульфоалюминатов также имеет место при реакциях СзА. Большие количества СзА в портландцементе могут повлиять на долговечность бетона. К примеру, цемент для бетона, который будет выдерживаться в сульфатных растворах, не может содержать более 5 % СзА.
Трехкальциевый алюминат реагирует с водой, образуя СгАНв и С4АН13 (гексагональные фазы). Эти продукты термодинамически нестабильны, поэтому без стабилизации или добавок они переходят в фазу СзАНб (кубическая фаза).
Ниже приведены соответствующие уравнения-
2С3А + 21 H->-C4AH і З + С2АНв;
С4АН, з + С2АН8-+2СзАНб + 9Н.
В насыщенном растворе Са(ОН)2 С2АНв реагирует с Са(ОН)2, образуя в зависимости от условий С4АН13 или СзАНб - Кубическая форма (СзАН6) может образоваться и в результате непосредственной гидратации С3А при 80 °С или более высокой температуре [10, 11]:
С3А + 6Н-^С3АН6.
При нормальных условиях гидратации камень из СзА дает меньшую прочность, чем из силикатных фаз, вследствие образования кубической фазы СзАНе.
При определенных условиях гидратации, т. е. при низких водотвердых отношениях (В/Т) и высокой температуре, прямое образование С3АНб (приводящее к возникновению непосредственных связей между частицами) может существенно повысить прочность. В портландцементе гидратация фазы С3А контролируется добавлением гипса. Таким образом снимается «ложное» схватывание.
Фаза СзА реагирует с гипсом в течение нескольких минут, образуя эттрингит,
C3A + 3CSH2 + 26H-^ -^C3A-3CSH32.
После того как весь гипс перейдет в эттрингит, избыток С3А вступает в реакцию с эт - трингитом, образуя низкосульфатную форму гидросульфо - алюмината кальция,
С3А • ЗС SH32 + 2_С3А + 4H-v -^3(C3A. CSHi2).
Гипс — более эффективный замедлитель гидратации С3А, чем известь; вместе они еще более эффективны, чем каждый в отдельности.
1.4.4. Ферритная фаза, составляющая в среднем 8—13 % состава портландцемента, имеет различный состав, выраженный как C2(AnFi-„), где 0<гс< <0,7. Среди цементных минералов ее гидратационные и фи - зико-механичеекие характеристики привлекают значительно меньшее внимание. Это частично может быть объяснено тем, что ферритная фаза и СзА ведут себя сходным образом. Однако очевидно, что имеются и значительные различия между ними.
Известно, что фаза C4AF дает в целом те же продукты гидратации, что и СзА, но при более медленном протекании реакции. В присутствии воды C4AF реагирует следующим образом:
C4AF+ 16Н-^2С2(А, F)H8; C4AF+16H-^C4(A, F) Н13+ (A, F)H3.
При реакциях C4AF образуются аморфные продукты. Термодинамически стабильная фаза С3(А, F)H6 —это продукт превращения гексагонального гидрата. Иногда образование этого гидрата вызывает ложное схватывание цемента.
Гидратация C4AF при низком В/Т и высокой температуре может увеличить степень прямого образования кубической фазы [12]. Результаты измерений микротвердости показывают, что при В/Т = 0,13 пробы, гидратированные при 23 и 80 °С, имеют микротвердость до 874 и 1770 МПа соответственно. Большая прочность при более высокой температуре может быть объяснена прямым образованием из C4AF кубического СзАНб. Это приводит к их более тесному соединению с ростом механической прочности.
В цементе в присутствии гипса C4AF реагирует значительно медленнее, чем СзА. Другими словами, гипс более эффективно замедляет гидратацию C4AF, чем С3А.
Скорость гидратации зависит от состава ферритной фазы; с ростом содержания железа снижается скорость гидратации. Реакция C4AF с гипсом протекает следующим образом [13]:
3C4AF+ 12CSH2_+110Н-+ ->-4[Сб (A, F)S3H32] + + 2(А, F)H3.
Низкосульфатная форма гидросульфоалюмината кальция может образоваться при реакции избытка C4AF с высокосульфатной формой
3C4AF + 2[C6(A, F)S3H32b
->-6[С4(А, F)SH12] + 2(A, F)H3.
При низком В/Ти высокой температуре низкосульфатная форма гидросульфоалюмината кальция может образоваться непосредственно.
Вышеприведенное уравнение включает образование гид - роксидов А1 и Fe вследствие недостатка извести в C4AF. В этих продуктах F может быть заменено А. Соотношение между А и F может быть не таким, как в исходном материале.
1.4.5. Портландцемент. Хотя изучение гидратации чистых цементных составляющих само по себе полезно для прослеживания гидратационных процессов в портландцементе, оно не может быть непосредственно применено к цементам вследствие сложности протекающих реакций. В портландцементе минералы состоят не из чистых фаз: они яйляются твердыми растворами, содержащими А1, Mg, Na и т. д. Изучение гидратации алита, содержащего различные количества Al, Mg или Fe, показало, что при той 'же степени гидратации Fe алит достигает большей прочности. Очевидно, что C-S-H, образующийся из различных видов алита, неодинаков [15]. На гидратацию СзА, C4AF и C2S в цементе влияет изменение количества Са2+ или ОН- в гидрат - ном растворе. Реакционная способность C4AF может зависеть от количества SOf~ - ионов, потребляемых СзА. Концентрация SO2- - ионов может быть понижена их адсорбцией на фазе C-S-H. Известно также, что гипс воздействует на скорость гидратации силикатов кальция. Значительные количества А1 и Fe связаны в структуре C-S-H. На гидратацию индивидуальных фаз оказывает влияние также присутствие щелочей в портландцементе. По их влиянию на скорость гидратации портландцемента в ранние сроки твердения (несколько дней) минералы цемента можно расположить в следующем порядке: С3А> C3S> C4AF> C2S.
Скорость гидратации составляющих портландцемента зависит от размеров кристаллов, их дефектности, размеров частиц и их распределения по размерам, скорости охлаждения клинкера, площади поверхности, наличия добавок, температуры и т. д.
В гидратированном портландцементе образуются такие продукты гидратации, как гель C-S-H, Са(ОН)2, эттрингит (А, F-3-фазы), моносульфатная (A, F-1 - фаза), гидрогранаты и, возможно, аморфные фазы с высоким содержанием ионов (А13+ и SO?-) [6].
Фаза C-S-H представлена в цементном камне аморфными или полукристаллическими гидратами силикатов кальция (де - 14 фис означает, что в геле молекулярное соотношение СаО: Si02 не обязательно равно 1:1). Строение порошка C-S-H из цементного камня сходно с таковым в камне из C3S. Состав C-S-H (в смысле отношения C/S) меняется в зависимости от времени гидратации. Через 1 сут. отношение C/S близко к 2, приходя к 1,4—1,6 после нескольких лет гидратации. C-S-H может захватывать значительные количества ионов Al3+, Fe3+ и SOI".
Последние исследования показали, что в камне ^как из C3S, так и в цементном, мономер, присутствующий в исходных C3S и C2S (тетраэдр SiOl""), полимеризуется во времени в димер и более крупные ионы. Газожидкостные хро - матографические анализы с получением триметилсилильных производных показали, что отсутствуют анионы с тремя и четырьмя атомами Si. По мере гидратации возрастает количество полимеров с пятью атомами Si и более и уменьшается количество димеров. В камне из C3S мономеры исчезают в результате образования полимеров. В цементном камне, даже после того как C3S и C2S прогидратировались, обнаруживается некоторое количество мономеров, возможно, вследствие модификации структуры аниона C-S-H путем замены некоторой части Si атомами А1, Fe или S [6]. Добавки могут воздействовать на скорость процесса полимеризации при гидратации партландцемен - та и C3S.
В полностью гидратирован - ном портландцементе Са(ОН)г составляет около 20— 25 % твердого вещества. Кристаллы плоские или призматические, легко раскалываются. Они могут плотно срастаться с C-S-H. Плотность Са(ОН)г равна 2240 кг/м3. Кристаллический Са(ОН)г дает четкие пики на рентгенограмме: наблюдаются эндотермический пик и потеря массы на термогравиметрической кривой. Морфология Са(ОН)г варьируется, кристаллы могут быть равновеликими, широкими, плоскими, длинными, тонкими, удлиненными; возможны также комбинации из них. Некоторые добавки и температура модифицируют морфологию кристаллов. Согласно данным некоторых исследователей, в камне из портландцемента могут образовываться и кристаллический, и аморфный Са(ОН)2.
Эттрингит в цементном камне, или AF-3 - фаза, имеет формулу СзА-ЗСБНзг, где часть А1 может быть в некоторой степени замещена Fe и поэтому обозначается Al-Fe-три (три обозначает число молекул CS). AF-3 - фаза образуется в первые часы гидратации (из С3А и C4AF), что влияет на сроки схватывания. Через несколько дней лишь небольшие количества этой фазы могут оставаться в цементном камне. Основными заместителями А13+ в AF-3 фазе являются Fe3+ и Si4+, а для SO|~ — различные анионы (такие, как ОН", СО§~ и силикат-ионы). Размер частиц этой фазы не превышает обычно нескольких мкм.
Моносульфатную форму, известную также как AF-1 или AF m - фазу, выражают формулой C4A-SHi2 или C3A-CSHi2, в которой присутствует одна молекула CS, обозначаемая как Al-Fe - моно.
В портландцементе она образуется после того, как исчезает AF-3. Эта фаза может составлять около 10 % твердого вещества в зрелом цементном камне. На снимках, выполненных с помощью сканирующего электронного микроскопа, видно, что для нее характерна гексагональная морфология, напоминающая кристаллы Са(ОН)г. Кристаллы фазы имеют субмикрометрическую толщину. Основными ионными заместителями А13+ в AF-.1 - фазе являются Fe3+, а для S04~ — ионы ОН~, СГ, СО§~ и др. Плотность этой фазы равна 2020 кг/м3.
Количество гидрогранатов в цементной фазе менее 3 %
[16] . Это соединения типа СзАЬ(ОН)і2, в которых часть А13+ замещена Fe3+, а часть анионов ОН - — ионами Si04_, т. е. C3(Ao,5Fo,5)SH4. Эта-фаза может присутствовать в цементном камне зрелого возраста; образуется также при высокой температуре. Кристаллическая структура родственна C3AS3 (гранаты). Плотность C6AFS2H8 равна 3042 кг/м3. Гидрогранаты разлагаются углекислым газом с образованием СаС03
[17] .
Некоторые исследователи считают, что низкосульфатные формы гидроалюминатов пред
ставляют собой гидроксисуль - фоалюминаты кальция. Кристаллические твердые растворы в системе СаО — А1203 — CaS04 — Н20 также образуются в цементном камне [18].
|
Таблица 1.2 НЕКОТОРЫЕ СОЕДИНЕНИЯ, ПРИСУТСТВУЮЩИЕ В ЦЕМЕНТЕ И ГИДРАТИРОВАН - НОМ ЦЕМЕНТЕ |
В табл. 1.2 дан перечень некоторых соединений, представляющих интерес для специалистов по цементу.
|
Формула |
|
Соединение |
|
Обозначение |
Примечание
Оксид кальция Периклаз
Гипс (дигидрат сульфата кальция)
Базанит (полугидрат сульфата кальция)
Арканит (сульфат калия)
Афтиотолит (натрий-калий-сульфат)
Калия-кальция сульфат Трехкальциевый силикат Алит
Ларнит ((3-двухкальцие - вый силикат)
Белит (замещенный двух - кальциевый силикат)
Трехкальциевый алюминат
СаО MgO
CaS04-2H20
CaS04-0,5H20
K2S04 (Na, K)2S04
(K2Ca) (S04)2
Ca3Si05
CasSiOs замещенный
|
С M CSH2 CSHo. e KS (NK)S (K2C)S2 C3S C3S P-C2s C2S СзА |
P-Ca2Si04 Ca2Si04 Ca3Al206
Присутствует в клинкере в небольших количествах Присутствует в клинкере. В избыточных количествах вызывает дефекты Измельчается вместе с цементным клинкером. Замедляет реакцию с СзА и предотвращает ложное схватывание
Может образоваться как продукт дегидратации из гипса во время измельчения гипсоклинкерной смеси. Вызывает ложное схватывание
Может присутствовать в некоторых клинкерах Может присутствовать во фракциях уноса и остатках обжиговых печей
Присутствует в летучих остатках
Синтезируемое соединение
Важнейшая составляющая в портландцементе. Содержит твердые растворы Fe, Al, Mg, Сг н Zn. При гидратации цемента образуется прочное тело Если не стабилизировать превращение в V-C2S, может превратиться в порошок
Присутствует в клинкере. Са замещается Mg, Na, К, Сг и Мп; Si04 может быть замещен Р04 и S04 Составляющая портланд- цементного клинкера. Гидратируется быстрее, чем C3S, C2S или C4AF
Продолжение табл. Ї.2
|
Формула |
|
Соединение |
|
Обозначение |
Примечание
Трехкальциевый (натриевый) алюминат
Алюмоферрит кальция; серия твердых растворов
Портландит или гидро - ксид кальция
Брусит (гидроксид магния)
Кальцит (карбонат кальция)
Гидрат силиката кальция, гель
Трехкальциевый алюминат гексагидрат Четырехкальциевый алюминат 19-водный
Двухкальциевый алюминат 8-водный
Эттрингит
Четырехкальциевый алюминат моносульфат 12- водный
NaCa4Al309
От Ca4Fe40io до Са4РеА1зО10
Са (ОН) 2
Mg(OH)2
СаСОз
ХСаО - Si02- уН20
Са3А12(ОН) 12 4Са0-А1203- 19Н20
2СаО • А120з • 8Н2О
Саб [а1 (он)6]2. •24h20-(s04)3- •2н20
Са2[А1(ОН)6]2- •S04-6H20
Nc8a3
Ca(Fi-_p)Ap
P = A/A+F (0<p< <0,7) CH
MH
CC
C-S-H
СзАНе C4AH|9
C2ah8
C6AS3H3
C4ash.
Присутствует в небольших количествах в некоторых цементах Фаза портландцемента. Состав от р = 0,33 до р = 0,67
Продукт гидратации цемента, C3S и C2S. Малые количества образуют.< при гидратации свободного СаО нз клинкера При автоклавировании гидратируется до Mg(OH)2. Для гидратации в нормально-влажных условиях требуются годы
Сырье для производства портландцемента. Эта соль появляется при карбонизации Са(ОН)2 и C-S-H
Присутствует в замещенных формах в гидратиро - ванном портландцементе. х и у варьируют в зависимости от условий гидратации
Устойчивый продукт гидратации СзА
Метастабильный продукт гидратации СзА, иногда находимый в цементе. Низкогидратный продукт С4АНі3. Его железистый аналог — C4FH|3 Гексагональный гидрат (метастабильный); образуется при гидратации СзА
Продукт реакции С3А с гипсом; образуется в раннем возрасте. Известны также железистые аналоги
Присутствует в гидрати- рованном цементе. Образует твердые растворы с С4АН]3. Известны железистые аналоги