АППАРАТЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
КРИСТАЛЛИЗАЦИЯ
Основные понятия. Во многих технологических процессах, связанных с обработкой твердых материалов в жидкой среде, приходится путем кристаллизации выделять в виде кристаллов растворенные в жидкости твердые вещества.
Кристаллизация представляет собой процесс выделения твердой фазы при затвердевании веществ, находящихся в жидком состоянии (из расплава), или процесс выделения твердого растворенного вещества из раствора. Кристаллизация является одним из важнейших способов получения твердых веществ в чистом виде.
Кристаллы представляют собой твердые химически однородные тела правильной формы. Строение кристаллов характеризуется симметричным расположением атомов, ионов и молекул в узлах пространственной решетки, которая образуется тремя взаимно пересекающимися системами плоскостей.
Кристаллы одного и того же вещества могут различаться по размерам и форме. В зависимости от условий образования кристаллов скорость роста их по отдельным граням может быть различной, вследствие чего кристаллы, сохраняя ту же самую кристаллическую решетку, принимают вытянутую или плоскую форму в зависимости от температуры и вязкости среды.
Каждая из форм кристаллов остается устойчивой лишь в определенном интервале значений температуры и давления. При достижении предельных условий происходит переход одной кристаллической формы в другую, сопровождающийся тепловым эффектом; границы этого перехода определяются так же, как и при изменении агрегатного состояния вещества. Кроме того, каждая из кристаллических форм обладает отличной, свойственной только ей упругостью паров и растворимостью.
В технологии многообразие форм кристаллов используют для получения одного и того же вещества в виде кристаллов определенной формы, обладающих различными свойствами, для чего создают соответствующие условия кристаллизации.
Так, в зависимости от температуры кристаллизации некоторые вещества могут быть получены различного цвета. Например, йодная ртуть в зависимости от температуры может быть выделена в виде осадка, окрашенного в желтый или в красный цвет. Изменяют также свой цвет при различной температуре кристаллизации хромовые соли свинца.
Форма и величина кристаллов оказывают существенное влияние на их дальнейшую обработку путем фильтрования, при котором оба эти фактора значительно влияют на скорость процесса. Известно, что чем крупнее кристаллы и отчетливее выражена их кристаллическая форма, тем эффективнее протекает процесс фильтрования.
Поэтому, например, процессы нейтрализации сернокислых растворов мелом необходимо проводить при определенной температуре (60—65°) и заданном соотношении реагирующих масс (равномерное и одновременное приливание водной суспензии мела и нейтрализуемой жидкости), что обусловливает образование крупнокристаллического осадка сернокислого кальция (гипса) определенной гидратной формы.
Известно также, что при синтезе органических полупродуктов и красителей антрахинонового ряда нередко от способа выделения кристаллов в значительной степени зависит успех всего производства. Так, например, быстрое осаждение антрахинона и его производных без нагревания приводит к образованию осадков, которые практически не фильтруются, а медленное осаждение в разведенной среде при кипячении раствора дает крупнокристаллические, сравнительно легко фильтруемые осадки.
Существенное влияние на кристаллизацию оказывает процесс гидратации, при котором выделяющиеся из раствора одна или несколько молекул растворенного вещества соединяются с одной или несколькими молекулами растворителя. При этом число присоединяющихся молекул растворителя может быть различным в зависимости от температуры и концентрации, при которых проводится кристаллизация.
Вследствие гидратации вещество из раствора выделяется в виде кристаллогидратов определенной формы, содержащих вполне определенное количество молекул растворителя (воды), причем содержание кристаллизационной воды в кристаллах сказывается не только на их форме, но и на свойствах. Так, например, безводный сульфат меди CuS04 является бесцветным соединением, кристаллизующимся в виде призматических иголок ромбической системы, а пятиводный гидрат сульфата меди CUS04-5H20 образует крупные синие кристаллы триклинической системы. При нагревании до 100° этот гидрат теряет 4 молекулы воды, а при 240° полностью теряет всю кристаллизационную воду, переходя в безводный сульфат.
Кристаллогидраты обладают определенной упругостью пара. Если упругость их пара больше упругости паров воды в окружающем воздухе при данной температуре, то кристаллы при хранении на воздухе теряют кристаллизационную воду—выветриваются. Примером такого кристаллогидрата может служить глауберова соль, представляющая собой десяти - водный сульфат натрия Na2S04- 10Н20.
Наоборот, если упругость пара над кристаллогидратом меньше упругости паров воды в окружающем воздухе, кристалл «притягивает» из окружающего воздуха воду и постепенно «плавится». Для этих кристаллов при хранении на воздухе содержание кристаллизационной воды должно быть таким, чтобы не нарушалась форма кристаллов. Типичным примером подобных кристаллогидратов является обыкновенная поваренная соль.
Равновесие фаз и растворимость. Все вещества, в том числе и твердые, обладают способностью в той или иной степени растворяться в различных жидких растворителях. Степень растворимости и концентрацию растворов чаще всего выражают в весовых процентах растворенного вещества по отношению к общему весу раствора или в граммах растворенного вещества на 100 г растворителя.
Растворимость веществ зависит от их химической природы, свойств растворителя и температуры. Данные о растворимости различных веществ находят опытным путем и обычно изображают в виде кривых зависимости растворения от температуры.
Растворимость многих веществ изображается плавной кривой, без излома, причем, как правило, с повышением температуры растворимость возрастает.
Для многих веществ, образующих кристаллогидраты, кривые растворимости имеют изломы; растворимость таких веществ может с повышением температуры уменьшаться.
Определение растворимости веществ при заданных температурах имеет большое практическое значение, но надежных расчетных формул нет, и в каждом конкретном случае приходится пользоваться опытными данными.
Для вычисления растворимости негидратируемых минеральных солей в воде при любой температуре может быть применено правило однозначности физико-химических функций, если известна растворимость соли при двух каких-нибудь температурах. Такие расчеты аналогичны определению температур кипения растворов при различных давлениях (см стр. 422), так как основой является общее правило, выражающее линейное изменение физико-химических величин для подобно протекающих процессов.
Применительно к растворимости это правило может быть сформулировано так: отношение разности температур (/—/'), соответствующих двум различным молярным растворимостям данного вещества, к разности температур ([t'—t') при тех же молярных раство - римостях стандартного вещества есть величина постоянная:
■fEgr (3-308)
Следовательно, для известного значения К молярная растворимость данного вещества при любой температуре T равна молярной растворимости стандартного вещества при температуре 6:
Ь = +6' (3—309)
Пусть требуется определить растворимость азотнокислого серебра AgNOg При 25е, если его растворимость при /=15° равна 10,75 г-мол на 1000 г воды и при T'=0° составляет 6,65 г-мол на 1000 г воды.
В качестве стандартного вещества выбираем негидратируемую соль—азотнокислый калий; растворимость 6,65 г-мол KN03 На 1000 г воды соответствует температуре 0'=41,5°, а растворимость 10,75 г-мол KN03 Соответствует температуре 6=59,7°.
Из уравнения (3—273) определяем значение константы
15 — 0
К = 59,7—41,5 ~ 0,825
Растворимость AgNO, При 25° будет равна растворимости стандартного вещества при температуре
■ 25—0
6= 0^25- + 41'5 = 71'8° И, по справочным данным, равна 14,27 г-мол на 1000 г воды.
Раствор, который содержит максимально возможное для данной температуры количество растворенного вещества, называют насыщен - н ы м. Понижение температуры насыщенного раствора ведет к выделению из него части растворенного вещества; при этом количество растворенного вещества, остающегося в растворе, будет соответствовать состоянию его насыщения при температуре, до которой охлажден раствор. Наоборот, повышение температуры раствора в большинстве случаев дает возможность увеличивать концентрацию до тех пор, пока раствор снова не станет насыщенным.
Зная зависимость растворимости вещества от температуры, можно проводить его кристаллизацию. Понижая температуру раствора путем
охлаждения или удаляя из раствора часть растворителя путем испарения или выпаривания, нарушают фазовое равновесие, вследствие чего раствор пересыщается и часть растворенного вещества переходит в твердую фазу, образуя кристаллы определенной структуры.
На рис. 444 приведена кривая растворимости в воде тиосульфата натрия, образующего различные кристал л огидратные формы. Кривая 1 показывает изменение стабильной твердой фазы, представляющей собой пентагидрат Na2S203-5Н20, получающийся в пределах температур от 0 до 48,2°, а кривая 2— изменение твердой фазы дигидрата Na2S20s-2H20 в пределах температур от 48,2 до 66,5°. При температуре выше 66,5°
Получается уже безводная соль Na2S203, которая существует в стабильной форме, находясь в соприкосновении с раствором.
Кривые на рис. 444 дают возможность установить, в какой кристал л огидратной форме будет кристаллизоваться тиосульфат натрия при охлаждении его растворов. Например, из раствора, содержащего 230 г Na2S203 на 100 г воды, при охлаждении до 70° будет выпадать безводный Na2S203; при охлаждении раствора, содержащего 190 г Na2S2Og на 100 г воды, до 55° будет кристаллизоваться дигидрат Na2S20s-2H20 и, наконец, при охлаждении раствора, содержащего от 50 до 160 г тиосульфата натрия на 100 г воды, будет выпадать пентагидрат Na2S203-5H20.
Как уже отмечалось, для получения кристаллов должно быть сдвинуто фазовое равновесие, т. е. раствор должен быть пересыщен. При этом необходимо образование мельчайших кристаллических ядер— центров, из которых затем вырастают кристаллы определенной величины.
Таким образом, весь процесс кристаллизации можно разделить на две стадии: образование ядер вследствие нарушения фазового равновесия раствора и рост образовавшихся ядер в растворе.
Образование кристаллов. Механизм образования ядер—центров кристаллизации до сих пор теоретически недостаточно выяснен. Известно лишь, что если раствор твердого вещества, имеющего нормальную растворимость (возрастающую с повышением температуры), охлаждать до температуры ниже предела его насыщения, то начинается образование микроскопических ядер—-центров, которое зависит от интенсивности охлаждения, скорости и способа перемешивания, температуры и свойств вещества, а также содержания примесей.
Практически установлено, что образованию большого количества ядер благоприятствуют быстрое охлаждение, энергичное перемешивание, высокая температура и небольшой молекулярный вес растворенного вещества.
|
700 |
|
О Ю 20 30 АО 50 60 70 во Температура, "С |
|
444. Кривые растворимости тиосульфата натрия. |
|
Воо |
Количество возникающих при кристаллизации ядер непосредственно сказывается на форме и величине кристаллов. Появление только не
большого числа зародышей—ядер, способствует образованию крупных кристаллов. Медленный рост крупных кристаллов позволяет получать более полногранные формы кристаллов с хорошо развитыми плоскостями.
В случае когда образуется значительное количество ядер—центров в единице объема раствора, получают мелкокристаллические осадки из микроскопических кристаллов со слабо развитыми гранями. В этом случае образуются преимущественно кристаллы пластинчатой или игольчатой формы.
Кроме того, если большое число ядер возникает в сильно разведенных растворах, то твердая фаза получается столь тонко раздробленной, что ее трудно отличить от коллоидных осадков.
Многие растворы, как, например, растворы глауберовой соли, могут быть сильно пересыщены без выделения кристаллов. Выяснено, что для возбуждения процесса кристаллизации таких пересыщенных растворов необходимо ввести в раствор извне хотя бы один мелкий кристалл этой соли или какого-либо другого вещества с той же кристаллической структурой.
Процесс кристаллизации протекает значительно легче вокруг имеющихся в растворе кристаллов или даже мельчайших кристаллических обломков того же вещества. Поэтому весьма часто при проведении процесса кристаллизации предварительно вводят в раствор некоторое количество кристаллов выделяемого вещества.
Развитие микроскопических ядер в видимые кристаллы начинается с того момента, когда возникли кристаллические центры—ядра, причем требуется постоянный приток твердого вещества к поверхности граней кристалла.
В растворе, находящемся в состоянии покоя, по мере роста кристаллов жидкость, находящаяся в непосредственном соседстве с гранями кристалла, перестает быть пересыщенной, и если в эту зону не будет поступать материал из других соседних областей, то рост кристаллов прекратится.
Перенос вещества, подтребного для роста кристалла в неподвижной среде, происходит вследствие возникновения в растворе одновременно с ростом кристалла диффузионных и конвекционных токов.
Диффузионные токи возникают вследствие диффузии, т. е. процесса выравнивания концентраций раствора по всей его массе, протекающего во времени. Закономерности процесса диффузии рассмотрены в главе X.
104. Методы кристаллизации и аппаратура
Процесс кристаллизации имеет такое же широкое распространение, как и выпаривание. В основном все методы кристаллизации можно разбить на две группы:
кристаллизация с удалением части растворителя;
кристаллизация без удаления растворителя.
Кристаллизация может проводиться периодически или непрерывно.
Периодическая кристаллизация проводится в громоздкой аппаратуре и требует больших затрат ручного труда. Кроме того, получающийся в аппаратах периодического действия кристаллический продукт не всегда однороден. Большая производительность аппаратуры и однородности продукта могут быть достигнуты в кристаллизаторах непрерывного действия, получивших наиболее широкое распространение в промышленности.
В некоторых случаях для осуществления кристаллизации требуется понизить растворимость кристаллизуемого продукта, что достигается
41 А. Г. Касаткин.
Введением в раствор какой-либо растворимой соли в сухом виде или в виде насыщенного раствора.
Кристаллизация с удалением части растворителя. Если растворимость кристаллизуемого продукта с понижением температуры изменяется мало, то кристаллизацию чаще всего проводят путем удаления из раствора, некоторой части растворителя.
Удаление растворителя может быть осуществлено двояко: путем кипячения (выпаривания) или путем испарения при температурах, значительно более низких, чем температура кипения раствора.
Соответственно различают следующие виды кристаллизации с удалением части растворителя: 1) выпаривание с кристаллизацией, 2) кристаллизация с воздушным охлаждением, 3) вакуум-кристаллизация.
Выпаривание растворов с одновременной кристаллизацией было описано выше (глава IX). При выпаривании водных растворов в закрытых выпарных вакуум-аппаратах можно поддерживать низкие температуры и интенсивно удалять растворитель
Для получения крупных кристаллов нельзя превысить предел концентрации, достигаемый при выпаривании. Не всегда следует выпаривать растворы до насыщения, так как при сливании таких растворов в кристаллизатор процесс кристаллизации протекает слишком быстро, что ведет к образованию очень мелких кристаллов, а иногда весь раствор затвердевает. Поэтому в каждом конкретном случае необходимо знать предельную концентрацию, до которой можно выпаривать раствор, что устанавливают только опытным путем.
Удаление растворителя путем его испарения при атмосферном давлении протекает весьма медленно и кристаллизация длится значительное время, что создает условия для медленного роста кристаллов. Таким методом пользуются, в частности, при кристаллизации соли из морской воды или на соляных промыслах, где кристаллизацию проводят в больших бассейнах.
Но, как отмечалось выше, рост кристаллов зависит от того, как быстро происходит перемещение кристаллизуемого продукта из раствора непосредственно к граням кристаллических центров. Поэтому для ускорения кристаллизации необходимо либо искусственно уменьшить длину пути к центрам кристаллизации, либо создать путем перемешивания интенсивные токи жидкости.
В производственных условиях кристаллизацию с удалением части растворителя путем испарения его в окружающий воздух проводят в открытых прямоугольных ящиках—кристаллизаторах, в которых подвешиваются ленты или нити из химически стойкого материала.
Вследствие' большой поверхности нитей (лент) на них осаждается основная масса чистых кристаллов; примеси осаждаются на дно и удаляются с маточным раствором.
Очистку нитей (лент) производят на специальных наклонных столах, где с кристаллов стекает маточный раствор. Для более полного удаления маточного раствора кристаллы центрифугируют, а затем сушат.
При расчете кристаллизаторов такого типа необходимо учитывать охлаждение раствора вследствие его испарения и отдачи тепла в окружающую среду через стенки аппарата. Количество жидкости, испаряющейся в единицу времени со свободной поверхности зеркала испарения, можно подсчитать по формуле самоиспарения (2—180).
Кристаллизация путем испарения растворителя без нагревания и перемешивания в большинстве случаев проводится исключительно для получения более крупных, отчетливо образованных кристаллов.
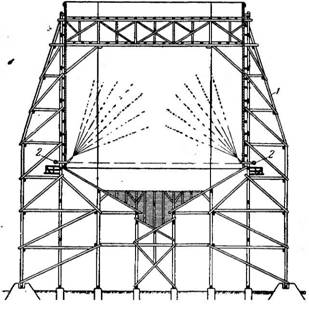
Крупные кристаллы не всегда являются более чистыми по сравнению с мелкими; часто крупные кристаллы срастаются в целые агрегаты, внутри когорых содержится значительное количество маточного раствора и примесей.
Кристаллизацию с удалением части растворителя проводят также в башенных кристаллизаторах (рис. 445). Предварительно охлажденный, раствор вводится в башню (шахту) и распыл ивается в ней специальными распылителями. Охлаждение раствора происходит вследствие испарения мелких капель в воздушном потоке, который образуется в результате разности температу о между раствором и внешним воздухом. На дальнейшую обработку полученные кристаллы вместе с маточным раство - ( ^ tb с! гЬ Јi d=b tb Јi ( } ром поступают самоте - Рис 445> БашеНный кристаллизатор:
КОМ ИЛИ транспортиру- /-шахта; I-распылители.
Ются насосом.
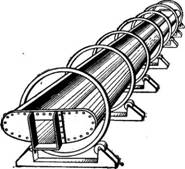
Удаление растворителя путем испарения его при атмосферном давлении протекает медленно и требует громоздкой аппаратуры. Ускорение процесса кристаллизации достигается при перемешивании раствора в шнеков ых кристаллизаторах, которые могут работать периодически и непрерывно.
|
Рис. 446. Шнековый кристаллизатор: /—желоб; 2—мешалка; 3—зубчатая передача. |
Шнековый кристаллизатор (рис. 446) представляет собой открытый горизонтальный желоб /, внутри которого установлена мешалка 2, приводимая в движение через зубчатую передачу 3. Мешалка вращается с небольшой скоростью (•—2 об/мин.).
|
|
Охлаждение раствора в кристаллизаторе такой конструкции происходит только естественным путем вследствие испарения растворителя
с открытой поверхности; несмотря на это, благодаря перемешиванию процесс кристаллизации в шнековых аппаратах протекает примерно в 6—7 раз быстрее, чем в кристаллизаторах ящичного типа.
К числу кристаллизаторов, непрерывно работающих с удалением части растворителя, относятся качающиеся и барабанные
Вращающиеся кристаллизаторы.
Непрерывно действующий качающийся кристаллизатор открытого типа, называемый «люлькой» (рис. 447), представляет собой неглубокое открытое корыто, которое установлено с небольшим наклоном на роликах и приводится в непрерывное движение качения. Раствор подается на кристаллизацию с одного конца корыта и непрерывно протекает вдоль него. Одной из лучших конструкций кристаллизаторов непрерывного действия является барабанный вращающийся кристаллизатор; по производительности, простоте конструкции и надежности в работе такой аппарат превосходит кристаллизаторы других типов, в том числе и качающиеся.
|
Рис. 447. Качающийся кристаллизатор. |
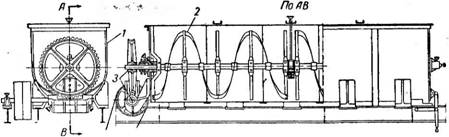
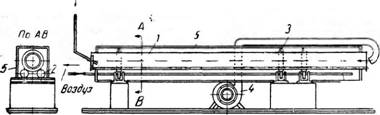
Барабанный вращающийся кристаллизатор (рис. 448) представляет собой цилиндрический барабан 1, опирающийся на две пары вращающихся опорных роликов 2. Труба установлена под небольшим углом к горизонту, поэтому при большой длине ее для предотвращения осевого скольжения верхний бандаж трубы помещается между двумя упорными
|
Ввод раствора |
|
Рис. 448. Барабанный вращающийся кристаллизатор: |
|
/—барабан; 2— опорный ролик; 3—Зубчатый венец; 4—Вентилятор; 5—кожух; 6—паровая труба. |
|
Выход G кристаллоб |
|
|
Роликами; при небольшой длине трубы осевые усилия воспринимаются опорными роликами с ребордами. Труба приводится во вращение при помощи зубчатого венца 3.
Для уменьшения потерь тепла в окружающую среду барабан покрывают снаружи слоем изоляции или заключают в кожух 5. Для предотвращения прилипания кристаллов к стенкам в нижней части кристаллизатора имеются паровые трубы 6, служащие для обогрева той части поверхности барабана, которая соприкасается с раствором.
Над раствором при помощи вентилятора 4 непрерывно пропускают /струю воздуха, который, насыщаясь, уносит с собой пары растворителя. Таким образом, по принципу действия и устройству кристаллизаторы этого типа приближаются к воздушным барабанным сушилкам.
Начальный раствор поступает равномерно по трубопроводу с одного конца барабана, а кристаллы и маточный раствор выходят в приемник
с другого конца. Воздух нагнетается вентилятором при нормальной температуре и движется внутри барабана в направлении, противоположном направлению движения раствора.
Толщина слоя жидкости, расход воздуха и энергии зависят от свойств раствора и желательных размеров кристаллов. Диаметр и длина барабана также зависят от этих факторов и для каждого конкретного случая устанавливаются опытным путем.
|
/—котел; 2, 4—эжекторы; 3—основной кон - 1—4—кристаллизаторы; 5—основной конденсатор; б, 7, денсатор; 5—конденсатор; б—обводная линия. 9— эжекторы; 8—конденсатор; 10— насос. |
Толщина слоя жидкости в аппарате колеблется в пределах от 100 до 200 лш; расход воздуха в зависимости от температуры и концентрации раствора составляет в среднем от 40 до 100 м31мин.
Барабанные вращающиеся кристаллизаторы нормализованы бывш. Главхим - машем и имеют диаметры 800,1000 и 1200 мм. Отношение длины барабана L К его диаметру D Колеблется в пределах L/D= 10—25; число оборотов барабана 5—50 в минуту; угол наклона барабана—до 5°.
Шнековые и барабанные вращающиеся кристаллизаторы могут также работать с охлаждением без удаления растворителя (см ниже).
Более производительными, чем кристаллизаторы с естественным охлаждением и самоиспарением раствора, являются аппараты для кристаллизации, работающие под вакуумом.
Принцип вакуум-охлаждения заключается в том, что если раствор поместить в замкнутый аппарат и создать в последнем вакуум, то вследствие самоиспарения раствор охлаждается до температуры, соответствующей упругости пара над раствором.
Конденсацию выделяющегося пара производят, используя растворитель, в конденсаторах смешения или в поверхностных конденсаторах. Тепло конденсации передается растворителю, вследствие чего довольно значительно сокращается расход тепла.
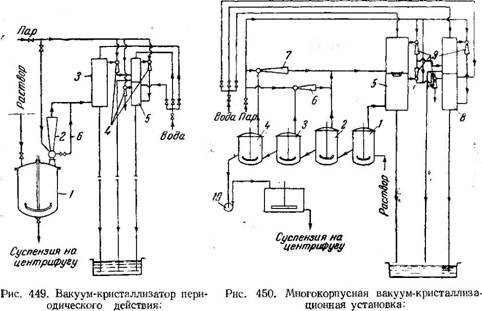
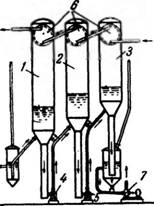
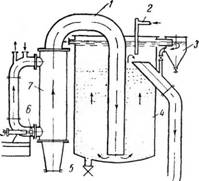
Вакуум-кристаллизатор периодического действия (рис. 449) представляет собой котел I с мешалкой, к которому присоединен пароструйный вакуум-насос (эжектор) 2 и основной конденсатор 3. Для отсасывания воздуха из конденсатора 3 служит вспомогательный трехступенчатый агрегат, состоящий из трех эжекторов 4 и конденсатора 5.
Для сокращения расхода пара охлаждение до температуры, соответствующей давлению в основном конденсаторе 3, ведут без включения эжектора 2, пропуская пар по обводной линии 6 непосредственно в конденсатор 3. После окончания кристаллизации давление в кристаллизаторе повышают до атмосферного и суспензию сливают в центрифугу. !* «По расходу энергии на создание вакуума более экономичными являются многокорпусные вакуум-кристаллизационные установки (рис. 450).
В периодически действующих аппаратах вся жидкость удаляется при постоянном (максимальном) вакууме. В многоступенчатых вакуум-кристаллизационных установках часть жидкости (в первых ступенях) испаряется при меньшем вакууме, а максимальный вакуум достигается в последней ступени. Эти установки работают непрерывно и обладают значительной производительностью.
Установка состоит из нескольких последовательно соединенных кристаллизаторов, по которым протекает раствор под действием вакуума. Испарение и конденсация в кристаллизаторах протекают ступенчато, поэтому в каждом из аппаратов поддерживаются различные вакуум и температура. Основной конденсатор 5 разделен на- две ступени перегородкой с гидравлическим затвором, вследствие чего из одной ступени в другую может перетекать жидкость, но не может проходить пар. При наличии такого устройства в каждой ступени можно поддерживать различный вакуум. Испарение и конденсация по данной схеме происходят в кристаллизаторах 1, 2, 3 и 4.
Аппарат 1 присоединен к нижней части основного конденсатора 5, а аппарат 2—к верхней. Пары из аппаратов 3 и 4 отсасываются эжекторами 6 и 7 и сжимаются до давления, равного давлению на верхней полке конденсатора 5. Удаление суспензии из установки производят насосом 10.
На рис. 451 показана схема вакуум-кристаллизационной установки с ' принудительной циркуляцией раствора. Горячий раствор поступает в^корпус У, где охлаждается за счет самоиспарения и частично кристаллизуется. Передачу раствора и выпавших кристаллов из корпуса 1 в корпус 2 и из последнего в корпус 3 производят при помощи центробежных насосов 4 и 5. Каждый насос не только подает раствор в последующий корпус, но может возвращать часть раствора обратно в тот же корпус, откуда забирает его.
|
Рис. 451. Вакуум-кристаллизационная установка с принудительной циркуляцией раствора /—3—корпуса; 4,'б, 7—насосы; 6— Поверхностные конденсаторы. |
Вследствие этого свежий раствор смешивается с охлажденным раствором, содержащим кристаллы, и не происходит образования значительного числа очень мелких кристаллов. Конденсация образующихся паров происходит в поверхностных конденсаторах 6, в которых по трубам протекает охлаждающая вода или холодный раствор. Охлажденный раствор перекачивается центробежным насосом 7 на дальнейшую обработку.
Кристаллизация без удаления растворителя. Хотя при кристаллизации с удалением растворителя кристаллы получаются крупными, зато, как было отмечено, создаются благоприятные условия для образования больших срастающихся агрегатов. В результате такого сращивания в кристаллизуемый продукт попадают примеси в виде маточного раствора. Кроме того, удаление растворителя методом испарения протекает весьма медленно, а выпаривание обходится сравнительно дорого. Поэтому очень часто кристаллизацию проводят, охлаждая раствор водой или холодильным рассолом в аппаратах, в которых осуществляется непрерывный ток раствора, или в аппаратах, снабженных механическими мешалками.
|
Рис. 452. Кристаллизатор с перемешиванием и охлаждением: 1 —котел; 2—мешалка; 3—змеевик; 4—привод. |
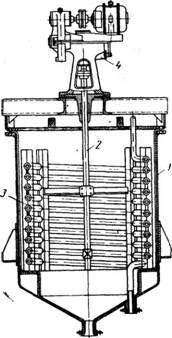
Кристаллизатор с перемешиванием и охлаждением (рис. 452) представляет собой герметически закрытый цилиндрический котел 1 с плоской крышкой и коническим дном; котел снабжен мешалкой 2. Охлаждение производится водой или холодильным рассолом, которые пропускаются через змеевик 3. Аппарат разгружают через штуцер, имеющийся в днище. Такие аппараты изготовляют также с рубашками, при эгом, чтобы устранить выпадание кристаллов на стенках аппарата (что повело бы к значительному ухудшению теплопередачи), лопасти мешалки снабжают скребками или металлическими щетками.
Кристаллизаторы этого типа работают периодически или непрерывно. При непрерывной работе соединяют несколько аппаратов последовательно и раствор перетекает из одного кристаллизатора в другой.
|
|
|
Рис. 453. Кристаллизатор открытого типа с мешалкой: /—корыто; 2—Водяная рубашка; 3—Мешалка; 4, 5— патрубки дляТвхода и выхода раствора; 6, 7—штуцеры для входа и выхода охлаждающей воды. |
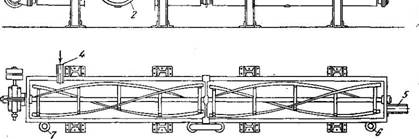
Непрерывно действующий кристаллизатор открытого типа с мешалкой (рис. 453) состоит из открытого корыта 1 шириной 600 мм и длиной до 12 м, имеющего полуцилиндрическое дно и секцион
ную водяную рубашку 2. Внутри корыта на горизонтальном валу расположена тихоходная ленточная мешалка 3. Если для проведения кристаллизации требуется значительная поверхность, устанавливают несколько аппаратов, последовательно один над другим, с тем чтобы раствор мог перетекать из одного аппарата в другой.
Горячий концентрированный раствор поступает в аппарат с одного конца и протекает вдоль корыта, а охлаждающая вода в рубашке движется в противоположном направлении.
Благодаря охлаждению процесс кристаллизации начинается вблизи от места входа раствора и полностью заканчивается до выхода его из корыта. Так как раствор перемешивается, осаждение кристаллов на охлаждаемой поверхности затрудняется. Кристаллы постоянно находятся во взвешенном состоянии, что способствует образованию индивидуальных и однородных по величине кристаллов.
|
Охлаждением: 1—вращающийся барабан; 2— неподвижный барабан; 3—пустотелый вал; 4—каналы Для удаления воды. |
Кристаллизацию с охлаждением без удаления растворителя проводят также во вращающихся кристаллизаторах с внутренним охлаждением.
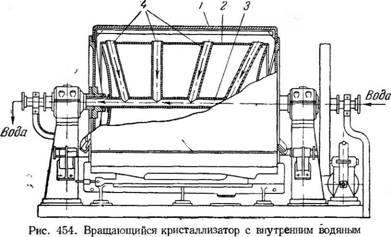
Аппаратами такого типа являются барабанные вращающиеся кристаллизаторы (рис. 454), снабженные водяной рубашкой. На работу барабанных кристаллизаторов с водяным охлаждением расходуется меньше энергии, так как отпадает необходимость в установке вентилятора. Процесс кристаллизации в них протекает с большой скоростью, и при той же производительности кристаллизаторы с водяным охлаждением могут иметь меньшую длину и меньший диаметр, чем воздушные; однако во вращающихся барабанных кристаллизаторах получают только очень мелкие кристаллы.
Непрерывно действующий вращающийся кристаллизатор с внутренним водяным охлаждением (вальцы) применяется главным образом для кристаллизации расплавленных продуктов, например аммиачной селитры. Внутри вращающегося чугунного барабана 1 находится второй неподвижный стальной барабан 2 меньшего диаметра. Охлаждающая вода поступает через правую пустотелую цапфу вала 3 внутрь наружного барабана и движется в кольцевом пространстве между барабанами.
Вода движется по каналам 4, проходящим в верхней части внутреннего барабана, и удаляется через левую пустотелую цапфу вала.
Расплавленный продукт поступает равномерной струей в корыто с паровым обогревом и кристаллизуется тонким слоем на наружной поверхности вращающегося барабана. Кристаллы снимаются с барабана ножом. Число оборотов барабана 3,5 в минуту.
Производительность кристаллизатора зависит от длины барабана, степени погружения его в жидкость и от числа оборотов. Кроме того, на производительность влияют свойства кристаллизуемой жидкости, температура ее затвердевания и температура охлаждающей воды.
Одним из существенных факторов, влияющих на производительность кристаллизаторов с водяным охлаждением, является температура кристаллизации обрабатываемой жидкости. Чем ниже эта температура, тем меньше производительность кристаллизатора, так как уменьшается разность температур между жидкостью и охлаждающей водой и, следовательно, охлаждающая вода отнимает меньшее количество тепла.
В отдельных конструкциях непрерывно действующих кристаллизаторов процесс кристаллизации можно регулировать для получения однородного продукта.
При пересыщении раствора путем охлаждения (или путем испарения части растворителя) возникают две области: метастабильная, в которой происходит рост кристаллов, и лабильная, в которой происходит образование центров кристаллизации. Регулируя метастабильное пересыщение, можно создать условия, при которых скорость роста кристаллов будет наибольшей, а скорость образования центров кристаллизации наименьшей.
В непрерывно действующем кристаллизаторе раствор пересыщается в одной части аппарата, а кристаллизация происходит в другой, причем кристаллы, достигшие требуемого размера, удаляются из зоны кристаллизации. Раствор поступает в аппарат (рис. 455) по трубе 2 ив холодильнике 7 пересыщается до метастабильного состояния. Циркуляционным насосом 5 раствор подается по трубе 1 в сосуд 4, в котором происходит выпадание кристаллов. Образующиеся кристаллы циркулируют с раствором до тех пор, пока скорость их осаждения не станет больше скорости циркулирующего раствора. Таким образом, в сосуде 4 происходит классификация кристаллов по размерам. Величину кристаллов регулируют, изменяя скорость циркуляции раствора и скорость отвода тепла в холодильнике 7. Для отделения образующихся в небольшом количестве мелких кристаллов служит сепаратор 3.
Расчеты по процессу кристаллизации. Расчет кристаллизации сводится к составлению материального и теплового балансов для определения производительности аппарата (выхода кристаллов) и количества тепла, которое надо подвести или отнять в процессе кристаллизации.
|
|
|
|
|
F |
|
|
Рис. 455. Непрерывно действующий кристаллизатор: |
|
/—труба; 2—труба для подачи раствора; 3— сепаратор; 4—сосуд-кристаллизатор; 5—циркуляционный насос для раствора; 6—Циркуля ционный насос для охлаждающей воды; 7— холодильник. |
Составление матери а-л ьного баланса. Примем обозначения:
Glt G2 И GKp.—вес исходного раствора, маточного раствора и кристаллов в /сгс;
W—вес испаренного растворителя в кгс;
Вг и В2—концентрация исходного и маточного растворов в весовых долях;
— —отношение молекулярных весов растворенного вещества
И кристаллогидрата (при выделении кристаллов в безводной форме Вкр, = 1).
В общем случае материальный баланс выразится равенством
G1==G2 + GKP. + W (3-310)
А уравнение материального баланса, считая на безводный продукт:
Ед=а2в.2 + Gkp Бкрв (3-311)
Решая совместно уравнения (3—310) и (3—311), находят величину выхода кристаллов:
Г — Вг)—WB2 /о Oio\
°кр== Вкр. — В2 61 Z)
Рассмотрим, как соответствует общее уравнение (3—311) различным видам процесса кристаллизации.
При проведении кристаллизации без удаления растворителя, т. е. с водяным или рассольным охлаждением, очевидно, W=0 и уравнение принимает вид:
°С-.Є? (3-312а>
Кристаллизация с удалением части растворителя, как указывалось выше, может проводиться при нагревании (выпаривание), воздушном охлаждении или под вакуумом (вакуум-кристаллизация).
При выпаривании с кристаллизацией либо принимают какое-то количество испаренного растворителя W, либо определяют его по уравнению (3—311), исходя из заданного GKp..
Для процесса кристаллизации с воздушным охлаждением
W = L{X2 — X1) (3—313)
Где L—расход сухого воздуха в кгс\ хх и х2—начальное и конечное влагосодержание воздуха в кгс/кгс сухого воздуха (см. стр. 663).
Количество растворителя, удаленного в процессе вакуум-кристаллизации, может быть определено путем совместного рассмотрения уравнения (3—312) и уравнения теплового баланса.
Рассмотрим тепловой баланс процесса в общем виде.
Обозначим в дополнение к предыдущему: сг, с2 и с0—средняя теплоемкость исходного раствора, маточного раствора и охлаждающей воды в ккалікгс-°С; —температура исходного раствора в °С; t3—температура маточного раствора и кристаллов в °С; t2l1 и t2к—начальная и конечная температуры охлаждающей воды в °С.
Общий приход тепла состоит из нескольких составляющих:
1. Тепло, вносимое с исходным раствором
Q, — G^T-I Ккал (3—314)
Теплота образования кристаллов.
По закону Гесса, теплота реакции (А-(-/гВ=С) образования кристаллогидрата из раствора и воды:
Я = Яс —Як — пяв (3—315)
Где п—количество молей гидратированно'й воды на 1 моль кристаллизуемого вещества (если кристаллы выпадают в безводной форме, то п=0); Яа, Яв и QС—теплота образования из элементов кристаллизуемого вещества в растворенном виде, . гидратированной воды и кристаллогидрата в ккал/г-моль. Тепло, выделяющееся при кристаллизации за счет теплоты образования кристаллогидратов, находят из уравнения
= ккал (3-316)
Тепло, сообщаемое раствору при нагревании.
Эта величина—Qs определяется из уравнения теплового баланса. Расход тепла складывается из следующих величин:
Тепло, уходящее с маточным раствором
Q4 = G2c2/3 ккал (3—317)
Тепло, уходящее с кристаллами
Qb^=GKT>.cKP. t3 ккал (3—318)
Тепло, удаляемое с парами растворителя
Qe = Wi (3—319)
Где і—теплосодержание паров растворителя в ккалікгс.
Тепло, отнимаемое охлаждающим агентом: при охлаждении водой или холодильным рассолом
Q7 = G0c0(t2K — t2u) ккал (3—320)
При охлаждении воздухом
Q7 = L(/1 — /2) ккал (3—321)
Где 1г и /2—теплосодержание воздуха на входе и выходе из кристаллизатора в ккалікгс (см. стр. 655).
Потери тепла в окружающую среду.
Этот расход тепла определяют по известной формуле теплоотдачи
Q* = а^т (/ст. а — *„) ккал]
Таким образом, тепловой баланс процесса в общем случае может быть выражен следующим образом:
Qi + Q2'+ Qs = Q* + Qs + Qe 4- QT + Qs (3-322)
Применительно к отдельным видам кристаллизации это уравнение должно быть видоизменено.
При выпаривании с кристаллизацией Q7=0.
При кристаллизации с охлаждением водой, холодильным рассолом или воздухом Q3=0.
При вакуум-кристаллизации Q3=Q7=0.
В кристаллизаторах с охлаждением можно пренебречь потерей тепла в окружающую среду и принять Q8=0-