АППАРАТЫ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
Фазовое равновесие
|
|
Фактор интенсивности. Протекание диффузионных процессов обусловливается наличием в системе двух фаз и заключается в переходе вещества из одной фазы в другую. Процесс перехода вещества из одной
29 А. Г. Касаткин
Фазы в другую, т. е. массообмен, или массопередача, в изолированной замкнутой системе, состоящей из двух или большего числа фаз, возникает самопроизвольно и протекает до тех пор, пока между фазами при данных условиях температуры и давления не установится подвижное фазовое равновесие, при котором в единицу времени из первой фазы во вторую переходит столько же молекул, сколько в первую из второй.
Как известно из термодинамики, любой процесс, самопроизвольно протекающий в замкнутой изолированной системе, характеризуется фактором интенсивности данного вида энергии. Так, при протекании гидродинамических процессов фактором интенсивности является высота напора или гидродинамическое давление, а при, протекании тепловых процессов фактором интенсивности является температура.
Возникновение самопроизвольного процесса, его направление и предел перехода данного вида энергии из одной части системы в другую зависят только от числового значения фактора интенсивности в разных частях системы, а"в тепловых процессах—от термодинамического потенциала.
Процесс возникает самопроизвольно при условии, что числовые значения фактора интенсивности в разных частях системы не равны или если термодинамический потенциал в системе больше нуля. Процесс протекает в направлении от части системы с большим фактором интенсивности к части с меньшим фактором интенсивности и, наконец, система приходит в состояние подвижного равновесия, когда все части ее имеют одинаковый фактор интенсивности и термодирямииргк-ий потенциал системы равен нулю.^
£5 процессах массообмена между фазами, при отсутствии химического взаимодействия компонентов системы, фактором:., интенсивности является химическийпотенциал [а. В условиях равновесия фаз в отношении распределяемого компонента числовые значения химического потенциала этого компонента в обеих фазах должны быть равны между собой.
В однокомпонентных фазах величина химического потенциала равна изобарному потенциалу ZK. Химический потенциал любого компонента в многокомпонентной фазе равен парциальному значению изобарного потенциала этого компонента в данной фазе и для любого компонента смеси идеальных газов определяется как:
^KZK + Kf\NpK^- (3-5)
Где kZK—значение изобарного потенциала для одного моля при давлении р = \ ата в ккал! кг-мол\ #=1,987 ккал! кг-мол-°К—газовая постоянная; Т—абсолютная температура газа в °К;
Рк—парциальное давление данного компонента в смеси в долях от
Общего давления. ДЛя реальных газов, к которым неприменимы законы идеальных газов, в уравнении (3—5) парциальное давление заменяется парциальной фугитивностью fK[1] данного компонента"в смеси.
Уравнение (3—5) показывает, что чем выше при данной температуре парциальное давление данного компонента в газе, тем выше значение его химического потенциала и тем самым выше его способность и стремление к выходу из данной фазы. Таким образом, парциальнсе давление данного компонента в газовых бмесях может служить характеристикой фактора интенсивности и двчукутрн силы пронесся мягсопередачиГ
Для жидких ц твердых компонентов фазовых систем такие простые ©тношения между химическими потенциалами и какими-нибудь другими свойствами или параметрами неизвестны, однако при небольших давлениях и в этих случаях можно считать, что парциальное давление насыщенного пара данного компонента может служить характеристикой химического потенциала компонента не только в парах, но и в равновесном с ним твердом теле или жидкости.
Правило фаз. Существование данной фазы в системе или равновесие фаз возможны лишь в определенных условиях; при изменении этих условий равновесие системы нарушается, происходит сдвиг фаз или переход вещества из одной фазы в другую."
Возможность существования данной фазы в равновесии с другими определяется правилом фаз, или законом равновесия фаз.
Условия, при которых система находится в равновесии, могут меняться (система может находиться при разных температурах, давлениях и концентрациях). Условимся называть составной частью системы, или компонентом, каждое из содержащихся в ней химически однородных веществ, которое выделяется из нее и может существовать в изолированном виде длительное время. Компоненты системы, наименьшее число которых достаточно для образования всех фаз данной системы, называют независимыми компонентами.
Правило фаз в общем виде выражается уравнением
С Ф «= k + п (3—6)
Где С—число степеней свободы или минимальное число факторов, которые можно изменять независимо друг от друга без нарушения равновесия данной системы;
Ф—число фаз системы;
K—число независимых компонентов системы;
П—число внешних факторов, влияющих на положение равновесия в данной системе.
Правило фаз формулируется так: сумма числа степеней свободы системы и числа фаз равна сумме числа независимых компонентов и числа внешних факторов, влияющих на равновесие этой системы.
Применительно к процессам массопередачи внешними факторами, влияющими на равновесие системы, являются лишь температура и давление, поэтому п== 2 и правило фаз принимает такой вид:
C = k — Ф+2 (3—6а)
Т. е. число степеней свободы равновесной терме - динамической системы, на которую из. внешних факторов влияют только температура и давление, равно числу независимых компонентов системы минус число фаз системы плюс два.
В зависимости от числа степеней свободы, системы могут быть: безвариантными (при С=0), одновариантными (С=1), двухвариант - ными (С= 2) и многовариантными (С>2).
Однокомпонентные системы. Если система состоит только из одного компонента, т. е. представляет собой чистое индивидуальное вещество, то возможность одновременного существования всех трех фаз—твердой, жидкой и газообразной, по правилу фаз определяется отсутствием степеней свободы, так как в этом случае
С= 1 —3 + 2=0
И система безвариантна. Такая система может существовать только при строго определенных значениях температуры и давления (для воды ^=0,0075°С и р=4,579 мм рт. ст.). Изменение любого из этих условий
Приводит к исчезновению одной из фаз и система становится двухфазной.
Наиболее интересной однокомпонент - ной системой является двухфазная система—жидкость и насыщенный пар. В этом случае
С=1—2+2=1
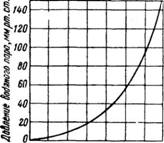
И система является одновариантной. Следовательно, не нарушая фазового равновесия, можно произвольно менять либо температуру, либо давление. В таких системах строго однозначна зависимость между температурой и давлением насыщенного пара. Поэтому при изменении температуры пара одновременно будет соответственно меняться давление и, наоборот, при изменении давления соответственно меняется и температура; для каждой жидкости можно, таким образом, построить кривую давления насыщенного пара. В качестве примера приводится кривая давления водяного пара (рис. 308). ^
Для проведения диффузионных процессов необходимо знать зависимость от температуры давления паров чистых жидкостей, входящих в состав смесей. Обычно такие кривые строят на основании опытных данных, которые для многих жидкостей приведены в литературе. Однако нередко приходится вычислять давление паров чистых жидкостей по теоретическим зависимостям или косвенными методами.
При любом равновесном переходе вещества из одной фазы в другую соблюдается зависимость, выражаемая уравнением Клаузиуса—Клапейрона
R = ATdЈ ДІЛ
Где г—теплота фазового перехода (испарения, плавления, субли
Мации и др.) в ккал! кг-мол\
А = ^ —тепловой эквивалент работы в ккал/кгс
Т—абсолютная температура фазового перехода в °К;
Р—давление в кгс/м2;
Д1/—изменение, мольного объема вещества при фазовом переходе в м3/кг-мол.
|
-10 О 10 20 30 UO 50 60 Температура, °С Рис. 308. Кривая давления насыщенного водяного пара. |
Применительно к двухфазной системе жидкость—пар перепишем это уравнение так:
|
DT |
DP г (3—7)
А(Уп-Уж)Т
Где /-—теплота испарения при данной температуре в ккал! кг-мол\ Vn—молярный объем пара в м3/кг-мол; Уж—молярный объем жидкости в м3(кг-мол.
В области невысоких давлений пара молярный объем жидкости исчезающе мал по сравнению с молярным объемом пара, поэтому без большой погрешности можно величиной Уж пренебречь, принимая Кж=0. Тогда
AVn = -^
Где R= 1,99 ккал! кг-мол ■ °К.
При этих условиях уравнение (3—7) принимает следующий вид:
DP___ Г Р DT RT*
Или
DP __RdT ,Q 7 )
ИЛИ
D\NP = ~DT (3-76)
При небольших интервалах температур величина г имеет примерно постоянное значение. Тогда интегрирование уравнения (3—76) дает
In Я =--- Jp+C (3—7в)
Где С—постоянная интегрирования.
По уравнению (3—7в) удобно вести практические расчеты, так как оно является уравнением прямой зависимости логарифма давления от обратной величины абсолютной температуры. Если для какой-либо одной температуры Т известно давление Р, то, зная величину г, можно из уравнения (3—7в) найти числовое значение константы С, после чего построить
Прямую в координатах lgP, у и по ней находить значение Р для любых
Других температур.
Если величина г также1 неизвестна, то для построения диаграммы необходимо знать давления при двух температурах, составить два уравнения и, решая их, определить значения г и С.
Уравнение (3—7а) можно интегрировать в пределах от Тх до Т2 и соответственно от Рг до Р2\ тогда получим новое уравнение для определения давления насыщенных паров в зависимости от температуры:
InA ' / L--M (3—8)
R тг
Исходя из условия прямолинейности функции, можно построить диаграмму, связывающую давление пара любого вещества с давлением пара некоторого стандартного вещества.
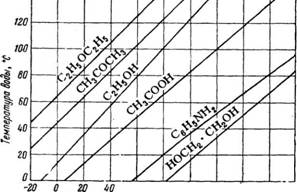
Отложим по оси ординат (рис. 309) температуру кипения стандартного вещества (воды), а по оси - абсцисс—температуру кипения различных веществ, при которых давление их пара такое же, как и пара стандартного вещества. Линии постоянного давления, которые соединяют температуры кипения данных веществ, соответствующие температуре кипения стандартного вещества при том же давлении, изображаются на
диаграмме в виде прямых. Так, например, пары анилина при 80° имеют такое же давление, как и пары воды при 20°, и если последнее известно, то может быть определено и давление паров анилина при 80°.
Для удобства пользования диаграммой рис. 309 строится дополнительно диаграмма зависимости давления водяного пара от температуры (рис. 310). По этой диаграмме находят, например, что при 20° давление пара воды равно 18 мм рт. ст.; это и будет давлением паров анилина при 80°. Так как прямая может быть построена по двум точкам, то для нанесения на диаграмму линии температур кипения данного вещества необходимо
Знать по крайней мере
Ш\------ г------------------ —-г-—тп—7-і------------- гт— две температуры кипения
При двух соответствующих давлениях. При этом одной точкой может служить обычно известная температура кипения вещества при 760 мм рт. ст., а второй любая другая температура при любом другом давлении. Если вторая температура неизвестна, то ее можно определить по уравнению (3—8).
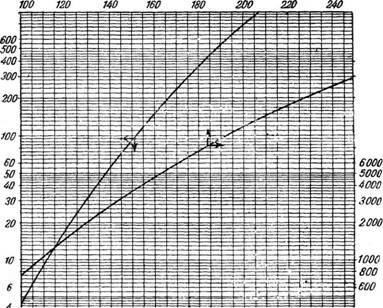
Существует и другой, более точный метод построения кривой зависимости давления пара от температуры. По оси ординат (шкала логарифмическая) откладывают давления, а по оси абсцисс — соответствующие температуры (рис. 311); шкала оси абсцисс неравномерна, и ее масштаб подобран так, что зависимость логарифма давления некоторого стандартного вещества (воДы) от температуры выражается прямой линией.
После построения линии для воды наносят линии для паров других веществ.
Преимущество такой диаграммы заключается в том, что для близких друг к другу веществ одного и того же гомологического ряда линии температур кипения сходятся в одной точке. Поэтому, если данное вещество принадлежит к группе веществ, имеющих общую точку, то достаточно определить экспериментально лишь одну точку (температуру кипения при 760 мм рт. ст.),- а второй служит общая для всей группы точка пересечения линий.
Двухкомпонентные системы. Если система состоит из двух или большего числа компонентов, то ее положение и равновесие зависят не только от температуры и давления, но и от количественного состава фаз.
Двухкомпонентная система, состоящая из двух фаз, по правилу фаз имеет две степени свободы:
С = K — Ф -J- 2=2 — 2 + 2 = 2
|
60 60 WO 120 Температура жидкости, "С |
|
160 WO |
|
Рис. 309. Диаграмма для определения давления пара различных веществ в зависимости от температуры. |
Что означает, что в таких системах можно без нарушения равновесия фаз менять одновременно два фактора—температуру и давление. Для характеристики равновесного состояния этих систем один из факторов принимают постоянным, и тогда зависимость между другим фактором и составом фаз становится однозначной, т. е. при постоянном давлении
Температура, °С
|
/ООО 800 |
|
40000 ^ 30000 J 20000 \ |
|
10000 8000 |
|
Рис. 310. Диаграмма зависимости между давлением и температурой водяного пара. |
|
----------------------------------- ,----- _400 О 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 Температура, °С |
|
ЮОООО /60000 4-0000 30000 Гоооо 10000 6000 4-000 3000 ^ 2000 % Fg /ООО БОО I 4-00 Tf 300 § Zoo |
|
О 10 20 304050 75 WO /50 200 250 300 Температура, °С Рис. 311. Диаграмма зависимости давления пара различных веществ от температурь^ |
|
40 Зо Го /о 6 4 З Г |
Каждой температуре, а при постоянной температуре каждому давлению соответствуют строго определенные составы фаз.
Более подробно свойства двухкомпонентных систем будут рассмотрены ниже применительно к конкретным диффузионным процессам, здесь же остановимся на общей функциональной зависимости между равновесными составами фаз.
Закон Генри. Равновесный состав фаз в системах газ—раствор газа в жидкости определяется для идеальных газов по закону Генри. По закону Генри парциальное давление растворенного идеального газа пропорционально его молярной доле в растворе:
Р = Цх (3-9)
Или растворимость идеального газа в жидкостях при данной температуре пропорциональна его парциальному давлению над жидкостью, т. е.
Х = ~р (3—9а)
Где х—молярная доля газа в растворе; - Ф—коэффициент пропорциональности, называемый коэффициентом Генри;
Р—парциальное давление газа над раствором. Размерность ф и его числовые значения для каждого данного газа зависят от свойств газа и жидкости, в которой газ растворяется, и от принятой системы единиц.
Если г/р—молярное равновесное содержание данного компонента в газовой смеси и Р—общее давление в системе, то парциальное давление можно выразить равенством
Р = УРр
Подставив это значение р в уравнение (3—9), получим
__ Р_
Х— ф УР
Откуда
(3-Ю)
Или
0p = *i*\J (3—10а)
Где kx = -~—коэффициент распределения, или константа фазового
Равновесия, величина безразмерная. Уравнение (3—10а) показывает, что для идеальных газов равновесная зависимость между содержанием данного компонента газовой смеси в газе и в жидкости выражается прямой линией, проходящей через основание осей координат и имеющей угол наклона, тангенс которого равен kv
Фазовое равновесие между раствором идеального газа в жидкости и газовой смесью над жидкостью подчиняется закону Генри только при температурах выше критических.
Закон Рауля. Когда температура газа ниже критической, система будет двухфазной: жидкость—насыщенный пар; равновесие такой системы характеризуется составом жидкости х и составом находящегося в равновесии с жидкостью насыщенного пара ур.
Фазовое равновесие жидких идеальных растворов подчиняется закону Рауля, по ксторому парциальное давление любого компонента в парах над смесью жидкостей равно упругости насыщенного пара этого компонента (при данной температуре), умноженной на его молекулярную долю в жидкости:
Рк = Р«х
Где рк—парциальное давление данного компонента в парах над жидкостью, выраженное в долях от общего давления; Рк—упругость паров чистого данного компонента при данной температуре;
Л:—молекулярная доля данного компонента в жидкости. Для любого компонента парциальное давление
Р = УРР
И, 4следовательно,
(3-11)
По закону Дальтона для двухкомпонентной системы, состоящей из компонентов А и В
Р = ра + Ре
Или
Р=Рах + Рв(\-х) Подставив найденное значение Р в уравнение (3—11), получим
РАХ
Ур = РАХ+РВ{1-Х) (3-12)
Деля числитель и знаменатель правой части уравнения (3—12) на Рв, получим
Ур = 1+/(а-1) (3~13>
РА '
Где а= - g--------- относительная летучесть компонентов смеси.
В
Уравнение (3—13) показывает, что для идеальных растворов равновесная зависимость между составами жидкости и пара над жидкостью выражается гиперболойL проходящей через основание (х=0) и вершину (х=1) прямоугольной системы осей координат.
В тех же случаях, когда для равновесной системы не действительны приведенные выше законы фазового равновесия, зависимость между составом пара над жидкостью и составом жидкости может быть найдена только опытным путем и в общем случае выражается уравнением
YP = F(X) (3-14)
І или
Ур = Ах» (3-15)
Однако и в этом случае на диаграмму у—х может быть нанесена кривая равновесия по опытным данным, которые для многих жидкостей приведены в справочной и специальной литературе.