ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ХЛОРИРОВАННЫХ ПОЛИМЕРОВ ПОД ДЕЙСТВИЕМ ФИЗИЧЕСКИХ ФАКТОРОВ
Химические превращения хлорированных полимеров при нагревании
Реакции термического разложения хлорсодержащих полимеров активируются атомами хлора, связанными с третичными атомами углерода, атомами хлора, находящимися в а-положении к двойным связям (аллильный хлор), вицинальными атомами хлора, трихлорэтиленовыми группами, концевыми ненасыщенными группами. Термическому разложению соседних звеньев макромолекул способствуют двойные связи, кислородсодержащие функциональные группы (карбонильные, карбоксильные, перекисные и гидроперекисные), хлористый водород и т. д., образующиеся при деструкции и окислении полимеров. Предполагают, что интенсивная окраска полимеров, появляющаяся уже при сравнительно низких степенях деструкции, обусловлена образованием в макромо-
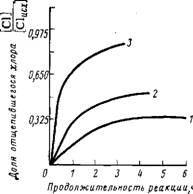
Рис. 2.2. Кинетика дегидрохлорирова - ния при 150 °С ХПЭ без добавок (1), в присутствии 2 масс. ч. стеариновой кислоты (2) и 2 масс. ч. перекиси ди - кумила (3).
Лекулах последовательностей сопряженных С = С-связей или С = С-связей, сопряженных с С = 0-группами [89].
ХПЭ, судя по данным термогравиметрического анализа, по стабильности в инертной среде занимает последнее место в ряду, уступая даже хлоропреновому каучуку [90]: бутадиен-акрилбнитриль - ный сополимер>бутадиен-стирольный каучук>бутилкаучук>на - туральный каучук>полихлоропрен>ХПЭ.
Процесс термической деструкции ХПЭ протекает во времени с переменной скоростью [91]. Через 10—20 мин нагревания скорость разложения ХПЭ резко падает и разложение при данной температуре прекращается. С увеличением содержания хлора в полимере от 24 до 45,2% начальная скорость дегидрохлорирования ХПЭ при 120—210 °С в инертной и окислительной атмосфере возрастает [92]. Наличие определенного предела разложения ХПЭ при каждой температуре связано с тем, что отщепление хлористого водорода сопровождается образованием пространственно сшитых структур (в случае ПВХ образуются полиеновые структуры [92, 93]), элиминирование НС1 из которых затруднено.
Энергия активации процесса деструкции ХПЭ в интервале температур 135—168 °С составляет 29,7 кДж/моль (для ПВХ—121— 138 кДж/моль [84]). Исследование кинетики дегидрохлорирования ХПЭ (содержание хлора 30,8%) при 150°С показало, что отщепление НС1 при нагревании ХПЭ без добавок является реакци: ей первого порядка с константой скорости 1,795 • 10~4 с-1 [94].
|
|
|
S? |
Малая энергия активации реакции дегидрохлорирования, а также отсутствие ингибирующего влияния на этот процесс ингибитора радикальных реакций позволили [91, 95] предположить ионный механизм отщепления хлористого водорода. Атомы хлора индуцируют на а - и p-углеродных атомах положительные заряды, облегчающие отщепление атомов водорода.
Имеются данные [94], что термическое дегидрохлорирование ХПЭ активируется как стеариновой кислотой, так и перекисью дикумила (рис. 2.2). Поэтому можно полагать, что термическое дегидрохлорирование ХПЭ протекает по смешанному ионно-ради - кальному механизму.
'Межмолекулярное отщепление хлористого водорода сопровождается образованием поперечных связей между полимерными цепями:
Н Н Н Н
|
С-с—.. І Н I -с—с—•• I I н н |
|
—С—С--------- Н* і Сг н І і —с—с--------------- I I н н |
|
+ неї |
Термоокислительная стабильность ХПЭ при 170 °С зависит от типа исходного ПЭ, условий его хлорирования и содержания хлора в полимере [96]. В частности, ХПЭ, полученный из ПЭНД, более стабилен, чем ХПЭ из ПЭВД. Наибольшей стабильностью обладают образцы с содержанием хлора до 10—20% и более 60— 70%. Хлорированные полиолефины разлагаются легче всего, когда на каждую мономерную единицу приходится по одному атому хлора [91]. При термическом дегидрохлорировании ХПЭ в токе азота, содержащего всего 0,003% кислорода, доля лабильного хлора с увеличением общего содержания связанного хлора снижается [97].
Скорость дегидрохлорирования ХПЭ сильно зависит от его микротактичности [98] вплоть до содержания хлора 56—61%. При более высоком содержании хлора влияние микротактичности перекрывается стерическими препятствиями, связанными с присутствием структур —СН2—СНС1—СС12—, —СНС1—СНС1—СС12—, —СНС1—СНС1—СНС1—, —СН2—СНС1—СНС1— или —СНС1— —СН2—СС12— в цепи ХПЭ. При предельном содержании хлора (73%) максимальная скорость дегидрохлорирования ХПЭ тем ниже, чем выше отношение содержания структур [СНС1] : [СН2].
Влияние среды, в которой проводилось хлорирование, на термоокислительную стабильность ХПЭ невелико [96]. Однако при термическом дегидрохлорировании в токе азота доля лабильных атомов хлора в ХПЭ, полученном хлорированием в суспензии, снижается при хлорировании в среде: Н20>СС14> (Н20-|-СС14) [97].
Порошкообразные образцы ХПЭ имеют более высокие скорости дегидрохлорирования, чем формованные [99].
Дегидрохлорирование ХПЭ ускоряется в присутствии кислот Льюиса [100]. Наиболее эффективным катализатором является
ZnCl2. Как и при отщеплении НС1 от галогеналкилов {84], первичным актом является образование комплексов между хлоридами металлов и атомами хлора в цепи полимера. Связь С—СІ в макромолекуле ослабляется и наиболее вероятным становится отрыв атома хлора с активацией дальнейшего хода процесса элиминирования НС1.
Предложены две схемы процесса [101]. Согласно первой из них имеет место многостадийный ионный процесс, включающий следующие стадии:
1. Образование комплекса между электрофильным реагентом и атомом хлора в полимерной молекуле:
--------------------------------------------------------------- СН—СН------------
I I
Н С1.--А1СІЗ
2. Образование карбкатиона (стадия определяет скорость всей реакции):
-------------------------------------- сн-сн-------
I
Н [А1С14Г
3. Отщепление протона от карбкатиона и образование двойной связи в полимере:
Н Н
I I
--------------------------------- С=С--------- [А1С14]-Н+
4. Распад кислоты Льюиса:
[А1С14]"Н+ --------------------------------------------------------- V НС1+А1СІЗ
Предполагается, что 3 и 4 стадии протекают очень быстро, ибо промежуточные соединения — карбкатиои и кислота — весьма неустойчивы.
В соответствии с другой схемой разрыв старых и образование новых связей происходит в шест. ич ленном молекулярном комплексе:
Н Н
I I
НС1 +А1С13 Ч--------------------------------------------------------------------------------------- С=С—
---------------------------------- СН-СН--------------
Н (L
CI— А1— С1
"А
Экспериментально обе схемы пока не подтверждены.
Чем выше степень хлорирования ХПЭ, тем меньше скорость поглощения им кислорода [92]. Полагают, что это связано с затрудненным присоединением кислорода к полимерной цепи, содержащей электронно-акцепторные атомы хлора. Добавка антиоксидантов приводит к появлению периода индукции окисления ХПЭ и одновременному уменьшению скорости дегидрохлорирования. Наиболее эффективна смесь 1% дистеарилтиодипропионата и 1 % 2,2'-диокси-3,3'-а-метилциклогексил-5,5'-диметил-дифенилмета - на, при использовании которой период индукции составляет примерно 30 ч, а скорость поглощения кислорода после окончания периода индукции уменьшается в 15 раз по сравнению с нестаби - лизированным ХПЭ. В присутствии антиоксидантов из группы ок - силированных дифениламинов скорость дегидрохлорирования возрастает [100]. Замедлители дегидрохлорирования (эпоксидная смола, соли и оксид свинца) действуют одновременно и как сильные антиоксиданты [92].
Методом пиролитической газовой хроматографии показано [102], что при сжигании ХПЭ, содержащего до 70% хлора, углерода образуется больше, чем в случае ХПВХ с тем же содержанием: хлора. Этот факт связан, очевидно, с различием в строении хлорированных полимеров. При содержании хлора выше 70% из ХПЭ> и ХПВХ образуется лишь незначительное'количество углерода.
При термической деструкции хлорированного полипропилена (ХПП) в интервале температур 100—238 °С протекает только дегидрохлорирование полимера [103], а выше 250 °С имеет место» также разрыв связей С—С в основной полимерной цепи. Ниже сопоставлены данные по изменению содержания хлора и полимера при разложении в течение 5 ч при разных температурах:
Температура, °С 100 122 139 190 238 25В
Содержание отщепившегося хлористого водорода, % (масс.) ... 1,76 3,62 5,80 13,9 18,6 27,4
Доля разложившегося полимера, %
(масс.) ............................................................... 1,77 3,66 6,07 13,3 18,3 30,1
Энергия активации реакции дегидрохлорирования ХПП в интервале температур от 100 до 250 °С составляет 33,5 кДж/моль. Полагают [103, 104], что отщепление хлористого водорода происходит по ионному механизму, как и в случае ХПЭ. Имеются сведения о вторичной реакции связей С—С1 с двойными связями. Результатом этой реакции обычно является сшивание [105].
СН,
TOC \o "1-3" \h \z СН3 СНз I
| | -------- СН2—С - - ■ •
------------------ СН2—С------------- 1---------- СН=С--------------------- ► |
| СН-СС1------------
С1 |
СНз
Как и в случае ХПЭ, при нагревании ХПП существует определенный «предел разложения» полимера, который связан с образованием сшитых структур в результате межмолекулярного отщепления хлористого водорода. Чем выше температура нагревания,, тем выше предел разложения полимера. Этот факт связан с тем, что межмолекулярное отщепление хлористого водорода преобладает при сравнительно низких температурах. При повышении температуры все в большей степени проявляется отщепление хлори-
Рис. 2.3. Влияние содержания хлора в ХПП на степень его разложения в процессе нагревания при '120 °С в течение 200 мин.
Стого водорода от одной молекулы и «предел разложения» ХПП возрастает.
Термостабильность ХПП зависит также от содержания хлора [103]. Как и в случае ХПЭ, наиболее легко разлагается полимер с полностью замещенными атомами водорода у третичных углеродных атомов, содержащий около 45% хлора (рис. 2.3). При дальнейшем увеличении содержания хлора термостойкость полимера возрастает, так как замещение водорода на хлор в СН3- и СН2-группах уменьшает число подвижных атомов водорода.
При дегидрохлорировании хлорированного этиленпропиленово - го сополимера быстрее всего отрывается хлор от третичного атома углерода и водород от соседней >СН2-группы. С меньшей скоростью протекает отрыв хлора от вторичного атома углерода и водорода от —СНз-группы.
При термической деструкции в массе полностью хлорированного ПВХ наибольшее влияние на процесс оказывают молекулярная масса и степень упорядоченности ХПВХ [106]. Наличие структурных дефектов в полимерных цепях, таких, например, как третичные атомы углерода или концевые двойные связи, благоприятствуют деструкции. Наилучшей термостабильностью отличается хлорированный продукт, полученный из ПВХ с достаточно большой молекулярной массой и максимальной стереорегулярностью при условии непрерывного удаления хлористого водорода, образующегося при хлорировании. ХПВХ, имеющий длинные последовательности >СНС1-групп, термически более стабилен, чем ПВХ или поливинилиденхлорид, содержащий >СС12-группы [107]. Термическое разложение ХПВХ начинается с дегидрохлорирования, вслед за которым происходит конденсация по реакции Дильса—Альдера с образованием хлорсодержащих ароматических соединений поли - аценовой структуры [108, 109]. Вторичная конденсация (сшивание) плоских молекул приводит к образованию разупорядоченных кристаллитов графитоподобной структуры.
|
1 20 HO SO ВО Содержание хлора 6 ХПП;% (масс) |
Пиролизаты ХПВХ обладают отличной термостабильностью, хорошей электропроводностью, регулярной микропористостью и значительной поглотительной способностью. Их удельная поверхность достигает 15-105 м2/кг. Радиус элементарных пор отличает-
ся постоянством и составляет примерно 7 А, что позволяет использовать эти продукты в качестве носителей для катализаторов и молекулярных сит.
Химические процессы, протекающие при термоокислительном старении ХПВХ, различны для участков с разной плотностью упаковки [ПО]. Внутри более плотно упакованных участков полимера преобладают процессы сшивания, а в менее плотно упакованной части полимера — процессы деструкции, сопровождающиеся уменьшением молекулярной массы.
Термическое дегидрохлорирование ХПВХ в атмосфере азота и на воздухе на начальных стадиях протекает по свободнорадикаль - ному механизму і[111]. Спектры ЭПР указывают на присутствие макрорадикалов по крайней мере трех различных типов.
При пиролизе ХПВХ при температурах выше 400 °С в летучих продуктах кроме хлористого водорода обнаружены бензол и его хлорпроизводные [107, 44, 49]. Содержание моно-, ди - и трихлор - бензолов зависит от способа хлорирования ПВХ (в газовой фазе, в суспензии, в растворе) и с глубиной хлорирования возрастает. Выход бензола от условий хлорирования практически не зависит и с глубиной хлорирования уменьшается.
По данным Смита [112], термическое разложение ХСПЭ протекает в три стадии:
1. При низких температурах происходит отщепление и распад хлорсульфоновых групп с образованием диоксида серы и хлористого водорода. Молекулярный хлор при этом не выделяется, а в ИК-спектрах ХСПЭ после тепловой обработки уменьшается интенсивность поглощения хлорсульфоновых групп при 1375 и 1170 см-1 и появляется полоса в области 975 см-1, указывающая на образование транс-олефиновых двойных связей [113]:
----------------------- CH2-CHS02C1------------------------------------- СН=СН----------- + S02 + НС1
2. При средних температурах происходит дегидрохлорирование в целом таким же образом, как и в случае ХПЭ. В первую очередь отщепляются атомы хлора, находящиеся в р-положении к S02Cl-rpynnaM, затем вицинальные атомы хлора, атомы хлора при третичном атоме углерода и т. п. Такой подвижный хлор в ХСПЭ составляет около 22% всего хлора или около 6% массы полимера
3. При дальнейшем повышении температуры имеет место разрыв полимерных цепей.
|
49 |
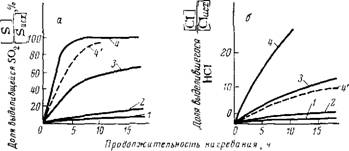
При 150 °С в виде S02 отщепляется примерно 70—80% серы, содержащейся в полимере, а при 180 °С за 5 ч из полимера удаляется практически вся связанная сера (рис. 2.4). Доля НС1, выделяющегося при термическом разложении ХСПЭ, значительно больше, чем в случае ХПЭ, что, очевидно, связано со свободно - радикальным механизмом процесса [94]. Отщепление диоксида серы при 150 °С протекает более интенсивно, чем отщепление хлористого водорода [94].
4—1263
|
Рис. 2.4. Кинетика выделения диоксида серы (а) и хлористого водорода (б) при нагревании ХСПЭ при 80 °С (/), 100°С (2), 150 °С (3) и 180 °С (4) на воздухе (1—4) и в атмосфере азота (4'). |
Разложение ХСПЭ активируется как перекисями, так и хлоридами цинка, железа, алюминия. Добавки до 0,5 масс. ч. обычных наполнителей (технический углерод, силикатные наполнители) на разложение полимера не влияют [112].
Удаление кислорода почти не отражается на скорости отщепления диоксида серы (см. рис. 2.4), в то время как скорость отщепления хлористого водорода в этих условиях снижается примерно в четыре раза [113]. Следовательно, кислород не влияет на де- сульфонирование ХСПЭ, но активирует его дегидрохлорирование.
Скорость окисления ХСПЭ почти на 1,5 порядка меньше, чем в случае полихлоропрена. По-видимому, это связано с большим различием в содержании двойных связей в этих полимерах.
Происходящие при нагревании химические изменения сопровождаются реакциями деструкции и сшивания с преобладанием последних. При 150 °С растворимость полимера снижается чрезвычайно быстро. Уменьшение растворимости наблюдается также и при длительном хранении ХСПЭ при комнатной температуре. Сшивание полимера может быть связано как с рекомбинацией полимерных радикалов двух соседних цепей, образовавшихся при отрыве атомов хлора и водорода, так и в результате развития окислительного процесса.
По данным Смита [114], при термическом разложении ХСПЭ образуются также циклические структуры. Удаление НС1 из системы приводит к уменьшению скорости окисления и сшивания полимера и других процессов, вызывающих изменение структуры. Поэтому для повышения термостабильности ХСПЭ рекомендуется вводить такие акцепторы хлористого водорода, как стеарат кадмия, фенолят натрия, эпоксидную смолу, оксид магния, а также «классические» ингибиторы окисления — фенил-р-нафтиламин, ди-
бутилдитиокарбамат никеля, 2,2'-метилен-бис (4-метил-6-грег-бу - тилфенол), триметилдигидрохинолин, ацетонанил.
При исследовании термодеструкции хлоркаучука аллопрен, содержащего 64,5% хлора, установлено, что 95% хлора теряется в виде хлористого водорода при нагревании до 400 °С. Кроме хлористого водорода образуются-метан, этилен, оксиды углерода и водород. Уже при уменьшении массы полимера на 1 % наблюдается его окрашивание, указывающее на образование системы сопряженных двойных связей в цепи. Уменьшение растворимости свидетельствует об образовании сшитых структур.
|
|
|
,С1 |
|
В |
|
С |
Согласно термограммам, на 2 звена изопрена легко теряется 5 молекул хлористого водорода. По мнению авторов работы ;[64], этот факт не соответствует предполагаемой циклической структуре хлорированного каучука. Поэтому они предлагают чередующуюся структуру исходного хлоркаучука (Л), которая по мере дегидрохлорирования переходит в структуру (В) с системой сопряженных двойных связей, теряющую НС1 при дальнейшем повышении температуры и переходящей в структуру (С).
|
А |
С1
Во влажной среде хлоркаучук отщепляет хлористый водород уже при 70 °С [115]. Процесс термодеструкции хлорированного полибутадиена (ХПБ) и хлорированных линейных сополимеров бутадиена со стиролом протекает в две стадии [116]. На первой стадии происходит отщепление атомов хлора в виде хлористого водорода. Чем выше содержание хлора в хлорированном полимере, тем ниже начальная температура разложения на первой стадии. Вторая стадия, обусловленная деструкцией основных углеводородных цепей, начинается при температуре 420 °С независимо от содержания хлора в исходных образцах.
|
51 |
При пиролизе хлорированных полибутадиенов образуются алифатические соединения, винилиденхлорид, бензол, толуол, ксилол, этилбензол, стирол, хлорбензол, дихлорбензол, изомерные три - и тетрахлорбензолы, нафталин и некоторые другие соединения [117, 118]. С увеличением степени хлорирования, определяемой как число атомов хлора, приходящихся на 4 атома углерода, доля алифатических соединений в продуктах пиролиза снижается, а доля ароматических соединений возрастает [118].
4*
|
|
|
2 |
|
2 |
|
Продолжительность нагревания, ч |
|
О |
|
U |
Рис. 2.5. Кинетика дегидрохлорирова
Ния нестабилизированного гидрохло-
Рированного СКИ-3 в токе воздуха при 70 °С (/), 80 °С (2), 90 °С (3), 100 °С (4) и ПО °С (5).
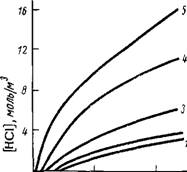
При тепловом воздействии на гидрохлорированный каучук, как и на любой другой хлорсодержащий полимер, отщепляется хлористый водород (рис. 2.5), а также протекают окислительные процессы вследствие наличия в полимере небольшого количества двойных связей (до 10% от исходного) [119]. В случае гидрохлорирован - ногс) синтетического изопренового каучука марки СКИ-3 отщепление хлористого водорода происходит уже при 60 °С. С увеличением температуры от 70 до 100 °С индукционный период выделения НС1 резко уменьшается. Энергия активации процесса дегидрохлорирования составляет 79,5 кДж/моль. Сшивание гидрохлориро - ванного каучука при нагревании происходит только при 120 °С. Процесс дегидрохлорирования интенсивнее протекает на воздухе. Этот факт согласуется с данными по влиянию кислорода на процесс дегидрохлорирования ПВХ, свидетельствующими об интенсификации процесса дегидрохлорирования этих полимеров кислородом или продуктами окисления.
Введение сорбиновой кислоты и зпоксидированного соевого масла в гидрохлорированный СКИ-3 увеличивает индукционный период отщепления хлористого водорода и замедляет тепловое старение полимера.
Состав продуктов пиролиза хлорированного полистирола зависит от степени хлорирования [120]. При пиролизе полистирола при 455 °С образуется в основном стирол. При увеличении содержания хлора в продуктах пиролиза появляются бензол, толуол и хлорбензол, а выход стирола уменьшается.