ГОРЕНИЕ И ОКИСЛЕНИЕ
|/ак идёт горение в примусе и керосинке. Наиболее яр - ким примером химических реакций, идущих при участии кислорода воздуха, является горение — тот процесс, с помощью которого мы получаем тепло и свет. Какое бы
Топливо мы ни сжигали — уголь или дрова, керосин или бензии, спирт или светильный газ — главная химическая реакция при горении их одна и та же: углерод и водород, входящие в состав молекул топлива, соединяются с кислородом воздуха и образуют углекислоту и воду. Общеизвестно, что керосинка даёт жёлтое, светящее пламя, а примус — голубое или фиолетовое, почти не светящее пламя. В обоих случаях топливо одно и то же — керосин. Почему же это происходит?
Керосин — это смесь различных углеводородов, соединений углерода с водородом. Для примера возьмём один из углеводородов керосина — нонан, имеющий состав СуНго. При горении нонан соединяется с кислородом и образуются углекислота и вода. Начальное и конечное состояния этого процесса можно изобразить химическим уравнением:
С9Н20 + 1402 — 9 С02 + 10 Н20 (пар) + теплота,
Написав такое уравнение, мы допустили, что углеводород сгорает полностью. Это и происходит в исправном примусе. В примусе керосин поступает в горелку под давлением. Испаряясь в нагретой горелке й вырываясь сильной струёй через форсунку, керосин хорошо перемешивается с воздухом. Смесь получается настолько богатой кислородом, что керосин сгорает полностью. Кроме того, пары керосина, проходя через раскалённую часть горелки, не только нагреваются, но и химически изменяются: сложные молекулы углеводородов при температуре 400—500 градусов распадаются на более простые, сгорающие легче. Этот распад обычно сопровождается выделением небольшого количества твёрдого углерода — кокса; кокс постепенно засоряет горелку, поэтому время от времени её нужно «прожигать».
Мы знаем, что керосинка всегда даёт копоть или сажу, то-есть очень мелкие частицы угля. Значит, в керосинке идёт неполное сгорание керосина. Керосин испаряется с поверхности фитиля и только тут смешивается с воздухом. Количество воздуха внутри пламени оказывается недостаточным. Поэтому и образуются мельчайшие раскалённые частички угля, от которых ярко светится пламя.
Почему дрова и каменный уголь, сгорая, дают пламя, а древесный уголь горит без пламени? Различные виды твёрдого топлива сгорают по-разному: дрова и каменный
Уголь образуют при горении пламя, а древесный уголь пламени не даёт. Какова же разница между ними?
Древесная масса и каменный уголь — смеси сложных веществ, богатых углеродом. Они содержат также кислород и водород. При нагревании дров и каменного угля сложные вещества расщепляются на более простые и в то же время более летучие вещества. Эти вещества, сгорая, и образуют пламя. Дрова дают большее пламя, чем каменный уголь: они образуют больше летучих веществ.
Древесный же уголь получают неполным сожжением дерева. Хороший древесный уголь — это почти чистый углерод; к нему примешаны только минеральные - вещества, дающие после сгорания золу. Поэтому древесный уголь не образует летучих продуктов и горит без пламени.
Все жидкие вещества и горючие газы, разлагающиеся при высокой температуре с выделением летучих продуктов, при горении образуют пламя. Твёрдые вещества, не способные давать летучие продукты разложения, горят без пламени. При неполном горении всегда образуется дым, состоящий из твёрдых частичек несгоревшего угля и газообразных продуктов горения — окиси углерода, углекислоты, водяных паров.
Почему керосиновая лампа коптит, а рано закрытая печка даёт угар. Мы можем управлять химическими реакциями, заставлять их протекать нужным нам образом. Примеры этому легко найти в нашем быту.
Керосиновая лампа стала коптить. Ясно, что если выделяется копоть, горение идёт не полно. Мы убавили фитиль — копоть перестала образовываться. Почему? Потому, что мы изменили условия горения. Убавив фитиль, мы уменьшили скорость испарения керосина. Количество же поступающего в лампу воздуха осталось прежним. Поэтому горение стало более полным.
А почему рано закрытая печь даёт угар? — Потому, что нарушается режим горения и вместо одной реакции идёт другая. При недостатке воздуха, поступающего в печь, горение идёт не до конца: вместо углекислоты, СО2, образуется окись углерода или, как её иначе называют, угарный газ СО. Угарный газ невидим, так как, в отличие от дыма, он не содержит твёрдых частиц. Он очень ядовит.
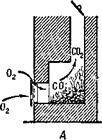
Окись углерода образуется и при открытой трубе, но так как приток кислорода в печь достаточный, она сгорает и образует углекислоту, уходящую в трубу
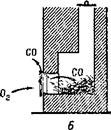
(рис. 7, А). При закрытой же трубе продукты горения выходят через печную дверцу в помещение. Если в печи осталось слишком много раскаленного угля, то притока воздуха хватает только на образование окиси углерода и в комнате появляется угар (рис. 7, £).
|
Рис. 7. А нормальное горение при открытой трубе; Б — образование угарного газа при большом количестве угля и закрытой трубе. |
![]() Эти простые примеры показывают, что, изменяя соотношения между количествами реагирующих веществ, можно управлять химической реакцией.
Эти простые примеры показывают, что, изменяя соотношения между количествами реагирующих веществ, можно управлять химической реакцией.
Чем отличается горение в печи от горения в живом организме? В печке сгорает топливо. Для организма топливом служит пища. И в организме и в печке углеродистые вещества сгорают, превращаясь в углекислоту и в воду.
В этом — сходство.
Разница же состоит в том, что в печке горение происходит при высокой температуре, а в живом организме — при низкой и значительно медленнее.
В печах, особенно промышленного типа — доменных, стекольных и др., температура превышает 1000 градусов. Тело человека имеет в среднем температуру 36,6 градуса. Химики установили, что повышение температуры на 10 градусов почти удваивает скорость реакции. Значит, горение в печи идёт во много раз быстрее, чем в организме.
Однако дело не только в этом. При высокой температуре реакция может протекать совсем иным путём. При 1000 градусов некоторая часть молекул кислорода (около 1,5 процента) распадается на атомы: 02^20. Значит, горение при высоких температурах можно объяснить тем, что с топливом вступают в реакцию свободные атомы кислорода, число которых по мере их расходования пополняется путём распада, диссоциации, новых молекул кислорода. Но в живых организмах молекулы кислорода не могут распадаться на атомы. Каким же образом происходит горение в организмах?
Общую теорию таких процессов разработал в конце прошлого столетия русский академик А. Н. Бах. Рядом опытов с простыми углеродистыми соединениями и с веществами, содержащимися в животных и растительных организмах, А. Н. Бах доказал, что при обыкновенной температуре к молекулам этих веществ присоединяются целые молекулы кислорода. При этом образуются такие соединения, которые способны окислять другие вещества так же легко, как и атомарный кислород. Эти соединения, называемые перекисями, являются промежуточными продуктами окисления.
Как же построены молекулы перекисей и какими свойствами они обладают?
Познакомимся сначала с простейшей перекисью — перекисью водорода Н202. Строение её изображается формулой Н—О—О—Н. Перекись водорода неустойчива, при хранении она медленно разлагается на воду и кислород: Н202=Н20+0. Значит, один из атомов кислорода в перекиси «подвижен»,«активен». Поэтому перекись водорода является хорошим окислителем.
В организмах животных и растений перекиси водорода нет, но с группой атомов —О—О—, характерной для перекисей, могут быть связаны атомы углерода органических соединений. Такие перекиси называют перекисями органических соединений, и они обнаружены в живых организмах. Им-то и принадлежит та исключительная роль в процессах медленного окисления в организме, на которую указал А. Н. Бах.
В организмах животных окисление пищевых материалов происходит в крови. В красных кровяных тельцах находится сложное белковое вещество, гемоглобин, окрашивающий кровь в красный цвет. В состав гемоглобина входит железо, придающее ему способность соединяться с кислородом. При дыхании гемоглобин окисляется (в лёгких) и превращается в оксигемоглобин. Сам оксигемоглобин не является настоящей перекисью, так как он отдаёт весь присоединённый кислород, а не половину, как это делают истинные перекиси. Но он легко превращает в перекиси некоторые пищевые вещества, попадающие в кровь, отдавая им свой кислород, и вновь переходит в гемоглобин. Кислород расходуется на окисление пищевых материалов, на выработку энергии, необходимой для поддержания жизни.
Есть ли разница между горением и окислением? По
Сходству с горением топлива естественно считать горением все химические процессы, протекающие с выделением тепла и света. Слово «горение» описывает внешние признаки и только одну сторону химической реакции — превращение химической энергии в тепловую и световую.
Но для химика описания только этой стороны реакции недостаточно. Он хочет знать, что происходит с каждым из атомов, входящих в состав вещества, как эти атомы изменяются во время реакции. И вот если с этой стороны посмотреть на реакции, происходящие при горении, то оказывается, что всегда какой-либо из атомов сгорающей молекулы увеличивает свою положительную валентность. Например, при сгорании СО в С02 положительная валентность углерода возрастает с 2 до 4, так как атом углерода оказывается связанным уже не с одним, а с двумя атомами кислорода. Углерод при горении окисляется. Поэтому мы называем окислением реакцию, в которой како й-л ибо элемент увеличивает свою положительную валентность.
А что делается при окислении с самим окисляющим веществом? В нашем примере окисляющим веществом служит кислород воздуха, простое вещество, которому мы условились (стр. 22) приписывать до реакции нулевую валентность. Входя в состав молекулы СОг, атом кислорода становится двухвалентным отрицательным. Реакцию, в которой атом каког о-л ибо элемента увеличивает свою отрицательную валентность, называют восстановлением. Следовательно, кислород воздуха, окисляя углерод СО, сам при этом восстанавливается. Из нашею примера мы видим, чго окисление и восстановление—два процесса - близнеца: они всегда сопровождают друг друга и невозможны один без другого.
Всякое ли окисление протекает как горение? Железо, окисляясь, ржавеет. Но разве мы можем сказать, что при этом железо горит. Конечно, нет. Разве в живом организме окисление сопровождается выделением света? — Нет, происходит только выделение тепла. Значит, окисление не всегда сопровождается горением. Но, как правило, все процессы горения являются окислением.
Могут ли горение и окисление происходить без кислорода? Окисляемый атом вовсе не обязательно должен отдавать свои валентные электроны именно атому кислорода. Очень легко это происходит и с другими элементами. Вернёмся к опыту, описанному на стр. 12. Железо, которое мы погружаем в раствор медного купороса,— простое вещество с нулевой валентностью. Железо активнее меди и вытесняет из раствора медь. В этой реакции вытеснения атом железа отдаёт атому меди 2 электрона и сам приобретает валентность + 2. Значит, и здесь железо окисляется! Атом же меди, забрав у атома железа 2 электрона, изменяет валентность с + 2 до нуля, восстанавливается.
Точно так же можно рассмотреть и реакцию между серой и железом (стр. 9). Оба они — простые вещества с нулевой валентностью. После реакции валентность железа + 2, а серы — 2, следовательно, железо окислилось, а сера восстановилась. Вспомним, что реакция между серой и железом сопровождается выделением тепла и света, то-есть горением, хотя кислород в ней и не участвует. Значит, не только окисление, но и горение может происходить без участия кислорода.
Почему железо ржавеет, а золото и серебро — нет? Из всех металлов наиболее широко используется в технике и в быту железо. Большим недостатком железа служит то, что оно легко соединяется с кислородом воздуха и водой, ржавеет. Так как ржавчина непрочно связана с поверхностью металла, она легко стирается, распыляется, приводя к большим потерям металла. Ржавление и подобные ему процессы разрушения металлов называют кор - роз и е й.
Подсчитано, что в результате коррозии во всём мире ежегодно теряется больше 30 миллионов тонн металлов. Это настоящее бедствие. Поэтому химики и физики упорно работают над вопросами борьбы с коррозией.
Ржавчина — это смесь водной закиси железа Ре (ОН)г, окиси железа Ре203, окалины Ре304 и некоторых других веществ. То, что железо окисляется уже при низкой температуре, объясняется его значительной химической активностью.
Другое дело — серебро, золото, платина и другие благородные металлы. Их активность очень мала. Ядра их атомов цепко удерживают валентные электроны и поэтому трудно окисляются. Соединения этих металлов непрочны, они легко распадаются с выделением свободных металлов. Хлористое и бромистое серебро, например, разлагается на свету. На этой реакции основана вся фотокинопромышленность [23]).
Неустойчивость солей серебра можно доказать интересным опытом. Подогреем в стаканчике нашатырный спирт (это — водный раствор аммиака) до 50—60 градусов и нальём в него при перемешивании несколько капель раствора ляписа (азотнокислого серебра). Затем добавим несколько капель формалина или раствора виноградного сахара — глюкозы. Через несколько минут на стенках стаканчика образуется серебряное зеркало, а в растворе появится тёмная муть. Формалин или глюкоза восстанавливают серебро из его соли. Эта реакция используется для изготовления зеркал.
* *
*
Итак, мы познакомились с составом воздуха и отметили особую роль кислорода в природе, которую ему обеспечивает его большая химическая активность. Но очень многие реакции с участием кислорода шли бы совсем иначе, а некоторые — не были бы даже возможны, если бы на помощь кислороду при его воздействии на другие вещества не приходила вода. Вода, подобно кислороду, играет в природе громадную роль и обладает многими очень важными свойствами. Их мы и рассмотрим в следующем разделе.