Коррекция на растворимый кремнезем
В методике Сиреа исследуемый образец кремнезема, находящийся в 150 мл раствора, содержащего 30 г NaCl при рН 4,0Г титруют вначале 0,1 н. раствором NaOH.
В качестве источника растворимого кремнезема используют 0,1 %-ный раствор БіОг, полученный из Na2Si03-9H20, в 0,1 и. NaOH. Различные порции (х мл) этого раствора добавляли при быстром перемешивании к (135 — х) мл воды, содержащей 1,25 мл 4 и. НС1. Затем добавляли 40 г NaCl и, как можно быстрее повышали рН до 3, используя 1,0 и. раствор NaOH, и до 4, используя 0,1 и. раствор NaOH.
Эту смесь сразу же после ее получения быстро титровали 0,1 н. NaOH до рН 9,0 и замеряли объем. Образцы последнего раствора анализировали затем молибдатным методом для того, чтобы определить, сколько еще кремнезема оставалось в виде мономера и димера (продолжительность реакции 2—3 мин). Когда с самого начала добавлялось не более чем 0,02 % мономера, то, по существу, система не претерпевала изменений, т. е. мономер не полимеризовался. В качестве контрольных опытов титровали объем х мл 0,1 н. NaOH, в котором кремнезем отсутствовал. На титрование контрольного раствора затрачивалось 0,3 мл.
В случае проведения опытов с образцами исследуемого кремнезема в интервале 3,8—45 мг Si02 наблюдаемая величина объема, требуемого для достижения рН 9, оказалась равной 0,135±0,005 мл на 1 мг 0,1 н. раствора NaOH. Чтобы превратить мономер Si(OH)4 полностью в HSiO~, потребовалось бы
0,166 мл/мг. Следовательно, 81,3% растворимого кремнезема находится при рН 9 в растворе NaCl в ионизированном состоянии. (Из этих данных можно подсчитать, что в 3,4 и. NaCl значение р/Са Для мономера Si (ОН) 4 равно 8,37). В таком случае для образцов, титруемых с целью определения удельной поверхности, на каждые 0,01 % растворимого кремнезема (15 мг) в 150 мл титруемой смеси должна вноситься поправка, равная —2,08 мл 0,1 н. раствора NaOH.
В качестве примера, когда подобная коррекция важна, рассмотрим титрование для определения поверхности золя с размером частиц 4 нм, содержащего в суспензии 5 % Si02 при рН 10. Золь выдерживался до тех пор, пока общее содержание растворимого кремнезема (0,0154%) и кремнезема в ионной форме не составило 0,0439 %. Обычно для титрования используется 1,5 г Si02. В таком случае требуется 30 г золя при содержании в нем 0,0439 % растворимого кремнезема. Для титрования золь разбавляется до 150 мл, что приводит к концентрации мономера 0,0088 %. Тогда коррекция на растворимый кремнезем при титровании равна 1,83 мл 0,1 и. раствора NaOH. Общий объем при титровании составляет 25,9 мл, что должно давать значение удельной поверхности частиц золя без поправки 734 м2/г. После вычитания поправки на растворимый кремнезем удельная поверхность коллоидного кремнезема оказывается равной 686 м2/г, т. е. относительная разность значений составляет •6,5%.
Мефферт и Лангенфельд [86а] автоматизировали определение удельной поверхности кремнезема по методу Сирса. Они использовали насыщенный раствор хлорида натрия, содержащий суспендированные мелкие кристаллы соли. Такие кристаллы, по-видимому, способствуют удалению кремнезема с поверхности стеклянного электрода рН-метра. В противном случае кремнезем осаждался бы и постепенно изменял характеристики электрода. В работе использовался автоматический титратор, прЦ - чем рН в любой момент времени поддерживалось не выше 9. Для расчета применялась формула '
A = K(Vt-Vb)
А — удельная поверхность, м2/г;
У г— объем 0,1 н. раствора NaOH, требуемый для 1,5 г S1O2 в интервале рН 4,0—9,0, мл;
Уь— объем, затрачиваемый на титрование контрольного опыта, мл.
Мефферт нашел значение К = 25,2 при использовании 200 мл насыщенного раствора NaCl. Это значение сравнимо с коэффициентом /( = 26,5, применяемым при работе по методу Сирса, когда используется 150 мл раствора NaCl с концентрацией 200 г/л. Уь составляет 1,3 мл при работе по методу Мефферта и Лангенфельда и 0,75 мл — по методу Сирса.
Коагуляция кремнезема добавлением желатина и соли
По мере развития процесса полимеризации первичные частицы поликремневой кислоты начинают агрегировать в цепочки и в пространственные сетки небольшого размера. Можно проследить за увеличением размера полимерного кремнезема, если использовать эмпирический метод, заключающийся в осаждении комплекса кремневой кислоты с определенным типом «пищевого желатина» без специфических вкусовых добавок [866]. Этот метод может быть стандартизован для выбранного золя кремнезема измерением молекулярной массы по температуре замерзания.
Метод основан на том, что в интервале рН 1,5—3,5 сам желатин без введения в систему поликремневой кислоты коагулирует из разбавленного раствора при концентрации хлорида натрия в этом растворе выше некоторой критической величины. Эта. критическая концентрация соли понижается с ростом молекулярной массы желатина. В присутствии в системе поликремневой кислоты происходит образование водородных связей и по-
Перечных связей между кремнеземом и желатином. Это в свою очередь приводит к повышению молекулярной массы последнего. В таком случае для осаждения желатина требуется более - низкая концентрация соли.
Однако по мере увеличения молекулярной массы поликремневой кислоты вскоре достигается точка, когда в присутствии желатина в системе происходит осаждение даже без введения в нее соли. Для увеличения интервала титрования используется также конкурентоспособный по отношению к соли агент или вещество, имеющее низкую молекулярную массу и способное образовывать водородные связи. В частности, для этой цели находит применение диэтиловый эфир диэтиленгликоля (ранее известный как диэтилкарбитол или ДЭК). Как показано на рис. 3.11,.
При повышении концентрации ДЭК требуется увеличение содержания соли в системе, для того чтобы вызвать осаждение желатина.
Поскольку в процессе полимеризации кремневой кислоты с ростом содержания желатина наблюдается тенденция к осаждению кремневой кислоты, то все эксперименты обычно выполняются вблизи рН 2, т. е. когда полимеризация наиболее замедленна. Характеристики осаждения не будут зависеть от величины рН в области 1,5—3,5 и будут относительно независимы от концентраций кремневой кислоты и желатина, если выбранный золь подвергается процессу старения в течение заданного времени, а концентрациия электролита остается неизменной. Если и другие факторы поддерживаются постоянными, то осаждение происходит только в том случае, когда концентрация соли превышает некоторое критическое значение. Если концентрация соли постоянна, то растворение образовавшегося осадка (или торможение процесса осаждения) будет наблюдаться, когда концентрация агента, способствующего образованию водородных связей, превышает определенный критический уровень. Коагулирующее действие соли на комплекс желатин— кремневая кислота, следовательно, компенсируется растворяющим действием такого агента.
Обычное поведение подобной системы приведено на примере, показанном на рис. 3.11. На этом рисунке графически представлены возможные варианты, возникающие из-за изменений концентраций хлорида натрия и ДЭК, а также возраста золя кремневой кислоты в процессе его старения. Образование осадка исследовалось в системе желатин—кремневая кислота, содержащей 0,5—2 % желатина и 1—5 % Si02 при рН 2,5 и 27°С. Каждая из линий, построенная для отдельного золя, является граничной, выше которой формируется осадок. Отметим, что желатин в отсутствие поликремневой кислоты высаливается из воды при рН 3, если концентрация NaCl превышает примерно 8 г/100 мл. Однако в присутствии ДЭК, чтобы вызвать подобное осаждение желатина, требуется, как это показано на рис. 3.11 (линия Л), более высокая концентрация соли. Для золей кремневой кислоты с большими периодами старения получены линии В—G. Экстраполяция этих линий до пересечения с осью абсцисс, на которой отложены значения концентраций ДЭК, дает удобную шкалу, позволяющую охарактеризоватп состояние полимеризации поликремневой кислоты.
Перед тем как обсудить возможные эффекты, связанные с присутствием в системе кремневой кислоты, необходимо рассмотреть поведение чистого желатина. Выдвигается гипотеза о том, что молекулы желатина в растворе окружены гидратной оболочкой, состоящей из молекулы воды, удерживающихся, вероятно, водородными связями. По мере того как к системе добавляется соль, вода постепенно удаляется из гидратных оболочек молекул желатина, а число дегидратированных мест возрастает. Благодаря наличию дегидратированных мест молекулы желатина связываются друг с другом, формируя сетку геля желатина с поперечными связями, который и представляет собой осадок. Для коротких молекул желатина с более низкой молекулярной массой требуется, таким образом, большее число поперечных связей по сравнению с молекулами поликремневой кислоты и, следовательно, более высокая концентрация соли для процесса коагуляции. Растворяющий эффект агента, образующего водородные связи, можно проследить следующим образом. Когда, например, в системе присутствует ДЭК, то добавление соли вызывает, как и прежде, частичное удаление воды из гидратной оболочки, окружающей молекулы желатина. Однако дегидратированные места немедленно покрываются молекулами ДЭК в результате их адсорбции, поэтому предотвращается процесс образования поперечных связей, который мог бы иметь место благодаря возникновению водородных связей на таких дегидратированных местах.
В присутствии кремнезема происходит следующее. Молекулы поликремневой кислоты могут адсорбировать, или, иначе говоря, удерживать вместе несколько молекул желатина благодаря образованию водородных связей. Кроме того, большие по размеру молекулы поликремневой кислоты могут адсорбировать большее число молекул желатина и, таким образом, формировать больший единичный комплекс. Однако этот большой единичный комплекс ведет себя точно так же, как и одиночная молекула желатина, но с большей молекулярной массой, требуя лишь меньшего количества соли для осаждения. Следовательно, механизм агрегации комплекса желатин—кремнезем является тем же самым, что и механизм агрегации одних только молекул желатина, что подтверждается параллельным наклоном линий на рис. 3.11.
Методика титрования. Образец раствора кремневой кислоты объемом 10 см3, свободный от органических растворителей и содержащий 4—6 % Si02 при рН 1,5—2,5, отмеривают пипеткой в пробирку размером 2,5-20- см. К этому образцу добавляют 2—3 см3 водного раствора диэтилового эфира диэтиленгликоля (диэтилкарбитола) при его содержании 500 г/л, после чего добавлением кислоты НС1 доводят рН до 2,5. К смеси добавляют 5 см3 2%-ного раствора высококачественного пищевого желатина. Чтобы предотвратить образование осадка в момент добавления раствора желатина, используют нужное количество раствора диэтилкарбитола. Полученную смесь затем титруют стандартным раствором NaCl с содержанием 300 г/л (предварительно добавив НС1 до рН 2,5) до тех пор, пока весь раствор не станет мутным. Это можно наблюдать, удерживая пробирку на уровне подсвеченного сзади лампой в 60 Вт круглого отверстия диаметром 6 мм. Момент помутнения смеси отмечается довольно произвольно, когда контур освещен-
ного отверстия, просматриваемый через пробирку, становится нечетким. Такой относительно грубый метод вполне удовлетворителен, поскольку конец титрования отмечается достаточно отчетливо: переход от совершенно прозрачной жидкости до крайне мутного состояния осуществляется в пределах небольшого объема (0,2—0,3 см3). После добавления каждой порции солевого раствора, перед тем как наблюдать помутнение, смесь энергично встряхивают в течение примерно 10 с. Помутневший раствор затем снова просветляется при добавлении новой порции диэтилкарбитола объемом 1—2 см3.
После этого повторяют процедуру добавления раствора NaCl с определением конца титрования по помутнению смеси. В каждой точке конца титрования подсчитывают общие концентрации (в г на 100 см3) NaCl и диэтилкар - титола с учетом суммарного объема смеси. Полученные значения представлены на рис. 3.11.
Положение прямых линий, полученных для образцов золей ео всевозрастающими молекулярными массами, постепенно смещается вправо. Это означает, что для предотвращения осаждения требуется вводить все более высокие концентрации диэтилкарбитола. Таким образом, отсекаемые прямыми линиями отрезки на оси абсцисс (указывающей концентрацию диэтилкарбитола), представляют собой показатели относительной величины молекулярной массы кремневой кислоты.
Для того чтобы иметь произвольную шкалу с положительными значениями определяемых величин, выбирается функция X в виде
Х = 6 + С
Где С — отрезок, отсекаемый на оси абсцисс. Такое «Х-значение» изменяется от нуля для растворов желатина без кремнезема (или для золей кремневой кислоты с чрезвычайно низкими молекулярными массами) и до 11 —12 для растворов кремневой кислоты, которые полимеризовались до геля и, следовательно, представляют собой вещество с высокой молекулярной массой.
|
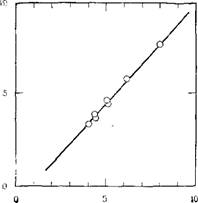
,, j. X — значение Рис. 3.12. Зависимость степени полимеризации N, определяемой криоскопиче - ски, от «Х-зиачения». |
На рис. 3.12 показано соотношение между «Z-значением» и степенью полимеризации по мере протекания процесса полимеризации кремневой кислоты, полученной добавлением раствора силиката натрия с отношением 3,25 к энергично перемешиваемому раствору кислоты до достижения рН~2. В действи
тельности данный метод показывает степень агрегации дискретных частиц кремнезема. В рассматриваемом примере исходные дискретные частицы поликремневой кислоты имели диаметр около 2 нм. Если проводить исследование частиц начиная с размера 5 нм, прослеживая за процессом агрегации, по мере того как золь превращается в гель, то приведенная методика титрования даст такую же серию линий, как и на рис. 3.11, но отличающуюся наклоном.