ВЕЛИКИЙ ЗАКОН ПРИРОДЫ
[]режде всего познакомимся со строением атомов химических элементов. В этом нам поможет знаменитый периодический закон Д. И. Менделеева. О чем говорит этот великий закон природы?
Как известно, все химические элементы размещаются в периодической системе элементов, которая была создана Д. И. Менделеевым.
Каждому элементу в таблице Менделеева отведено определенное место — клетка. Клетки пронумерованы; таким образом, всякий элемент имеет свой порядковый номер. Водород имеет порядковый номер 1, кислород — 8, медь — 29, ртуть — 80 и т. д.
Как же распределены элементы по отдельным клеткам?
В то время, когда Д. И. Менделеев работал над своей системой (60-е годы прошлого века), ученые почти ничего не знали о природе атомов. Было известно только одно — атомы отличаются друг от друга своими массами, или, что то же, атомными весами.
Напомним, что в химии принято пользоваться не истинным весом атома, а его относительным весом. Для этого вес какого-нибудь атома или определенную часть его веса считают условно за единицу. Вначале за единицу веса был принят вес одного атома водорода, а затем (с 1900 года) нашли, что более удобна в качестве единицы одна шестнадцатая часть веса атома кислорода. Вес атома любого элемента,
|
Перио Ды |
ГРУППЫ |
|||||
|
I |
II |
III |
IV |
V |
||
|
1 |
Н 1 Водород 1,008 |
|||||
|
2 |
И 3 Литий 6,9 |
Ве 4 Бериллий 9,0 |
5 В Бор 10,8 |
6 С Углерод 12 |
7 N Азот 14 |
|
|
3 |
Ыа 11 Натрий 23 |
Мд 12 Магний 24,3 |
13 А1 Алюминий 27 |
14 ві Иремний 28,1 |
15 Р Фосфор 31 |
|
|
4 |
К 19 Налий 39,1 |
Са 20 Нальций 40,1 |
Эс 21 Снандий 45,1 |
Ті 22 Титан 47,9 |
V 23 Ванадий 51 |
|
|
29 Си Медь 63,6 |
Зо гп Цинк 65,4 |
31 Оа. Галлий 69,7 |
32 Ое Германий 72,6 |
33 Ав Мышьяк 74,9 |
||
|
5 |
37 Рубидий 85,5 |
8г 38 Стронций 87,6 |
У 39 Иттрий 88,9 |
Гг 40 Цирконий 91,2 |
ГМЬ 41 Ниобий 92,9 |
|
|
47 Ад Серебро 107,9 |
48 Сс1 Иадмий 112,4 |
49 1п Индий 114,8 |
50 8п Олово 118,7 |
51 8Ь Сурьма 121,8 |
||
|
6 |
Се 55 Цезий 132,9 |
Ва 56 Барий 137,4 |
Ьа 57-71 * Лантан 138,9 |
Ні 72 Гафний 178,6 |
Та 73 Тантал 180,9 |
|
|
79 Аи Золото 197,2 |
80 Нд Ртуть 200,6 |
81 Т1 Таллий 204,4 |
82 РЬ Свинец 207,2 |
83 В! Висмут 209 |
||
|
7 |
Fr 87 Франций 233 |
Ка 88 Радий 226 |
Ас 89 Антиний 227 |
ТЬ 90 Торий 232,1 |
Ра 91 Протактиний 231 |
|
|
“Редкоземельные |
||||||
|
Се 58 Церий 140,1 |
Рг 59 Празеодим 140,9 |
N01 60 Неодим 144,3 |
Рт 61 Прометий |
Эт 62 Самарий 150,4 |
||
|
ТЬ 65 Тербий 159,2 |
Оу 66 Диспрозий 162,5 |
Но 67 Гольмий 164,9 |
Ег 68 Эрбий 167,2 |
Ти 69 Тулий 169,4 |
||
|
** Трансурановые |
||||||
|
Мр 93 Нептуний 237 |
Ри 94 Плутоний 239 |
Ат 95 Америций 241 |
Ст 96 Нюрий 242 |
Вк 97 Берклий 243 |
|
ЭЛЕМЕНТОВ |
||||||
|
VI |
VII |
VIII |
О |
|||
|
Не 2 Гелий 4 |
||||||
|
8 О Кислород 16 |
9 F Фтор 19 |
Ne 10 Неон 20,2 |
||||
|
16 в Сера 32,1 |
17 С! Хлор 35,5 |
Аг 18 Аргон 39,9 |
||||
|
Сг 24 Хром 52 |
Мп 25 Марганец 54,9 |
Fe 26 Железо 55,9 |
Со 27 Кобальт 58,9 |
Ni 28 Нинель 58,7 |
||
|
34 8е Селен 79 |
35 Вг Бром 79,9 |
Кг 36 Криптон 83,7 |
||||
|
Мо 42 Молибден 96 |
Тс 43 Технеций |
Ru 44 Рутений 101,7 |
Rh 45 Родий 102,9 |
Pd 46 Палладий 106,7 |
||
|
52 Те Теллур 127,6 |
53 I Иод 126,9 |
Хе 54 Ксенон 131,3 |
||||
|
А/ 74 Вольфрам 183,9 |
Re 75 Рений 186,3 |
Os 76 Осмий 190,2 |
Lr 77 Иридий 193,1 |
Pt 78 Платина 195,2 |
||
|
84 Ро Полоний 210 |
85 At Ас тати н 211 |
Rn 8G Радон 222 |
||||
|
И 92** Уран 238,1 |
||||||
|
Элементы |
||||||
|
Eu 63 Европий 152 |
Gd 64 Гадолиний 156,9 |
|||||
|
Yb 70 Иттербий 173 |
Lu 71 Лютеций 175 |
|||||
|
Элементы |
||||||
|
Cf 98 Калифорний 246 |
Е 99 Эйнштейний 253 |
Fm 100 Фермий 256 |
Mv 101 Менделевий 256 |
102 Нобелий |
Выраженный в таких условных единицах, и называют его атомным весом. При этом атомный вес кислорода равен точно 16, а веса других элементов в большинстве случаев представляют дробные числа: для водорода— 1,0080, хлора — 35,457, железа — 55,85, ртути — 200,61, урана — 238,07 и т. д.
Располагая все известные элементы (их тогда было 63) в порядке возрастания атомных весов, Д. И. Менделеев заметил, что свойства одних элементов более или менее заметно периодически повторяются у других элементов. Периодическая повторяемость свойств различных химических элементов и есть один из важнейших законов природы. Менделеев открыл его и назвал периодическим законом, а естественную последовательность элементов — периодической системой элементов.
Составляя свою таблицу, Д. И. Менделеев не придавал атомным весам решающего значения. При определении места в таблице он руководствовался всей совокупностью свойств элемента. В ряде случаев он не согласился с принятыми в то время значениями атомных весов и смело исправил их у отдельных элементов.
В некоторых местах, где закономерность явно нарушалась, великий химик оставил клетки пустыми, решив, что они принадлежат еще не открытым элементам.
В дальнейшем все исправления, сделанные Д. И. Менделеевым, подтвердились. Пустые клетки заполнили вновь открытые элементы, а новые определения атомных весов совпали с теми, которые он предсказал. Это было подлинным торжеством периодического закона.
Осталось только три места в таблице, где нарушался порядок возрастания атомных весов. Кобальт стоял впереди никеля, теллур — впереди иода и аргон — впереди калия, хотя атомные веса у первых больше, чем у вторых. Почему это так?
Ответ был найден позднее, когда наукой было открыто и изучено внутреннее строение атомов.
О том, как построены отдельные атомы, долгое время высказывались лишь различные научные гипотезы. Так, например, полтора века назад английский врач и химик Проут считал, что атомы всех химических элементов построены из атомов водорода, как наиболее легких. Недостаточно точно определенные в то время атомные веса у многих элементов были действительно кратными атомному весу водорода.
Однако позднее, когда атомные веса были определены более точно, оказалось, что для большинства элементов атомные веса не целые, а дробные числа по отношению к весу водорода. Гипотеза Проута лишилась своей опоры и была надолго забыта.
Лишь в начале нашего века, после того как были найдены пути «проникновения» внутрь атомов, удалось получить правильное представление об их строении. Атом оказался телом, состоящим из заряженного положительным электричеством ядра, вокруг которого на некотором расстоянии вращаются отрицательно заряженные частицы—электроны. В очень маленьком (по отношению ко всему атому) по своим размерам ядре сосредоточена основная масса атома. Электроны почти в две тысячи раз легче даже самого маленького ядра — ядра атома водорода. Они существенного вклада в массу атома не вносят.
Отрицательный заряд электрона — это самая маленькая порция, «атом электричества». Имеется и равный ему по величине, но положительного знака заряд. Это — так называемый позитрон. Положительный заряд ядра атома водорода и по величине и по знаку равен заряду одного позитрона. Заряд ядра атома водорода по величине равен также заряду электрона, но противоположен ему по знаку.
Заряд электрона можно условно принять за единицу отрицательного электричества, а заряд ядра водорода — за единицу положительного электричества.
А каковы заряды других атомных ядер?
Исследование этого вопроса показало, что заряды ядер различных элементов различны. И самым интересным оказалось то, что величина заряда ядра любого элемента (в выбранных нами единицах) в точности равна номеру клетки, которую этот элемент занимает в периодической таблице. Порядковый номер элемента имеет, таким образом, глубокий физический смысл: он равен заряду ядра атома. Заряд ядра — вот то внутреннее свойство атома, которое искал Д. И. Менделеев.
Заметим, кстати, что когда были проверены заряды ядер у кобальта, никеля, теллура, иода, аргона и калия, то обнаружилось, что они должны занимать в соответствии с величиной заряда как раз те клетки, куда их поместил Менделеев.
Периодическая система ныне включает в себя 102 химических элемента. Она состоит из семи периодов. Первый из них содержит два элемента, второй и третий по восьми, четвертый и пятый по восемнадцати, шестой — тридцать два и седьмой (незаконченный) — шестнадцать элементов. В пределах каждого периода свойства элементов с увеличением атомного веса закономерно меняются: металлические свойства ослабляются, а неметаллические — усиливаются. Характер изменения свойств одинаков для всех периодов. Каждый период начинается с щелочного металла (литий, натрий, калий, рубидий, цезий, франций) и заканчивается инертным газом (гелий, неон, аргон, криптон, ксенон, радон).
Рассмотрим атом самого легкого элемента — водорода. Его порядковый номер в таблице—первый. Положительный заряд его ядра равен единице. Так как атом в целом электрически нейтральный, то в нем должен присутствовать еще такой же по величине отрицательный заряд. Так в действительности и есть. Вокруг ядра водорода вращается единственный электрон. Ядро водорода называют обычно протоном (от греческого слова «протос» — первый), а атом водорода соответственно называют— протий. Этими названиями в дальнейшем мы будем пользоваться.
Кислород занимает восьмую клетку таблицы, значит, заряд его ядра в восемь раз больше заряда протона. Вокруг ядра в атоме кислорода вращается восемь электронов.
Таким образом, зарядом ядра определяется не только место положения атома в периодической таблице элементов, но и число электронов, входящих в состав атома. При переходе от элемента к элементу, с возрастанием порядкового номера растут заряды ядер, растет и число электронов, движущихся вокруг ядра. Атом каждого последующего элемента в периодической таблице имеет на один электрон больше предыдущего.
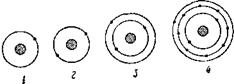
В атоме гелия два электрона, вращаясь вокруг ядра, они образуют однослойную электронную оболочку. С возрастанием числа электронов структура электронной оболочки усложняется. Начиная с третьего по порядку элемента — лития, который открывает второй период таблицы, электроны в оболочке располагаются уже не в один, а в два слоя. У натрия и далее вплоть до аргона (третий период) электроны в атомах образуют три слоя. А в атоме урана, стоящем в седьмом периоде, из 92 электронов строится семислойная оболочка (рис. 3). Часто в клетках таблицы Менделеева около каждого элемента помещаются колон-
Ки цифр, указывающие, какое число электронов размещается в каждом слое.
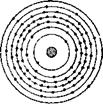 Электроны, образующие самый внешний слой электронной оболочки атома, находятся дальше других от ядра и ме -
Электроны, образующие самый внешний слой электронной оболочки атома, находятся дальше других от ядра и ме -
|
|
|
Рис. 3. Схемы электронных оболочек атомов: 1 — водорода, 2 — гелия, 3 — лития, 4 — натрия, 5 — урана. |
Нее прочно с ним связаны. Электроны внутренних слоев крепче удерживаются ядром, их труднее вырвать из атома, чем электроны внешнего слоя.