ТЕХНОЛОГИЯ МИНЕРАЛЬНЫХ УДОБРЕНИЙ
ИЗОХРОНЫ РАСТВОРЕНИЯ ДИКАЛЬЦИЙФОСФАТА В ЧАСТИЧНО АММОНИЗИРОВАННЫХ РАСТВОРАХ ФОСФОРНОЙ КИСЛОТЫ
Ранее было показано [1], что при введении в фосфорно - кислотный раствор ионов аммония можно получить в дигид - ратном режиме растворы с концентрацией 38—42% Р2О5.
При этом технологические показатели процесса экстракции остаются на высоком уровне, а фильтрующие свойства фосфогипса улучшаются.
Равновесие в системе СаО—Р2О5—NH3—Н20, как и частных составляющих ее систем, изучено весьма подробно в широком диапазоне температур и концентраций компонентов [2, 3, 4]. Однако в литературе не обнаружили данных о свойствах неравновесных растворов в указанной системе при изменении содержания аммиака в области, далекой от образования насыщенных растворов. Такие сведения необходимы для регулирования концентрационного режима экстракции, а также промывки фосфогипса в условиях непрерывного разбавления раствора, когда возможно выделение в твердую фазу дикальцийфосфата, что связано с потерями Р205 и ухудшением условий фильтрования осадка.
Ниже приводятся результаты экспериментального исследования, имевшего своей целью определение неравновесной концентрации Са+2 (выраженной через СаО) в частично аммонизированных растворах фосфорной кислоты, твердая фаза которых соответствует дикальцийфосфату.
Опыты проводили, изменяя концентрации компонентов в следующих пределах: Р205— 5—20%, NH3 — 0—2,2%. Температуру варьировали от 40 до 80 °С. В опытах использовали ортофосфорную кислоту, окись кальция и моноаммонийфос - фат марки х. ч.
Определенное количество раствора заданного состава заливали в трехгорлую колбу, снабженную мешалкой и установленную в термостат. Раствор термостатировали в течение 30—40 мин. Постоянство температуры в термостате поддерживали с точностью до ±0,1 °С. По истечении указанного времени в раствор вносили заведомо избыточное количество окиси кальция.
Продолжительность перемешивания суспензии, характеризовавшаяся достижением практически неизменяющейся в нескольких последовательно отобранных пробах концентрации окиси кальция, составляла 1—2 ч. Как известно, установление в подобной системе истинного равновесия связано с более длительным временем контакта твердой и жидкой фаз [2]. Принятая продолжительность проведения опытов, а также характеристики растворов соответствуют осуществлению процесса в реальных условиях. При этом, как показали результаты определения растворимости СаО, в отсутствие ионов аммония, при концентрации фосфорной кислоты 5 и 10%.
Р2О5 и температуре 40 °С достигаемые значении концентрации СаО соответствуют концентрации насыщенных растворов [2].
Изохроны растворимости окиси кальция в частично аммонизированных растворах фосфорной кислоты определяли с применением метода математического планирования, используя полный факторный эксперимент [5]. Растворимость окиси кальция исследовали в зависимости от изменения концентрации в растворе аммиака (Cn), Р2О5 (Ср) и температуры (/). Одновременно фиксировали значения рН исходных (рН°) и конечных растворов. Верхний предел содержания аммиака в растворе установлен на основании предварительных опытов, показавших, что при концентрации 2,5% NH3 растворимость соединений кальция резко уменьшается и приближается к нулю.
В результате проведения опытов по матрице полного факторного эксперимента, проверки значимости коэффициентов и адекватности модели получена следующая зависимость в виде неполного квадратичного уравнения растворимости окиси кальция (Усао) в аммонизированной фосфорной кислоте:
Уса0 = 1,803—0,788л:, +1,252*2—0,197х3— —0,249x^2+0,1 ОЗх, х3- -0,092Х2Х3,
Где *ь х2, х3, соответственно, кодированные [5] значения факторов Cn, Ср, t.
Значения растворимости окиси кальция, рассчитанные по полученному уравнению, приведены в таблице.
Полученные данные указывают на неравновесное (пересыщенное) состояние образующихся растворов. Лишь при концентрации кислоты до 10% Р205 при 40 °С содержание окиси кальция в отсутствие ионов аммония за 2 ч достигает равновесного его значения. Во всех остальных случаях оно больше, чем при равновесии. Относительное пересыщение растворов сравнительно невелико и составляет в среднем 3,5—4,5% при 40 °С и 6—10% при 80 °С. В остальном данные о растворимости окиси кальция в разбавленных растворах фосфорной кислоты в отсутствие ионов аммония по своему характеру хорошо согласуются с известными сведениями
[4].
В аммонизированных растворах фосфорной кислоты растворимость окиси кальция резко уменьшается и тем в боль-
|
Изохрона растворимости СаО в аммонизированных растворах фосфорной кислоты. Продолжительность контакта фаз — 2 ч
|
|
Температура 40 °С
|
|
Температура 60 °С
|
|
Температура 80 °С
|
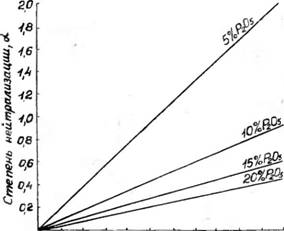
Шей степени, чем больше концентрация аммиака, меньше концентрация кислоты и выше температура. С увеличением концентрации NH3 в фосфорной кислоте от нуля до 2,2% растворимость окиси кальция уменьшается при концентрации 10 и 15—20% Р2О5 соответственно в 5—3 раза и 2,5—2 раза, в меньшей мере изменяется в зависимости от температуры (см. таблицу). Это. очевидно, связано с увеличением степени нейтрализации фосфорной кислоты или, что то же самое, величины мольного отношения аммиака и фосфорной кислоты в растворе (а). В диапазоне изменения содержания NH3 от 0,2 до 2,2% величина а прямолинейно возрастает в зависимости от концентрации NH3 при всех изученных концентрациях кислот (рисунок). Как видно, использованные аммонизированные растворы фосфорной кислоты представляют собой при концентрации 5% Р205 и содержании NH3— 1,2% смеси фосфорной кислоты и моноаммоннйфосфата, при большем содержании NH3 смешанные растворы моно - и диаммо - нийфосфата, а при концентрациях 10, 15 и 20% Р2О5 во всем диапазоне изменения концентрации NH3 только смеси фосфорной кислоты и моноаммонийфосфата.
Влияние степени нейтрализации фосфорной кислоты, выраженной величиной ос, или содержания фосфатов аммония на изохронную растворимость окиси кальция является слож
|
|
|
О |
|
О, г о4 о, є о, а іо іг і, в sp гг Концентрация A/H3t% |
Степень нейтрализации фосфорной кислоты в зависимости от содержания аммиака
Ным, зависит от природы взаимодействия компонентов в растворе, обусловленного главным образом концентрацией раствора. Анализ экспериментальных данных показал, что в исследованной области изменения температуры изохронная растворимость окиси кальция является аддитивной величиной значений растворимости ее в растворах моноаммонийфосфата и фосфорной кислоты в пределах изменения ос от О до 1 при значениях концентрации фосфорной кислоты, не превышающих 10% Р2О5. В этих условиях, по-видимому, смешение растворов моноаммонийфосфата и фосфорной кислоты не приводит к их взаимодействию. При этом значения растворимости, рассчитанные исходя из правила аддитивности, фактически совпадают с экспериментальными данными.
Например, изохронная растворимость СаО (Ур) при температуре 40 °С, концентрации фосфорной кислоты 5% Р2О5 и содержании аммиака 1% (а=0,837) будет равна УР=С[а+ +С2(1—а) =0,664-0.837+1,447(1—0,837) =0,791 (%), где Сі и С2— соответственно растворимости СаО в растворе моноаммонийфосфата заданной концентрации (а=1) и в растворе чистой фосфорной кислоты (а=0), % (данные табл.).
Полученная величина Ур не отличается от опытной величины, приведенной в таблице.
В более концентрированных растворах, содержащих 15, 20% Р2О5, а также при наличии в разбавленных растворах диаммонийфосфата условие аддитивности не соблюдается.
Известно [11, что осуществление процесса экстракции фосфорной кислоты в присутствии ионов аммония приводит к образованию крупных хорошо фильтрующих кристаллов дигидрата сульфата кальция. Это можно объяснить, исходя из полученных данных о характере влияния ионов аммония на растворимость фосфатов кальция. При взаимодействии серной кислоты с пульпой, жидкая фаза которой представляет собой раствор монокальцийфосфата в фосфорной кислоте, образование кристаллов сульфата кальция будет происходить при тем меньшем содержании ионов кальция в жидкой фазе, чем больше ионов аммония в фосфорнокислот - ном растворе. По-видимому, именно это способствует образованию более крупных кристаллов фосфогипса, облегчающих фильтрование реакционных пульп и промывку осадка.
Таким образом, результаты выполненного исследования позволяют оценивать растворимость соединений кальция и условия применения частично аммонизированных растворов фосфорной кислоты концентрации 5—20% Р2О5 на различных стадиях экстракции ее из природных фосфатов.
[1] Вязкость раствора, содержащего 64°/0 Р205, определена нами экстраполяцией данных [11].